- المفاهيم والمصطلحات :
عزيزي الطالب ستتعرف في هذا الدرس على هذه المفاهيم والمصطلحات العلمية :
|
الذرات |
Atoms |
|
النموذج الذري |
Atomic Model |
|
نموذج دالتون |
Dalton’s Model |
|
انبوب التفريغ الكهربائي |
Cathode Ray Tube |
|
نموذج ثومسون |
Thomson’s Model |
|
جسيمات ألفا |
Alpha Particles |
|
نموذج رذرفورد النووي |
Rutherford’s Nuclear Model |
|
النيوترونات |
Neutrons |
|
النواة |
Nucleus |
|
النظائر |
Isotopes |
|
النظائر المشعة |
Radioactive Isotopes |
الدرس الأول: مكونات الذرة :(Components of Atom)
- النماذج الذرية : ( Atomic Models)
- توجد المواد في الطبيعة بأشكال مختلفة مثل العناصر والمركبات، وتتكون جميعها من وحدات متناهية في الصغر تسمى الذرات، ونظرًا إلى صعوبة رؤية الذرات وتعرف مكوناتها؛ فقد درس العلماء المادة بطرائق غير مباشرة وتوصلوا إلى بعض النظريات التي تبين مكونات الذرة وبنيتها، ووضع كل منهم نموذجًا يعبر عن أرائه حول بنية الذرة ومكوناتها أطلق عليه اسم النموذج الذري
- النموذج الذري (Atomic Model) : وهو تمثيل تخطيطي للجسيمات التي تتكون منها الذرة وأماكن تواجدها، والشكل الآتي يبين بعض النماذج الذرية :
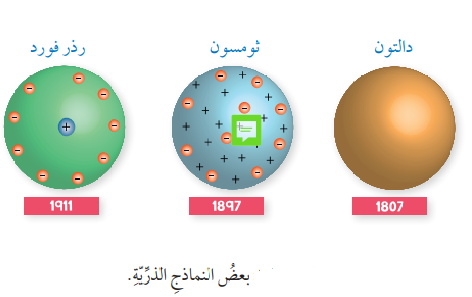
- نظرية دالتون الذرية (Dalton’s Atomic Theory) :
- أجرى العالم جون دالتون كثيرًا من الدراسات والتجارب؛ للتعرف إلى بنية الذرة ومكوناتها، ورصد كثيرًا من المشاهدات والملاحظات التي تعتمد على نتائج التجارب العملية، وتوصل إلى نظرية سميت بنظرية دالتون .
- الفرضيات التي تضمنتها نظرية دالتون :
- تتكون المواد من جسيمات كروية صغيرة غير قابلة للتجزئة تسمى الذرات
- تتشابه ذرات العنصر الواحد في الشكل والكتلة والحجم
فمثلًا : عنصر النحاس يتكون من ذرات نحاس متشابهة والشكل الآتي يمثل ذرات النحاس كما في الشكل الآتي:

- تمتلك ذرات العناصر المختلفة كتلًا مختلفة.
- يتكون المركب الكيميائي من إرتباط ذرات العناصر المختلفة بنسبٍ عددية صحيحة ثابتة، مهما إختلفت طرائق تكوينه
- بناءً على تلك الفرضيات؛ وضع دالتون تصورًا للذرة حيث وصفها بأنها :
" جُسيم كروي متناهٍ في الصغر لا يمكن تجزئته إلى أجزاء أصغر منه " وعبر عن ذلك بنموذج سمي بنموذج دالتون
- نموذج دالتون (Dalton’s Model):
وصف الذرة بأنها جُسيم كروي متناهٍ في الصغر لا يمكن تجزئته إلى أجزاء أصغر منه
- الشكل الآتي يبين نموذج دالتون :

سؤال (1):
أصف نموذج دالتون للذرة :
الإجابة:
وصف الذرة بأنها جُسيم كروي متناهٍ في الصغر لا يمكن تجزئته إلى أجزاء أصغر منه كما في الشكل الآتي:

- تجارب التحليل الكهربائي (Electrolysis Experiments) :
- أجرى العالم مايكل فارادي تجارب تبين أثر تمرير تيار كهربائي في محاليل المركبات الأيونية ومصاهيرها، وقد أشارت نتائج هذه التجارب إلى أن للمواد طبيعة كهربائية أي أنها : " تحتوي على جسيمات مشحونة "
فمثلًا: عند إجراء تحليل كهربائي لمصهور بروميد الرصاص PbBr2 بإستخدام أقطاب الكاربون كما في الشكل الآتي :
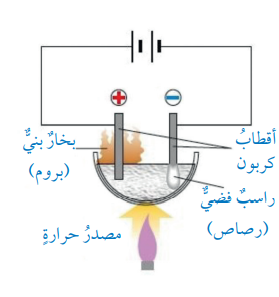
- فإن أيونات البروميد السالبة Br- تتجه إلى القطب الموجب (المصعد) وتتحول عنده إلى بخار البروم Br2 البني اللون أي أنه أصبح متعادلًا كهربائيًا؛ ما يشير إلى فقده الشحنة السالبة .
- تتجه أيونات الرصاص Pb2+ إلى القطب السالب (المهبط) وتتحول عنده إلى ذرات الرصاص Pb المتعادلة كهربائيًا مكونة راسب فضي اللون، ما يشير إلى أنها أكتسبت شحنات سالبة أدت إلى تعادلها .
- بذلك، جرى التوصل إلى أن " الذرة تحتوي جسيمات سالبة يمكن أن تفقدها أو تكتسبها عند تفاعلها"
"وقد جرى لاحقًا إثبات وجود هذه الجسيمات والتعرف إلى خصائصها وأطلق عليها إسم الإلكترونات"
سؤال (2):
أوضح ما توصلت إليه تجارب التحليل الكهربائي:
الإجابة:
- جرى التوصل إلى أن : " الذرة تحتوي جسيمات سالبة يمكن أن تفقدها أو تكتسبها عند تفاعلها" أطلق عليها فيما بعد إسم الإلكترونات
- التجربة (1) : التحليل الكهربائي لمحلول كلوريد النحاس :
- الهدف من التجربة :
أستدل على وجود الشحنات السالبة في الذرة
- المواد والأدوات المستخدمة :
- كأس زجاجية 250 ml
- أقطاب كربون
- أسلاك توصيل
- محلول كلوريد النحاس CuCl2 (تركيزه 1M)
- بطارية 6 v
- مخبار مدرج
- خطوات العمل :
- أقيس. بإستخدام المخبار المدرج 150 ml من محلول كلوريد النحاس، وأضعها في الكأس الزجاجية
- أصل كلًا من قطبي الكربون بسلك توصيل بطول مناسب، وأضع القطبين في المحلول.
- ألاحظ. أصل الأسلاك بالبطارية كما في الشكل الآتي، وأُلاحظ ما يحدث في الوعاء وأسجل ملاحظاتي
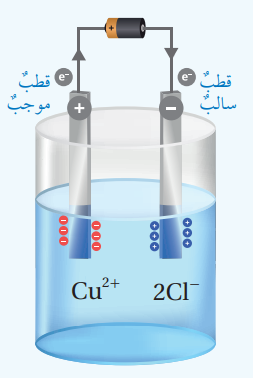
- التحليل والإستنتاج :
1) أصف. ما يحدث عند قطب الكربون المتصل بالقطب السالب للبطارية ؟
2) أصف. ما يحدث عند قطب الكربون المتصل بالقطب الموجب للبطارية ؟
3) أُفسر. دور الإلكترونات في حدوث التغيرات عند كل من القطبين ؟
- الملاحظات على التجربة :
1) تتحرك أيونات النحاس الموجبة Cu2+ نحو القطب السالب (المهبط)، حيث تكتسب الأيونات الموجبة الشحنات السالبة وتكون ذرات النحاس المتعادلة Cu
2) تتحرك أيونات الكلور السالبة Cl- نحو القطب الموجب (المصعد) حيث تفقد الشحنات السالبة وتتحول إلى جزيئات متعادلة Cl2
3) ساعدت في إستخلاص الفلزات من خاماتها حيث تم إستخلاص فلز النحاس وتكوين غاز الكلور
- تجارب التفريغ الكهربائي (Electrical Discharge Experiments) :
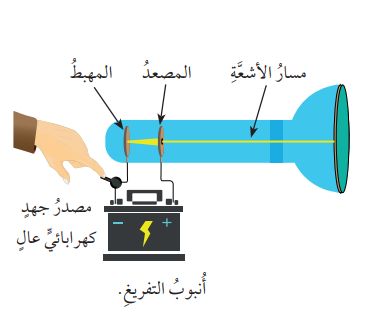
- أُنبوب التفريغ الكهربائي (Cathode Ray Tube):
- هو أنبوب زجاجي يحتوي على غاز معين تحت ضغط منخفض جدًا، مزود بصفيحة فلزية تمثل القطب السالب، وصفيحة أخرى تمثل القطب الموجب، وعند توصيل القطبين بالمصدر الكهربائي؛ يلاحظ إنطلاق حزمة من الأشعة داخل الأُنبوب الزجاجي كما في الشكل الآتي :
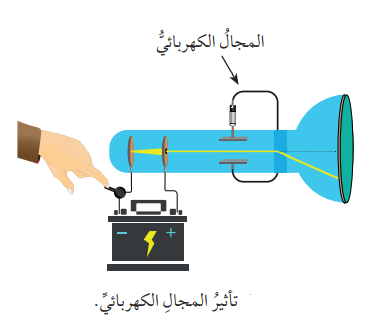
- عند التأثير عليها بمجال كهربائي تنحرف مبتعدةً عن القطب السالب للمجال الكهربائي كما في الشكل الآتي :
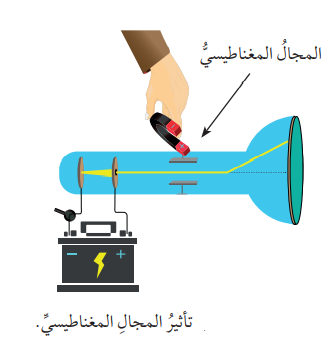
- عند التأثير عليها بإستخدام مجال مغناطيسي، فإنها تنحرف مبتعدة عن مسارها أيضًا، كما في الشكل الآتي :
- درس العلماء أثر تمرير تيار كهربائي ذي جهد كهربائي عالٍ في أُنبوب تفريغ كهربائي وقد توصل العلماء في هذه التجارب إلى أن " هذه الأشعة جسيمات متناهية في الصغر، تحمل شحنات سالبة وتتحرك بسرعة عالية جدًا "
- وقد أجريت العديد من التجارب بإستخدام أنابيب التفريغ الكهربائي للتعرف إلى خصائص أخرى لهذه الأشعة وجرى التوصل إلى أن " خصائص هذه الأشعة لا تتغير بتغير نوع الصفيحة المكونة للمهبط في أُنبوب التفريغ، أو بتغير نوع الغاز المستخدم في الأُنبوب؛ ما يؤكد أن هذه الجسيمات (الإلكترونات) موجودة في ذرات العناصر جميعها "
- التجربة (2) : التفريغ الكهربائي :
- الهدف من التجربة :
أتعرف إلى الأشعة المهبطية (الإلكترونات)
- المواد والأدوات المستخدمة :
- أُنبوب تفريغ كهربائي
- أسلاك توصيل
- ملف رومكورف
- مغناطيس
- خطوات العمل :
- أصل أنبوب التفريغ الكهربائي مع ملف رومكورف، مع إبقاء الدارة مفتوحة كما في الشكل الآتي:
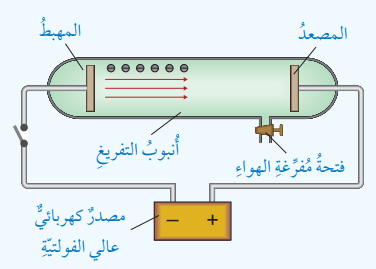
- ألاحظ. أغلق الدارة الكهربائية، وألاحظ ظهور حزمة من الأشعة داخل أُنبوب التفريغ وأسجل ملاحظاتي
- ألاحظ. أُقرب أحد قطبي المغناطيس من أُنبوب التفريغ الكهربائي، وألاحظ ما يحدث للحزمة الضوئية
- أقرب القطب الأخر للمغناطيس من أنبوب التفريغ، وأسجل ملاحظاتي
- أفتح الدارة الكهربائية، وأفصل التيار الكهربائي عن ملف رومكورف، وأنزع أنبوب التفريغ
- التحليل والإستنتاج :
1) أُفسر. ظهور حزمة من الأشعة بين القطبين عند تمرير التيار الكهربائي في أُنبوب التفريغ ؟
2) أُوضح. أثر المجال المغناطيسي في مسار الأشعة
3) أستنتج. بعض خصائص الأشعة التي تظهر في أنبوب التفريغ ؟
- الملاحظات على التجربة :
1) توصل إلى وجود الجسيمات سالبة الشحنة " الإلكترونات".
2) تنحرف الأشعة مبتعدةً عن مسارها.
3) أ) تنتقل الأشعة في خط مستقيم.
ب) جسيمات تمتلك طاقة حركية.
جـ) جسيمات مشحونة بشحنة سالبة وتتأثر بالمجال المغناطيسي إذا قرب من مسارها.
د) لا تتغير خصائص الأشعة الناتجة عند تغيير مادة المهبط المصنوع منها، وهذا يعني أنها موجودة في كل الذرات.
- نموذج ثومسون (Thomson’s Model):
- استمر نموذج دالتون لمدة من الزمن، إلى أن جاء العالم ثومسون الذي أثبت وجود جسيمات سالبة الشحنة تتكون منها الذرات.
- بما أن الذرات متعادلة الشحنة الكهربائية، فلا بد من وجود شحنات موجبة تعادل الشحنات السالبة التي جرى إثبات وجودها ما دعاه إلى إقتراح نموذج ذري جديد، أُطلق عليه إسم نموذج ثومسون
- نموذج ثومسون (Thomson’s Model) : الذي يفترض فيه :
" أن الذرة كرة متجانسة من الشحنات الموجبة، غُرس فيها عدد من الإلكترونات سالبة الشحنة "
- الشكل الآتي يوضح نموذج ثومسون :
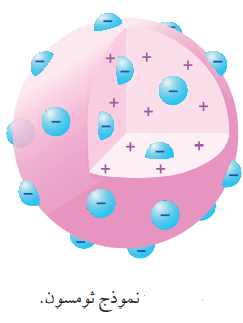
سؤال (3):
أصف نموذج ثومسون للذرة :
الإجابة:
أن الذرة كرة متجانسة من الشحنات الموجبة، غُرس فيها عدد من الإلكترونات سالبة الشحنة كما في الشكل الآتي :

- نموذج رذرفورد النووي (Rutherford’s Nuclear Model):
- لم يمضي على نموذج ثومسون زمن طويل، حتى جاء العالم إرنست رذرفورد بنموذج أكثر قبولًا حيث :
- أطلق جسيمات ألفا بإتجاه صفيحة رقيقة من الذهب، وكان من المتوقع أن تعبر جسيمات ألفا بشكل مستقيم خلال صفيحة الذهب، إلا أن ما شاهده هو :
- أن معظم جسيمات ألفا تمر عبر صفيحة الذهب إلى الجهة المقابلة بشكل مستقيم.
- وأن عدد قليل من هذه الجسيمات إنحرف عن مساره .
- وأن عدد قليل جدًا من هذه الجسيمات ارتد إلى الخلف.
ملاحظة (1) :
جسيمات ألفا (Alpha Particles) : هي جُسيمات موجبة الشحنة وعالية السرعة تنبعث من ذرات العناصر المشعة .
- الشكل الآتي يبين نتائج تجربة رذرفورد :
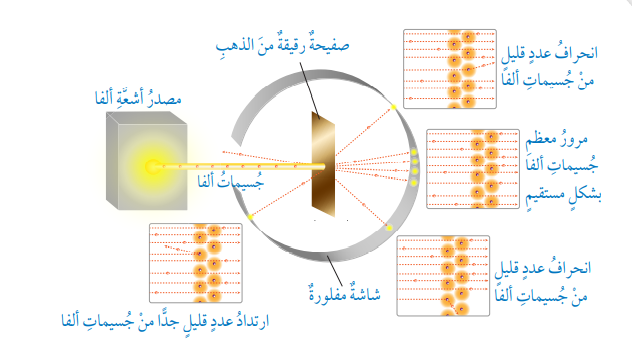
- بناءً على هذه النتائج؛ تمكن رذرفورد من تطوير نموذج جديد لبنية الذرة أُطلق عليه إسم نموذج رذرفورد النووي
- نموذج رذرفورد النووي إفترض أن :
" الذرة لها نواة صغيرة جدًا مشحونة بشحنة موجبة، تتركز فيها كتلة الذرة وتدور حولها الإلكترونات سالبة الشحنة وأن معظم حجم الذرة فراغ"
- الشكل الآتي يبين نموذج رذرفورد النووي :
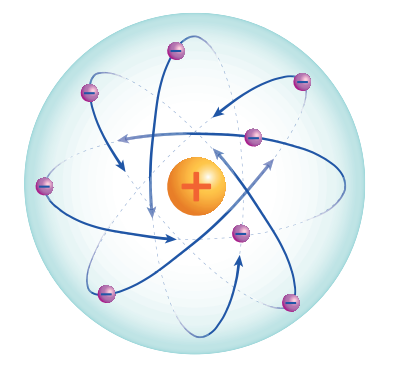
سؤال (4):
ما سبب إرتداد بعض جسيمات ألفا عن مسارها :
الإجابة:
بسبب وجود جزء ذو كثافة عالية ويشغل حيزًا صغيرًا جدًا وتتركز فيه كتلة الذرة والتي عرفت بنواة الذرة
- استمرت الدراسات والأبحاث حول مكونات الذرة فقد تمكن العالم شادويك من قذف صفيحة صفيحة من البيريليوم بجسيمات ألفا وتوصل إلى : " إنطلاق إشعاعات على شكل جسيمات متعادلة الشحنة سميت بـ النيوترونات "
- بذلك، جرى التوصل إلى أن :
- الذرة هي أصغر جزء من العنصر تحمل صفاته
- كل عنصر مكون من نوع واحد من الذرات
- كل ذرة تتكون من ثلاث أنواع من الجسيمات؛ وهي (البروتونات، النيوترونات، الإلكترونات)
- قد دُرست هذه الجسيمات وقورنت كتلتها وشحنتها ببعضها؛ إذ جرى التوصل إلى أن :
- كتلة البروتون مساوية لكتلة النيوترون تقريبًا
- شحنة الإلكترون تساوي شحنة البروتون عدديًا وتخالفها بالإشارة فالإلكترون سالب الشحنة والبروتون موجب الشحنة
- الجدول الآتي يبين شحنة مكونات الذرة وكتلتها النسبية
|
الجُسيم |
الشحنة
|
الكتلة النسبية |
|
البروتون |
1 +
|
1 |
|
النيوترون |
0
|
1 |
|
الإلكترون |
1 -
|
1840/1 |
- وقد وجد أن البروتونات والنيوترونات تتمركز في وسط الذرة في ما يسمى بـالنواة Nucleus بينما توجد الإلكترونات حول التواة وتتحرك في مسارات محددة
- الشكل الآتي يبين التركيب العام للذرة :

سؤال (5):
1) أُوضح نموذج رذرفورد:
2) أُفسر سبب مرور معظم جُسيمات ألفا خلال صفيحة الذهب
الإجابة:
1) الذرة لها نواة صغيرة جدًا مشحونة بشحنة موجبة، تتركز فيها كتلة الذرة وتدور حولها الإلكترونات سالبة الشحنة وأن معظم حجم الذرة فراغ كما في الشكل الآتي :

2) لأن معظم حجم الذرة فراغ
- النظائر (Isotopes) :
- النظائر: هي عناصر يكون لذراتها العدد الذري نفسه، ولكنها تختلف في العدد الكتلي لإختلاف عدد النيوترونات في أنويتها
- تحتوي ذرات العنصر على عدد من البروتونات مساوٍ لعدد الإلكترونات فيها
- قد وجد أن بعض العناصر قد تحتوي على أعداد مختلفة من النيوترونات في بعض أنوية ذراتها أي أن لها العدد الذري نفسه ولكنها تختلف في العدد الكتلي ويطلق على هذه العناصر إسم النظائر وقد يكون للعنصر نفسه نظيران أو أكثر فمثلًا :
- عنصر الكلور له نظيران (Cl- 35, Cl- 37) ويمكن التعبير عنهما على النحو الآتي : Cl1735 ، Cl1737
الجدول الآتي يبين نظائر الكلور :
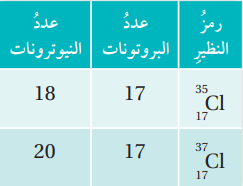
- عنصر الكربون له ثلاث نظائر، جميعها تمتلك العدد نفسه من البروتونات ولكنها تختلف عن بعضها في عدد النيوترونات
فالكربون (C – 12) يوجد في نواته 6 نيوترونات ، والكربون (C – 13) يوجد في نواته 7 نيوترونات ، والكربون (C – 14) يوجد في نواته 8 نيوترونات وكل هذه النظائر توجد في الطبيعة بنسبٍ مئوية محددة
- تَبين أن نظائر العنصر الواحد لها الخصائص الكيميائية نفسها لكنها تختلف قليلًا عن بعضها في الخصائص الفيزيائية
- وجد أن ذرات بعض العناصر لها القدرة على إطلاق الإشعاعات بصورة تلقائية وتسمى بالنظائر المشعة ما يؤدي إلى تحللها مع مرور الزمن وتحولها إلى عنصر أخر أكثر إستقرارًا إذا كان الإنبعاث على شكل جسيمات ألفا (α) او بيتا (β)، وبذلك يتغير عدد البروتونات أو النيوترونات أو كلاهما في نواتها ومن ثم يحدث تغير في تركيب النواة ومثال على ذلك :
+ تحلل عنصر اليورانيوم إلى عنصر الثوريوم والمعادلة الآتية توضح ذلك :
- قد تكون الإشعاعات المنبعثة من بعض النظائر المشعة على شكل أمواج كهرومغناطيسية مثل أشعة غاما (γ).
- تستخدم النظائر المشعة في العديد من المجالات الطبية والصناعية وأغراض البحث العلمي
ملاحظة (2) :
النظائر المشعة : هي عناصر لذراتها القدرة على إطلاق الإشعاعات بصورة تلقائية
- الربط مع علوم الأرض :
يعتبر نظير الكربون – 14 من النظائر المشعة، حيث يستخدم في تقدير عمر بعض المواد الموجودة منذ آلاف السنين، والتي يدخل الكربون في تركيبها مثل الخشب والجلود والعظام، وهو ما يسمى بالعمر الكوني لها .
v.الربط بالطب:
تستخدم أشعة غاما () المنبعثة من النظائر المشعة في الأغراض الطبية، مثل التصوير الطبقي .