- المفاهيم والمصطلحات :
عزيزي الطالب ستتعرف في هذا الدرس على هذه المفاهيم والمصطلحات العلمية :
|
سلسلة النشاط الكيميائي |
Chemical Activity Series |
|
تفاعل الإحلال |
Displacement Reaction |
|
تآكل الفلزات |
Metal Corrosion |
|
صدأ الحديد |
Iron Rust |
|
الجلفنة |
Galvanizing |
الدرس الثاني: سلسلة النشاط الكيميائي وتآكل الفلزات : Reactivity Series and Corrosion of Metals)):
- سلسلة النشاط (Reactivity Series)
- تستخدم الفلزات في حياتنا اليومية في مجالات عملية عديدة ومتنوعة ويعتمد استخدام العناصر في المجالات المختلفة على :
أ) خصائصها الكيميائية ب) خصائصها الفيزيائية جـ) نشاطها الكيميائي
- تتفاوت الفلزات في نشاطها الكيميائي خلال تفاعلها مع أكسجين الهواء والماء وحمض الهيدروكلوريك فبعضها :
- نشط جدًا في تفاعله معها مثل :( الصوديوم والبوتاسيوم)
- أقل نشاطًا في تفاعله معها مثل :(الكالسيوم والمغنيسيوم)
- لا يظهر له تفاعل معها مثل :( النحاس والذهب والفضة والبلاتين والتيتانيوم )
ملاحظة (1) :
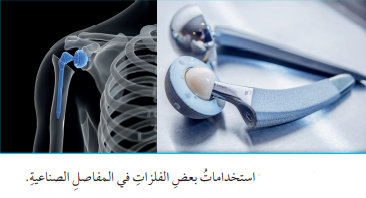
يتميز البلاتين والتيتانيوم بمقاومتهما للتآكل بفعل سوائل الجسم وعدم تفاعلهما معها لذلك، تستخدم في تصنيع الأطراف الصناعية مثل :
( الصفائح ، الدبابيس والبراغي التي يتم إدخالها في جسم الإنسان في عمليات إستبدال مفاصل الورك أو الركبة أو الكتف )
- الصورة الآتية توضح كيفية إستخدام بعض الفلزات في المفاصل الصناعية :
- ترتيب الفلزات في سلسلة النشاط (Arranging the Metal in the Activity Series) :
- يعد الجدول الدوري وسيلة لترتيب العناصر الكيميائية وفقًا للتشابه والإختلاف في خصائصها حيث :
- تتشابه العناصر في المجموعة الواحدة بصورة عامة في خصائصها الكيميائية والفيزيائية لكنها تتفاوت في تلك الخصائص بالإتجاه من الأعلى إلى الأسفل.
- تتدرج عناصر الدورة الواحدة في خصائصها الكيميائية والفيزيائية بالإتجاه من اليسار إلى اليمين..
- سلسلة النشاط الكيميائي (Chemical Activity Series) :
هي طريقة أخرى لترتيب العناصر، وهي " ترتيب الفلزات وفقًا لنشاطها النسبي من الأكثر نشاطًا إلى الأقل نشاطًا ويطلق عليها سلسلة التفاعلية ".
- يستفاد من سلسلة النشاط الكيميائي بـ:
أ) التنبؤ بتفاعلات العناصر . ب) قدرة العنصر على أن يحل محل عنصر أخر أثناء التفاعل .
- لسلسلة النشاط الكيميائي العديد من التطبيقات العملية مثل :
أ) الحصول على معلومات عن تفاعلات الفلزات مع الماء والحموض .
ب) التنبؤ بكيفية إستخلاص الفلزات من خاماتها .
- تصنع الحلي والمجوهرات المستخدمة في الزينة في حياتنا من فلزي الذهب والفضة وذلك لأنها تحافظ على بريقها ولمعانها مدة طويلة، ما يشير إلى أنها لا تتأثر بالماء أو الهواء الجوي المحيط .
- الحلي والجواهر التقليدية، تصنع من النحاس وفلزات أخرى فنجد أنها تفقد بريقها ولمعانها مع الزمن، وتغطي سطحها طبقة معتمة، وهذا يعني أنها تتفاعل مع الماء والهواء المحيط؛ وهذا يعد مؤشرًا على تفاوت نشاط الفلزات في تفاعلاتها .
- تتفاوت الفلزات في تفاعلها مع أكسجين الهواء والماء وحمض الهيدروكلوريك حيث أن :
- في تفاعل الفلزات مع غاز الأكسجين لاحظنا أن :
- الفلزات الأكثر نشاطًا مثل الصوديوم تتفاعل بسرعة مع مع غاز الأكسجين ويكون تفاعل الكالسيوم أٌقل نشاطًأ أما الذهب فلا يتفاعل مع غاز الأكسجين .
- في تفاعل الفلزات مع الماء لاحظنا أن :
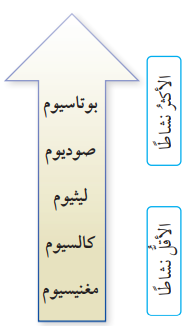
- عناصر المجموعة الأولى تتفاوت في تفاعلها فمثلًا :
- يتفاعل البوتاسيوم بشدة مع الماء .
- يتفاعل الصوديوم بسرعة أقل من البوتاسيوم وبسرعة أكبر من الليثيوم
- عناصر المجموعة الثانية تتفاوت في تفاعلها أيضًا :
- يتفاعل الكالسيوم بسهولة مع الماء
- يتفاعل المغنيسيوم ببطءٍ مع الماء البارد لكنه يتفاعل بسرعة مع بخار الماء
((وعليه يكون الكالسيوم أكثر نشاطًا من المغنيسيوم )).
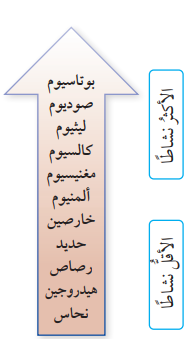
- بناءً على ما سبق فإنه يمكن ترتيب هذه الفلزات وفقًا لتفاعلها مع غاز الأكسجين والماء بحسب نشاطها كما في الشكل الآتي الذي يمثل ترتيب بعض الفلزات وفقًا لنشاطها :
- بالرجوع لموقع هذه العناصر في الجدول الدوري سنجد أن :
- الصوديوم يقع أسفل الليثيوم في المجموعة الأولى، وأن ذرته أكبر حجمًا من ذرة الليثيوم وعليه فإنها تفقد الإلكترونات بسهولة أكثر من الليثيوم وبذلك فهو أكثر نشاطًا من الليثيوم .
- البوتاسيوم يقع أسفل الصوديوم في المجموعة الأولى وهو أكثر نشاطًا من الصوديوم وهذا ينسجم وترتيب هذه العناصر في سلسلة النشاط .
- الكالسيوم يقع أسفل المغنيسيوم في المجموعة الثانية، وعليه فإنه أكثر نشاطًا من المغنيسيوم وهذا ينسجم والنتائج التي تُوصل إليها عن تفاعل كل منهما مع الماء وينسجم وترتيبهما في سلسلة النشاط .
- يعد كلًا من الحديد والألمنيوم والنحاس من الفلزات قليلة النشاط شائعة الإستخدام في حياتنا اليومية.
ملاحظة (2):
انتشر استخدام الحديد في القرن الماضي في صناعة الأبواب والنوافذ وأعمال البناء إلا أنه استبدل به الألمنيوم الذي بات
يستخدم على نطاق واسع في مجال صناعة النوافذ والأبواب وتزيين السقوف .
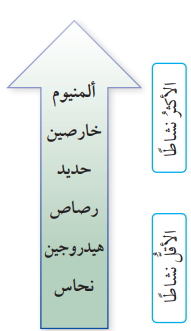
- يستفاد من تفاعلات الفلزات الشائعة الأقل نشاطًا في مقارنة نشاط هذه الفلزات وترتيبها وفقًا لنشاطها حيث أن :
- الألمنيوم أقل نشاطًا من المغنيسيوم .
- الألمنيوم أكثر نشاطًا من الخارصين ، في تفاعله مع محلول الحمض،
- الخارصين أكثر نشاطًا من الحديد، وذلك من خلال مقارنة كمية غاز الهيدروجين الناتجة من تفاعل كمية معينة من الخارصين مع محلول الحمض سنجد أنها أكبر من تلك التي تنتج من تفاعل كمية مماثلة من الحديد خلال المدة الزمنية نفسها.
- الحديد أكثر نشاطًا من الرصاص ، وذلك من خلال مقارنة كمية غاز الهيدروجين الناتجة من تفاعل كمية معينة من الحديد مع محلول الحمض سنجد أنها أكبر من تلك التي تنتج من تفاعل كمية مماثلة من الرصاص خلال المدة الزمنية نفسها.
- النحاس والفضة لا يتفاعلان مع محلول حمض الهيدروكلوريك المخفف
- تتميز الفلزات بأنها تفقد الإلكترونات في أثناء تفاعلها، ويعتمد نشاطها الكيميائي على سهولة فقدها الإلكترونات وهذا يعني أن :
- الفلز الأكثر نشاطًا يفقد الإلكترونات بسهولة أكبر فعند تفاعل الفلز مع محلول حمض الهيدروكلوريك HCl فإن الفلز يفقد الإلكترونات في حين يكتسبها أيون الهيدروجين في محلول HCl ويتكون غاز الهيدروجين فمثلًا :
+ تفاعل الخارصين Zn مع محلول حمض الهيدروكلوريك HCl كما في المعادلة الآتية :
- نلاحظ أن ملح كلوريد الخارصين وغاز الهيدروجين ينتجان هذا التفاعل وهذا يعني أن الخارصين أكثر نشاطًا من الهيدروجين.
وهذا يعني أن :
- الفلز الذي يتفاعل مع محلول الحمض يكون أكثر نشاطًا من الهيدروجين أما الفلز الذي لا يتفاعل مع محلول الحمض يكون أقل نشاطًا من الهيدروجين ؛ وعليه فإنه يمكن ترتيب هذه الفلزات بحسب تفاعلها مع محلول حمض الهيدروكلوريك أو نشاطها بالنسبة للهيدروجين كما في الشكل الآتي الي يبين ترتيب هذه الفلزات وكذلك الهيدروجين وفقًا لنشاطها :
- يمكن دمج الترتيبين السابقين للحصول على سلسلة النشاط الأكثر شمولًا كما في الشكل الآتي الذي يبين جزءًا من
سلسلة نشاط الفلزات :
سؤال (1):
1) أحدد الفلز الأكثر نشاطًا في مجموعة الفلزات الآتية :
( الرصاص، المغنيسيوم، الخارصين، الألمنيوم)
2) اقترح طريقة لتحقق من ذلك
الإجابة :
المغنيسيوم
الإجابة :
اختبار تفاعلها مع حمض الهيدروكلوريك المخفف
حيث تتفاعل الفلزات في محلول حمض الهيدروكلوريك HCl المخفف ، وينتج من التفاعل ملح الفلز ويتكون غاز الهيدروجين H2، حيث تزداد سرعة تفاعل الفلز مع الحمض بزيادة نشاطه وتزداد كمية الهيدروجين الناتجة ويمكن اختبار نشاط الفلزات المذكورة عن طريق مفاعلة كمية متساوية منها مع كمية محددة من الحمض لها التركيز نفسه، ومقارنة سرعة تصاعد غاز الهيدروجين وكميته.
- تفاعلات الإحلال (Displacement Reactions) :
- تعريفه : هو التفاعل الذي يحل فيه العنصر النشط محل العنصر الأقل نشاطًا.
- يشير هذا التفاعل إلى أن : العنصر النشط يحل محل العنصر الأقل نشاطًا في محلول أحد أملاحه أو مركباته أثناء التفاعل.
- يعد تفاعل الفلز مع محلول حمض الهيدروكلوريك مثالًا على هذا النوع من التفاعلات حيث أن:
الفلز الأكثر نشاطًا من الهيدروجين يحل محله في أثناء التفاعل فمثلًا :
- في تفاعل الخارصين مع محلول حمض الهيدروكلوريك يحل الخارصين محل الهيدروجين، وهذا يعني أن الخارصين أكثر نشاطًا من الهيدروجين وأنه يقع فوقه في سلسلة النشاط .
- في تفاعل المغنيسيوم مع محلول كبريتات النحاس (CuSO4) يُلاحظ أن المغنيسيوم يحل محل النحاس، ويتكون راسب من ذرات النحاس وهذا يعني أن المغنيسيوم أكثر نشاطًا من النحاس كما هو موضح من المعادلة الكيميائية الآتية :
- بينما؛ في تفاعل النحاسCu، مع محلول كبريتات المغنيسيوم (MgSO4)؛ لا يحل النحاس محل المغنيسيوم وذلك لأن النحاس أقل نشاطًا من المغنيسيوم .
- يستفاد من هذا النوع من التفاعلات (تفاعلات الإحلال) في:
أ) تحديد نشاط الفلزات الأقل نشاطًا من الهيدروجين،
ب) التنبؤ بمواقع الفلزات في سلسلة النشاط الكيميائي
مثلًا:
عند تفاعل النحاس(Cu) مع محلول نترات الفضة (AgNO3) نجد أن النحاس يحل محل الفضة في المحلول ويتكون راسب من الفضة كما في الشكل الآتي الذي يبين ترسب الفضة على سلك النحاس :

- المعادلة الكيميائية التي تمثل ترسب الفضة على سلك النحاس :
- يمكن إعادة ترتيب الفلزات في سلسلة النشاط الكيميائي كما في الشكل الآتي الذي يبين سلسلة النشاط لعدد من الفلزات الشائعة :
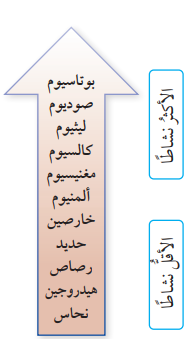
- يتضح مما سبق أنه:
- في تفاعلات الإحلال يمكن للفلز الأكثر نشاطًا أن يطرد الفلز الأقل نشاطًا من مركباته ليحل محله، وبهذا يمكن إستخلاص الفلز الأقل نشاطًا من مركباته باستخدام فلز أخر أكثر نشاطًا فمثلًا :
- عند غمس صفيحة من الخارصين Zn في محلول كبريتات الرصاص (PbSO4)، فإنه يتوقع حدوث تفاعل وذلك لأن :
الخارصين أكثر نشاطًا من الرصاص، وبذلك فإنه يحل محله وينتج الرصاص على هيئة عنصر حر، وهذا يعني أنه يمكن إستخلاص الرصاص من مركباته عند تفاعله مع فلز أخر أكثر نشاطًا من الرصاص كما يتضح من المعادلة الكيميائية الآتية :
- عند غمس صفيحة من النحاس Cu في محلول كبريتات الرصاص(PbSO4) فإنه لا يتوقع حدوث التفاعل وذلك لأن :
النحاس أقل نشاطًا من الرصاص، فلا يمكنه أن يحل محله وبذلك لا يحدث تفاعل ولا يمكن إستخلاص الرصاص من مركباته بإستخدام فلز النحاس .
- تفاعلات التنافس على الأكسجين :
هي التفاعلات التي يمكن من خلالها إستخلاص بعض العناصر قليلة النشاط من أكاسيدها. فمثلًا :
- عند تسخين مسحوق من المغنيسيوم Mg مع مسحوق من أكسيد النحاس CuO فإن المغنيسيوم يحل محل النحاس وينتج أكسيد المغنيسيوم MgO والنحاس كما في المعادلة الآتية :
- الربط بالصناعة :
يستخدم فلز الرصاص في تبطين خزانات السفن لنقل المواد الكيميائية الخطرة، ويستخدم طبقة مبطنة لخزانات حفظ المواد عالية الحموضة، مثل حمضي الفسفوريك والكبريتيك، بسبب قلة النشاط الكيميائي للرصاص ومقاومته للتآكل.

- الربط بالصحة :
المغنيسيوم في الجسم :
- يحمي عنصر المغنيسيوم من الإصابة بالسكري، ويحافظ على انتظام نبض القلب والأوعية الدموية وارتفاع ضغط الدم، كما يمنع تكون الحصى في الجهاز البولي.
- تكمن أهمية هذا العنصر في أن جميع عمليات الطاقة التي تجري في جسم الإنسان يتحكم فيها مركب أدينوسين ثلاثي الفوسفات، الذي يرتبط عمله بالمغنيسيوم.
سؤال (2):
أي التفاعلين الآتين قابل للحدوث بالإعتماد على سلسلة نشاط الفلزات ؟
الإجابة :
التفاعل الثاني لأنه وحسب سلسلة النشاط الكيميائي فإن المغنيسيوم أنشط من الخارصين بالتالي يكون له القدرة على أن يحل مكانه، لكن في التفاعل الأول فإنه وحسب سلسلة النشاط الكيميائي فإن الحديد أنشط كيميائيًا من الرصاص بالتالي فإن الرصاص غير قادر أن يحل مكان الحديد
- تآكل الفلزات (Metal Corrosion) :
- تتفاعل الفلزات مع الهواء الجوي والمواد في البيئة المحيطة، فتفقد العديد من خصائصها وتتحول إلى مواد جديدة أكثر ثباتًا كيميائًا، كأكاسيد الفلزات وهيدروكسيداتها وكبريتيداتها وكربوناتها، لذلك تصنع بعض المعدات مثل الكراسي المتحركة من الفولاذ أو الفلزات الخفيفة كالألمنيوم والتيتانيوم .
- تعريف تآكل الفلز (Metal Corrosion) :
(هو تكون طبقة جديدة على سطح الفلز تنتج من تفاعل الفلز مع مكونات الهواء، ما يجعل الفلز أضعف وأكثر هشاشة)
مثل :
- تآكل الحديد بفعل الهواء الجوي الرطب، فينتج صدأ الحديد الصلب الهش.
- يتآكل النحاس مكونًا طبقة على سطحه تسمى الزنجار كما في الشكل الآتي :

ملاحظة (3) :
إن عملية التآكل هي عملية بطيئة تعتمد على نشاط الفلز وطبيعة المركبات التي تتكون على سطحه نتيجة تفاعله مع مكونات الهواء فمثلًا :
- يتفاعل فلز الكالسيوم مع أكسجين الهواء مكونًا طبقة من أكسيد الكالسيوم لا تمنع إستمرار تآكله .
- يتفاعل فلز الألمنيوم مع أكسجين الهواء مكونًا طبقة من أكسيد الألمنيوم تمنع إستمرار تآكله وتحميه من التآكل.
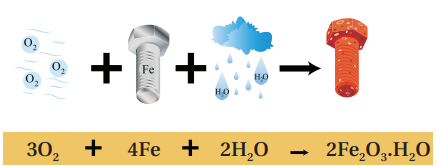
- صدأ الحديد (Iron Rust)
- تعريفه : هو طبقة هشة من أكسيد الحديد (Fe2O3.n H2O) حيث أن n ( تشير إلى عدد جزيئات المرتبطة بأكسيد الحديد ) تنشأ هذه الطبقة على سطح الحديد نتيجة تفاعله مع أكسجين الهواء الجوي بوجود الماء أو بخار الماء كما في الشكل الآتي :

- يتكون الصدأ على سطح الحديد عندما يتفاعل مع الأكسجين والماء، فترتبط ذرات الحديد مع الأكسجين والماء، مُكونة طبقة بُنية هشة على هيئة قشور تتراكم على سطح الحديد تتساقط بمرور الوقت، فينكشف السطح من جديد مُعرضًا للهواء الجوي فيتفاعل مع الأكسجين والماء مرة أخرى وتتكرر هذه العملية تلقائيًا مسببةً تآكل الحديد .
- الشروط الأساسية لتكون صدأ الحديد :
أ) الأكسجين ب) الماء أو بخار الماء
- الشكل الآتي يبين شروط تكون الصدأ :
سؤال (3):
أُحدد الشروط اللازمة لتكون الصدأ :
الإجابة :
توفر الأكسجين والماء أو بخار الماء شرطين رئيسين لتكون الصدأ
سؤال (4):
أٌفسر عدم استخدام الحديد في صناعة أسلاك التوصيل الكهربائي
الإجابة:
لأنه يتفاعل مع مكونات الوسط المحيط مثل الأكسجين والماء، مما يسبب تكون طبقة من صدأ الحديد عيى هيئة قشور تتراكم على سطح الحديد وتتساقط بمرور الوقت مما يسبب تآكل الأسلاك وتقطعها بإستمرار .
- طرائق حماية الفلز من التآكل :( Methods of Metals Protection from Corrosion)
- إن مشكلة تآكل الفلزات تحظى بإهتمام عالمي كبير لما لها من أثار سلبية في الإقتصاد بسبب تلف الفلزات المستخدمة في المجالات الصناعية المختلفة.
- يتكون الصدأ بوجود الأكسجين والماء معًا، ويمكن الحد من تكونه بعزل الحديد عنهما.
- الطرق المتبعة لعزل الحديد ومنع تكون الصدأ :
- طلاء سطح الحديد بطبقة من الدهان أو الشحمة أو تغليفه بطيقة بلاستيكية كما في الشكل الآتي :
| التغليف بطبقة من الدهان | التغليف بطبقة من البلاستيك |
 |
 |
- خلط الحديد بفلزات أخرى مثل الكروم والنيكل لإنتاج سبائك لا تصدأ مثل الفولاذ المقاوم للصدأ .
- تغطية الحديد بطبقة من فلز أخر أكثر نشاطًا من الحديد، مثل : الخارصين حيث يتآكل الفلز بدلًا من الحديد ويحميه من التآكل.
ملاحظة (4) :
تعريف الغلفنة (Galvanizing) :
هي تغطية الحديد بطبقة من فلز أخر أكثر نشاطًا من الحديد، مثل : الخارصين حيث يتآكل الفلز بدلًا من الحديد ويحميه من التآكل. كما في الشكل الآتي :

- طلاء سطح الحديد بطبقة من فلز غير الخارصين، مثل النيكل أو الكروم أو القصدير بإجراء ترسيب كهربائي لها على سطح الحديد بالطلاء الكهربائي .
سؤال (5):
أبين الطرائق المستخدمة في حماية الفلزات من التآكل :
الإجابة:
- طلاء سطح الحديد بطبقة من الدهان أو الشحمة أو تغليفه بطيقة بلاستيكية.
- خلط الحديد بفلزات أخرى مثل الكروم والنيكل لإنتاج سبائك لا تصدأ مثل الفولاذ المقاوم للصدأ .
- تغطية الحديد بطبقة من فلز أخر أكثر نشاطًا من الحديد، مثل : الخارصين حيث يتآكل الفلز بدلًا من الحديد ويحميه من التآكل.
- طلاء سطح الحديد بطبقة من فلز غير الخارصين، مثل النيكل أو الكروم أو القصدير بإجراء ترسيب كهربائي لها على سطح الحديد بالطلاء الكهربائي .
سؤال (6):
لماذا تلصق قضبان من الخارصين بهياكل السفن المصنوعة من الحديد
الإجابة:
لأن الخارصين أكثر نشاطًا من الحديد وعند تعرضهما في الوقت نفسه إلى الماء والهواء فإن الخارصين يتفاعل بسرعة أكبر من الحديد، فيتأكسد ويتآكل بدلًا من الحديد مما يساعد على الحد من تآكل الحديد.
- الإثراء والتوسع :
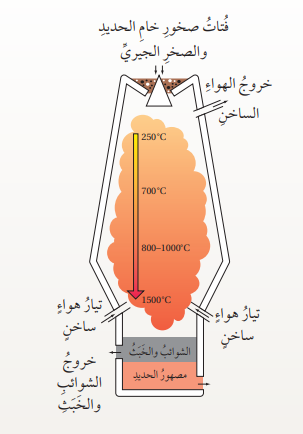
إستخلاص الحديد : (Iron Extraction) :
- الطرق العالمية المستخدمة في إنتاج الحديد :
- يستخرج الحديد من صخور القشرة الأرضية التي تحتوي على خامات الحديد مثل الهيماتيت (Fe2O3) حيث تُكسر الصخور الكبيرة وتطحن، ثم يُنقل خام الحديد المستخلص منها إلى فرن بدرجة حرارة عالية يسمى الفرن اللافح
ويضاف الصخر الجيري (كربونات الكالسيوم CaCo3) لتنقية الحديد الناتج من الشوائب وتتم هذه العملية عبر ثلاث مراحل رئيسية كما يآتي :
1) يُدخل خام الحديد المطحون وفحم الكوك والصخر الجيري من الجزء العلوي في الفرن، ثم تُضخ كمية من الهواء الساخن من خلال أنابيب النفخ الموجودة أسفل الفرن، حيث يتفاعل خام الحديد مع الفحم الحجري (الكوك)، وينتج عن هذا التفاعل ثاني أكسيد الكربون CO2 كما في المعادلة الآتية :
2) يتفاعل غاز ثاني أكسيد الكربون الناتج مع فحم الكوك مرة أخرى لتكوين أول أكسيد الكربون كما في المعادلة الآتية :
3) - يتفاعل غاز أول أكسيد الكربون الناتج CO مع اكسيد الحديد Fe2O3 وينتج من ذلك الحديد المنصهر، وغاز ثاني أكسيد الكربون CO2 كما في المعادلة الآتية :
- يندفع الحديد المنصهر من الفتحات أسفل الفرن لتبريده وتحويله إلى مادة صلبة، ويمكن كتابة معالة التفاعل الكلية على النحو الآتي :
- الشكل الآتي يمثل شكل الفرن اللافح :