- المفاهيم والمصطلحات :
عزيزي الطالب ستتعرف في هذا الدرس على هذه المفاهيم والمصطلحات العلمية :
|
المادة الكهرلية |
Electrolyte |
|
المادة غير الكهرلية |
Non - Electrolyte |
|
التحليل الكهربائي |
Electrolysis |
|
الطلاء الكهربائي |
Electroplating |
خلايا التحليل الكهربائي (Electrolysis Cell) :
- توصيل محاليل المركبات ومصاهيرها للتيار الكهربائي :
- تذكر :
- المركبات الأيونية تتفكك في الماء إلى أيونات موجبة و سالبة وأن محاليلها موصلة للتيار الكهربائي
- محاليل الحموض والقواعد هي محاليل موصلة للتيار الكهربائي .
- المواد الكهرلية (Electrolyte) والمواد غير الكهرلية (Non – Electrolyte):
- المواد الكهرلية (Electrolyte) :
- تعريفها : هي مادة تتفكك إلى أيونات موجبة وسالبة حرة الحركة عند صهرها أو إذابتها في الماء.
- توصيلها للتيار الكهربائي : قدرة هذه الأيونات على التحرك في جميع الاتجاهات وبإتجاه أقطاب مخالفة لها في الشحنة يجعل مصاهيرها ومحاليلها موصلة للتيار الكهربائي.
- الأمثلة على هذه المواد :
1) المركبات الأيونية مثل : NaCl, KBr, AgNO3, KOH
2) الحموض مثل : HCl, H2SO4, HNO3 , HBr , HI
1) المركبات الأيونية مثل : NaCl, KBr, AgNO3, KOH
- مثال للتوضيح :
- يتفكك ملح كلوريد الصوديوم NaCl في الماء بحسب المعادلة الآتية :
- نلاحظ من المعادلة أنه ينتج من ذوبان الملح في الماء أيونات الصوديوم Na+ وأيونات الكلوريد Cl- حرة الحركة
- الشكل الآتي : يوضح تفكك ملح NaCl إلى أيونات حرة الحركة عند ذوبانه في الماء :
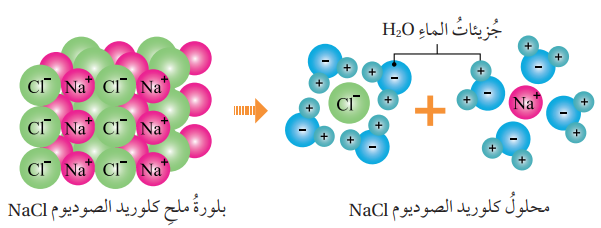
- عند صهر NaCl فإنه يتفكك إلى أيونات حرة الحركة بحسب المعادلة الآتية :
- إن وجود هذه الأيونات حرة الحركة يفسر توصيل محلول ومصهور ملح NaCl للتيار الكهربائي وعليه فإن ملح كلوريد الصوديوم NaCl مادة كهرلية .
2) الحموض مثل : HCl, H2SO4, HNO3 وغيرها تعد مواد كهرلية على الرغم من انها جزيئات متعادلة وليست أيونية، وذلك لأنها تتأين في الماء منتجةً أيونات حرة الحركة .
- مثال للتوضيح :
- توضح المعادلة الآتية تأين حمض HCl في الماء :
- نلاحظ أن حمض HCl قد تفكك إلى أيونات موجبة وسالبة حرة الحركة تجعل له القدرة على إيصال التيار الكهربائي
- الشكل الآتي يوضح توصيل محلول HCl للتيار الكهربائي:
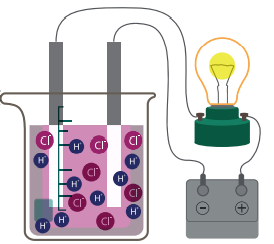
- المواد غير الكهرلية (Non - Electrolyte) :
- تعريفها : هي مادة لا تتفكك إلى أيونات حرة الحركة عند صهرها أو إذابتها في الماء.
- توصيلها للتيار الكهربائي : عدم قدرة هذه المواد على التفكك وإنتاج أيونات حرة الحركة ، ولذلك هذه المواد تكون غير موصلة للتيار الكهربائي.
- الأمثلة على هذه المواد :
- السكر ، الشمع
- الشكل الآتي يوضح الفرق بين المواد الكهرلية والمواد غير الكهرلية :
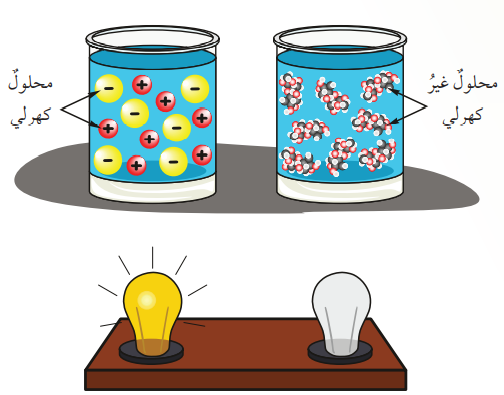
سؤال (1) :
ما الشروط الواجب توافرها في المادة لوصفها بالكهرلية :
الإجابة :
1. تتفكك إلى أيونات موجبة وسالبة حرة الحركة عند صهرها أو إذابتها في الماء
2. مصاهيرها ومحاليلها موصلة للتيار الكهربائي .
سؤال (2) :
هل يعد مصهور الشمع مادة كهرلية :
الإجابة:
الشمع مادة غير كهرلية فهي لا تتفكك إلى أيونات حرة الحركة عند صهرها أو ذوبانها في الماء، لذلك فإن مصاهيرها ومحاليلها غير موصلة للتيار الكهربائي .
- التحليل الكهربائي (Electrolysis) :
- عملية التحليل الكهربائي : إمرار تيار كهربائي في مصهور أو محلول مادة كهرلية يؤدي إلى إحداث تفاعل التأكسد والاختزال .
- خلية التحليل الكهربائي : الدارة الكهربائية المستخدمة في عملية التحليل التحليل الكهربائي وهي النوع الثاني من الخلايا الكهركيميائية، حيث تتحول فيها الطاقة الكهربائية إلى طاقة كيميائية
- الشكل الآتي يمثل شكل خلية التحليل الكهربائي :
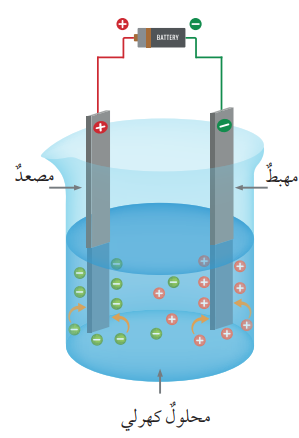
- مكونات خلية التحليل الكهربائي :
- وعاء يحتوي محلولًا أو مصهورًا لمادة كهرلية
- قطبي غرافيت وهما قطبان خاملان لا يتشركان في التفاعل .
- مصعد (Anode) القطب الموجب للبطارية
- مهبط (Cathode) القطب السالب للبطارية
- أسلاك توصيل .
ملاحظة (1) :
قطبي غرافيت وهما قطبان خاملان لا يتشركان في التفاعل وإنما:
- ينقلان الإلكترونات من المحلول أو المصهور الكهرلي وإليه.
- يتصلان ببطارية عبر أسلاك التوصيل بحيث :
- يتصل أحد القطبين بالقطب الموجب للبطارية وهو الصعد
- يتصل القطب الأخر بالقطب السالب للبطارية وهو المهبط
- ألية عمل خلية التحليل الكهربائي :
- عند مرور التيار الكهربائي في المحلول أو المصهور:
- تتحرك الأيونات السالبة بإتجاه القطب الموجب (المصعد)
- تتحرك الأيونات الموجبة بإتجاه القطب السالب (المهبط)
- التفاعلات التي تحدث في خلية التحليل الكهربائي لمصهور مادة كهرلية :
- الأيونات السالبة تتأكسد عند المصعد
- الأيونات الموجبة تختزل عند المهبط
- التفاعلات التي تحدث في خلية التحليل الكهربائي لمحلول مادة كهرلية :
- يحتمل اختزال الأيون الموجب أو الماء عند المهبط
- يحتمل تأكسد الأيون السالب أو الماء عند المصعد
- هنا تختلف نواتج عملية التحليل الكهربائي بسبب وجود الماء
سؤال (3) :
أقارن بين تحولات الطاقة في الخلية الجلفانية وخلية التحليل الكهربائي :
الإجابة:
الخلية الجلفانية :
تتحول فيها الطاقة من الكيميائية إلى الكهربائية
خلية التحليل الكهربائي :
تتحول فيها الطاقة من الكهربائية إلى الكيميائية
سؤال (4) :
أحدد التفاعل الذي يحدث عند كل من المصعد والمهبط في خلية التحليل الكهربائي :
الإجابة:
التفاعل الذي يحدث عند المصعد : تأكسد
التفاعل الذي يحدث عند المهبط : اختزال .
- التحليل الكهربائي لمصهور مادة كهرلية (Electrolysis of Molten Electrolyte) :
عند تمرير تيار كهربائي في مصهور مادة كهرلية، فإن الايونات السالبة تتأكسد عند المصعد والأيونات الموجبة تختزل عند المهبط .
- الأمثلة الآتية توضح التحليل الكهربائي لمصهور المادة الكهرلية:
مثال (1) :
أكتب معادلات كيميائية تمثل التفاعلات التي تحدث على الأقطاب والتفاعل الكلي عند التحليل الكهربائي لمصهور يوديد الرصاص PbI2 ثم أكتب نواتج التحليل الكهربائي له :
الإجابة :
يوديد الرصاص PbI2 مركب أيوني يتفكك عند صهره بالحرارة بحسب المعادلة الآتية :
- شكل خلية التحليل الكهربائي لمصهور يوديد الرصاص :
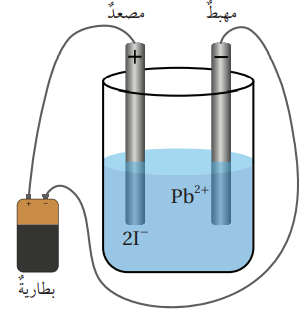
- عند تمرير تيار الكهربائي في المصهور، تتحرك أيونات الرصاص الموجبة Pb2+ بإتجاه المهبط، وتختزل، مكونة ذرات الرصاص Pb
- تتحرك الأيونات السالبة 2I- باتجاه المصعد وتتأكسد، مكونة جزيئات اليود I2
- المعادلات الكيميائية التي تصف التفاعلات الحاصلة على الأقطاب:
- معادلة التفاعل الكلي: هي مجموع نصفي تفاعل التأكسد والاختزال وتكون بالشكل الآتي :
- أي أنه عند التحليل الكهربائي مصهور يوديد الرصاص PbI2 يتكون الرصاص Pb واليود I2
مثال (2) :
أكتب معادلات كيميائية تمثل التفاعلات التي تحدث على الأقطاب عند التحليل الكهربائي مصهور بروميد البوتاسيوم KBr، ثم أكتب نواتج التحليل الكهربائي :
الإجابة :
بروميد البوتاسيوم KBr هو مركب أيوني يتفكك عند صهره بالحرارة بحسب المعادلة الآتية :
- عند تمرير تيار الكهربائي في المصهور، تتحرك أيونات البوتاسيوم الموجبة K+ بإتجاه المهبط، وتختزل، مكونة ذرات البوتاسيوم K بحسب المعادلة الآتية :
- تتحرك أيونات البروميد السالبة Br- باتجاه المصعد وتتأكسد، مكونة جزيئ البروم Br2 بحسب المعادلة الآتية :
- نلاحظ أن عدد الإلكترونات في أنصاف التفاعل غير متساوية لذلك يجب أن :
- نضرب نصف تفاعل الإختزال بـ 2
- نواتج التحليل الكهربائي لمحلول بروميد البوتاسيوم KBr هي تكوُّن البوتاسيوم K والبروم Br2
سؤال (5) :
عند التحليل الكهربائي لمصهور كلوريد الكالسيوم CaCl2
1. أكتب نصفي تفاعل المصعد والمهبط والتفاعل الكلي
2. أحدد نواتج التحليل الكهربائي للمصهور .
الإجابة:
2. نواتج التحليل الكهربائي : الكالسيوم (عند المهبط) ، غاز الكلور ( عند المصعد)
- التحليل الكهربائي لمحلول مادة كهرلية ( Electrolysis of Electrolyte Solution) :
- عند إذابة المادة الكهرلية في الماء؛ فإنها :
- تتفكك إلى أيونات موجبة وسالبة حرة الحركة .
- عند تمرير التيار الكهربائي في محلول المادة الكهرلية :
- يتحرك الأيون الموجب وهو أيون الفلز باتجاه المهبط وهناك إحتمالان وهما :
1. إما أن تختزل أبونات الفلز الموجبة ويتكون الفلز .
2. إما أن يختزل الماء ويتكون غاز الهيدرجين .
- القاعدة المتبعة في تحديد أي الإحتمالين قد يحدث على قطب المهبط هي :
" أن الفلزات أسفل الهيدروجين في سلسلة النشاط الكيميائي هي التي تترسب نتيجة اختزال أيوناتها الموجبة، أما الفلزات فوق الهيدروجين في سلسلة النشاط الكيميائي ؛ لا تختزل أيوناتها وإنما يختزل الماء ويتصاعد غاز الهيدروجين "
- عند المصعد : فإن الأيونات السالبة وتتأكسد مكونة جزيئاتها مثل :
أيونات المجموعة السابعة: أيونات الكلوريد Cl-، أيونات البروميد Br-، أيونات اليوديد I- ، تتأكسد مكونة جزيئات Cl2، Br2، I2
- أمثلة للتوضيح:
مثال (3) :
أستنتج نواتج التحليل الكهربائي لمحلول بروميد النحاس CuBr2 في الماء :
الإجابة :
أكتب معادلة تفكك ملح بروميد النحاس CuBr2 في الماء :
- إذا رجعنا إلى سلسلة النشاط الكيميائي؛ سنجد أن النحاس Cu يقع أسفل الهيدروجين في السلسلة؛ لذلك فإن الإحتمال الأول بالنسبة لحركة الأيون الموجب بإتجاه المهبط هو الذي سيطبق وهو أن أيونات النحاس الموجبة Cu2+ ستتحرك بإتجاه المهبط وتختزل ويتكون النحاس كما في المعادلة الآتية :
- أيونات البروميد السالبة Br- ستتحرك بإتجاه المصعد وتتأكسد، ويتكون البروم كما توضح المعادلة الآتية :
- إن نواتج التحليل الكهربائي لمحلول بروميد النحاس CuBr2 هي :
1. تكون النحاس Cu عند المهبط 2. تكون البروم Br2 عند المصعد
مثال (4) :
أستنتج نواتج التحليل الكهربائي لمحلول كلوريد البوتاسيوم KCl في الماء :
الإجابة :
أكتب معادلة تفكك ملح كلوريد البوتاسيوم KCl في الماء:
- إذا رجعنا إلى سلسلة النشاط الكيميائي؛ سنجد البوتاسيوم K يقع فوق الهيدروجين في السلسلة؛ لذلك فإن الإحتمال الثاني بالنسبة لحركة الأيون الموجب بإتجاه المهبط هو الذي سيطبق وهو أن الماء هو الذي سيختزل عند المهبط ويتكون غاز الهيدروجين H2 وليست أيونات البوتاسيوم الموجبة +K كما توضح المعادلة الآتية :
- أيونات الكلوريد السالبة Cl- ستتحرك بإتجاه القطب الموجب (المصعد) وتتأكسد ويتكون غاز الكلور Cl2 كما توضح المعادلة الآتية :
- إن نواتج التحليل الكهربائي لمحلول كلوريد البوتاسيوم KCl هي :
1. تكون غاز الهيدروجين H2 عند المهبط 2. تكون غاز الكلور Cl2 عند المصعد
سؤال (6) :
أستنتج نواتج التحليل الكهربائي لمحلول يوديد الصوديوم NaI :
الإجابة:
1. يتأكسد أيون اليوديد على المصهد فينتج اليود I2 وفق المعادلة الآتية :
2. بالرجوع لسلسلة النشاط الكيميائي سنجد أن الصوديوم يقع فوق الهيدروجين في ترتيب السلسلة إذًا فإن أيونات الصوديوم الموجبة Na+
لا تختزل وإنما تختزل جزيئات الماء مكونة غاز الهيدروجين وفق المعادلة الآتية :
3. نواتج التحليل الكهربائي لمحلول يوديد الصوديوم NaI هي :
1. غاز الهيدروجين H2 عند المهبط 2. يود I2 عند المصعد
- الربط بالحياة :
شحن البطارية :
البطارية : خلية غلفانية يحدث فيها تفاعل تأكسد واختزال يُنتج تيارً كهربائيًا، وعندما يعاد شحن البطارية، فإنها تعمل بوصفها خلية تحليل كهربائي؛ إذ يمر فيها تيار كهربائي يتسبب في حدوث تفاعل التأكسد والإختزال، وهو عكس التفاعل الذي يحدث في أثناء استخدام البطارية فمثلًا، في بطارية السيارة فأن التفاعل الذي يحدث في أثناء الشحن هو :
- وهو عكس التفاعل المنتج للطاقة فيها، وتحدث عملية الشحن آليًا عبر محرك السيارة، أما في الهواتف والحواسيب المحمولة والسيارات الكهربائية وغيرها، فإن الشحن يتم بإسخدام مصدر خارجي للتيار الكهربائي.
- تطبيقات خلايا التحليل الكهربائي (Electrolysis Cells Applications) :
- تحول خلايا التحليل الكهربائي الطاقة الكهربائية إلى طاقة كيميائية بإستخدام تيار كهربائي يؤدي إلى إحداث تفاعل التأكسد والاختزال ولهذه الخلايا تطبيقات مهمة فمثلًا :
1. تُحضر الفلزات النشطة كالصوديوم والمغنيسيوم بالتحليل الكهربائي لمصاهير الكلوريدات الخاصة بها
2. الطلاء الكهربائي للحُلي والأدوات المنزلية، سواءً لإكسابها مظهرًا جميلًا أو لحمايتها من التأكل .
- إستخلاص الصوديوم (Extracting Sodium) :
- تُستخدم عملية التحليل الكهربائي لمصهور كلوريد الصوديوم NaCl في إستخلاص الصوديوم صناعيًا بإستخدام خلية داون Dawn’s Cell وذلك من خلال : تمرير تيار كهربائي في مصهور كلوريد الصوديوم NaCl فإنه:
- تتحرك أيونات الكلوريد السالبة Cl- باتجاه المصعد حيث تتأكسد مكونة غاز الكلور كما في المعادلة الآتية :
* أيونات الصوديوم الموجبة Na+ تتحرك بإتجاه المهبط وتحدث لها عملية اختزال، وتتكون ذرات الصوديوم كما في المعادلة الآتية :
- للحصول على معادلة التفاعل الكلية، أجمع نصفي تفاعل التأكسد والإختزال :
- شكل خلية داون Dawn’s Cell:
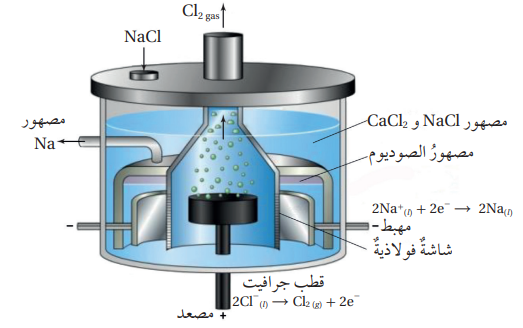
- نلاحظ من الشكل أن المصعد في الخلية محاط بشاشة فولاذية تعزل غازالكلور الناتج وتمنع تفاعله مع الصوديوم الناتج ويخرج غاز الكلور من مخرجٍ مخصص له .
- الطلاء الكهربائي (Electroplating) :
- تذكر أنه : يمكن حماية العديد من الفلزات من التآكل بطلائها بفلز آخر، فمثلًا :
- من طرائق حماية الحديد طلاؤه بطبقة من الخارصين وهو ما يسمى بغلفنة الحديد، في حين تغطى بعض الفلزات بطبقة من فلزات آخرى لإكسابها مظهرًا جميلًا .
- تتضمن عملية الطلاء الكهربائي :
ترسيب طبقة رقيقة من المادة المراد الطلاء بها على سطح المادة المراد طلاؤها، فمثلًا :
- إذا أردنا طلاء ملعقة بالفضة فإنه :
1. توصل الملعقة بالقطب السالب للبطارية حيث انها تمثل المهبط في خلية التحليل الكهربائي .
2. يوصل قطب من الفضة وهي المادة المراد الطلاء بها بالقطب الموجب للبطارية حيث يمثل المصعد .
3. كلاهما يكون موضوع في محلول كهرلي كهرلي لأحد أملاح الفضة مثل محلول نترات الفضة AgNO3 ، كما في الشكل الآتي :
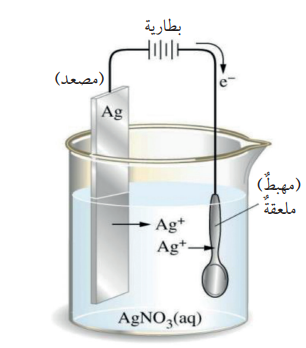
4. عند إغلاق الدارة الكهربائية تتأكسد ذرات الفضة المكونة للمصعد بحسب المعادلة الآتية :
كذلك فإن أيونات الفضة تختزل وتترسب على الملعقة ( المهبط) حسب المعادلة الآتية :
وبذلك يتم طلاء الملعقة بطبقة من الفضة
ملاحظة : إن كتلة قطب المصعد ( الفضة ) تقل مع مرور الوقت ( أثناء عملية الطلاء)
سؤال (7) :
يطلى الكثير من الأدوات الفولاذية كهربائيًا بطبقة من الكروم Cr لحمايتها من الصدأ . أكتب نصفي تفاعل التأكسد والاختزال اللذين يحدثان فيها .( شحنة الكروم +3(
الإجابة:
- الربط بالرياضة :
إن الميدالية الذهبية التي يكرم بها الفائزون في الألعاب الأولمبية لا تحتوي إلا جزءًا بسيطًا من الذهب، واللجنة الأولمبية العالمية هي من يضع مواصفات الميداليات الأولمبية، وتوافق على التصميم المقدم من الدولة المستضيفة إذ يبلغ قطر الميدالية الذهبية 85 mm ، وتبلغ كتلتها (556 g )، (550 g ) منها من الفضة الخالصة، وتطلى بطبقة من الذهب كتلتها (6 g) ، وعلى الرغم من ذلك، فإن الفرحة بالفوز بالميدالية الذهبية كبيرة .

- الإثراء والتوسع : ( النظارات ذاتية التلون Photochromic Glass) :
- يفضل بعض الأشخاص الذين يرتدون النظارات الطبية ذات العدسات ذاتية التلون عند التعرض للوض Photochromic Lenses، حيث تصبح داكنة عند تعرضها للضوء الساطع، ما يغنيهم عن النظارات الشمسية .
- يمكن تفسير هذا التغير في اللون استجابةً للضوء اعتمادًا على تفاعلات التأكسد والاختزال.
- من المألوف أن العدسات في النظارات العادية مصنوعة من الزجاج الشفاف للضوء المرئي، أما في العدسات ذاتية التلون، فيعالج الزجاج فيها بإضافة بلورات كلوريد الفضة AgCl وبلورات كلوريد النحاس CuCl (I) في أثناء تصنيع زجاج العدسة .
- من خصائص كلوريد الفضة أنه يتأثر بالضوء حيث يحدث له التفاعلات الآتية:
- تختزل أيونات الفضة Ag+ مكونة ذرات الفضة بحسب المعادلة الآتية :
- تتأكسد أيونات الكلوريد Cl- مكونة ذرات الكلور بحسب المعادلة الآتية :
- تتجمع ذرات الفضة معًا وتمنع إنتقال الضوء، ما يؤدي إلى تغميق لون زجاج العدسة، ويحدث ذلك فور التعرض للضوء
- حتى تكون هذه النظارة عملية، يجب أن يحدث العكس من ذلك بعيدًا عن الضوء ( في الظل أو الليل ) وهو ما يقوم به كلوريد النحاس CuCl (I) .
- عند وقوف الشخص في الظل يحدث التفاعل الآتي :
- تختزل أيونات 2+Cu ذرات الكلور التي تكونت نتيجة التعرض للضوء وتحولها إلى أيونات -Cl، وكذلك تتأكسد أيونات +Cu إلى 2+Cu، ثم تتفاعل أيونات 2+Cu مع ذرات الفضة التي تكونت نتيجة التعرض للضوء وتؤكسدها إلى أيونات الفضة +Ag وتختزل إلى أيونات +Cu كما في المعادلة الآتية :
- بذلك تصبح العدسات شفافة مرة آخرى .
- شكل النظارات ذاتية التلون
