- المفاهيم والمصطلحات :
عزيزي الطالب ستتعرف في هذا الدرس على هذه المفاهيم والمصطلحات العلمية :
|
تفاعل التعادل |
Neutralization Reaction |
|
الملح |
Salt |
|
المعادلة الأيونية |
Ionic Equation |
|
الأيونات المتفرجة |
Spectator Ions |
|
المعادلة الأيونية النهائية |
Net Ionic Equation |
الدرس الثاني : تفاعل الحموض والقواعد :(Acid-Base Reaction)
- تفاعل التعادل : ( Neutralization Reaction)
- تعريفه : هو التفاعل بين محلول الحمض ومحلول القاعدة.
- تشترك غالبية الحموض بوجود ذرات الهيدروجين في تركيبها وينتج عن ذوبانها في الماء أيونات الهيدروجين H+
- يشترك عدد من القواعد في وجود مجموعة الهيدروكسيد OH- في تركيبها، وينتج عن ذوبانها في الماء أيونات الهيدروكسيد OH-
- تتفاعل محاليل الحموض مع القواعد لتكوين محاليل الأملاح وجزيئات الماء فمثلًا :
- يتفاعل محلول حمض الهيدروكلوريك HCl مع محلول هيدروكسيد الصوديوم NaOH؛ فينتج محلول ملح كلوريد الصوديوم وجزيئات الماء كما في الشكل الآتي :

- المعادلة الكيميائية التي تمثل تفاعل حمض الهيدروكلوريك HCl مع محلول هيدروكسيد الصوديوم القاعدي هي:
- تكون المعادلة النهائية من تفاعل أيونات الهيدروجين H+ من الحمض وأيونات الهيدروكسيد OH- من القاعدة لتكوين جزيئات الماء، كما في المعادلة الآتية :
- تتفاعل محاليل الحموض مع أكاسيد الفلزات القاعدية مثل :(Na2O, MgO, CaO) لإنتاج الأملاح وجزيئات الماء فمثلًا:
يتفاعل أُكسيد المغنيسيوم MgO مع محلول حمض الهيدروكلوريك HCl لإنتاج ملح كلوريد المغنيسيوم MgCl2 وجزيئات الماء وفق المعادلة الكيميائية الآتية :
- تتفاعل القواعد مع أكاسيد اللافلزات الحمضية مثل : ( NO2, SO2, CO2)؛ لإنتاج الأملاح وجزيئات الماء فمثلًا :
يتفاعل غاز ثاني أُكسيد الكبريت SO2 مع هيدروكسيد الصوديوم NaOH؛ لإنتاج ملح كبريتيت الصوديوم Na2SO3 وجزيئات الماء، وفق المعادلة الكيميائية الآتية:
- الربط مع الزراعة :
- يستخدم المزارعون الأسمدة في التربة لزيادة نمو المحاصيل وكميتها.
- الأسمدة : هي مركبات تحتوي على أيونات يحتاج إليها النبات كي ينمو مثل :
. نترات البوتاسيوم التي نحصل عليها من تفاعلات التعادل حيث يحضر سماد نترات البوتاسيوم من تفاعل كربونات البوتاسيوم مع حمض النيتريك .
- التجربة (2) (تفاعل تعادل حمض وقاعدة ) :
- الهدف من التجربة :
أستقصي تفاعل التعادل بين حمضٍ وقاعدة
- المواد والأدوات المستخدمة :
- محلول حمض الهيدروكلوريك HCl تركيزه (1M)
- محلول هيدروكسيد الصوديوم NaOH تركيزه (1M)
- مخبار مدرج عدد (2)
- كأس زجاجية سعة 100ml عدد (2)
- أوراق الكاشف العام
- ميزان حرارة
- لهب بنسن
- منصب تسخين
- خطوات العمل :
- أقيس. 10ml من محلول HCl باستخدام المخبار المدرج، ثم أضعها في كأس زجاجية، وأقيس درجة حرارة المحلول، وأسجلها.
- أُكرر الخطوة السابقة مستخدمًا محلول NaOH، وأسجل درجة حرارة المحلول.
- أُلاحظ. أضع ورقة الكاشف العام في كل محلول، ثم أطابق لونها مع دليل الكاشف وأُقدر درجة حموضة المحلول، وأُسجل ملاحظاتي.
- أقيس. أُ ضيف محتويات الكأس الأولى إلى الكأس الثانية، ثم أقيس درجة حرارة المحلول الناتج، وأسجلها
- أُلاحظ. أضع ورقة الكاشف العام في المحلول، ثم أطابق لونها مع دليل الكاشف وأُقدر درجة حموضة المحلول، وأُسجل ملاحظاتي.
- ألاحظ. أضع المحلول في جفنة ثم أضعها على منصب التسخين، وأُسخن على لهب خفيف حتى تتبخر كمية الماء جميعها، وأُسجل ملاحظاتي .
- التحليل والإستنتاج:
1. أُقارن بين درجة حرارة المحلولين قبل خلطهما وبعده. علام يدل ذلك ؟
2. أكتب معادلة التفاعل الحادث.
3. أُقدر درجة حموضة المحلولين قبل الخلطِ وبعده.
- الملاحظات على التجربة :
1. ترتفع درجة حرارة المحلول بعد الخلط وهذا دلالة على حدوث التفاعل
2.
3. درجة الحموضة تساوي 7 بعد الخلط أي أن المحلول أصبح متعادل، أما قبل الخلط فقد كانت درجة حموضة المحلول الحمضي (حمض الهيدروكلوريك HCl) أقل من 7 ودرجة الحموضة للمحلول القاعدي (هيدروكسيد الصوديوم NaOH) أكبر من 7
- المعادلة الأيونية : ( Ionic Equation)
- تعريفها : هي المعادلة التي تتضمن الأيونات الموجودة في المحلول المائي .
- فمثلًا :
- حمض الهيدروكلوريك HCl يتأين في الماء منتجًا أيونات الهيدروجين (H+) وأيونات الكلوريد (Cl-)
- يتأين هيدروكسيد الصوديوم في الماء منتجًا أيونات الصوديوم (Na+) وأيونات الهيدروكسيد (OH-)
- الشكل التالي يوضح التفاعل بين محلول HCl ومحلول NaOH منتجًا الملح والماء:
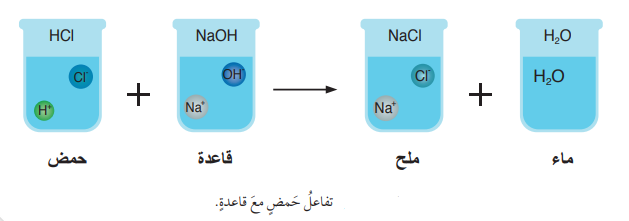
- بهذا يمكن كتابة المعادلة الأيونية لتفاعل محلول HCl ومحلول NaOH كما في المعادلة الآتية :
- يتضح من المعادلة أن : أيوني Na+, Cl- موجودان في المواد المتفاعلة والناتجة ويطلق على هذه الأيونات اسُم الأيونات المتفرجة؛ لذا يمكن حذفها من طرفي المعادلة وبهذا يمكن كتابة المعادلة النهائية
- تعريف الأيونات المتفرجة : هي الأيونات التي لم تشترك في التفاعل ولم تتغير شحناتها ولهذا يمكن حذفها من طرفي المعادلة
- تعريف المعادلة الأيونية النهائية : هي المعادلة التي تصف الأيونات المتفاعلة في المحلول المائي .
- بهذا تكون المعادلة النهائية أيونات الهيدروجين H+ من الحمض وأيونات الهيدروكسيد OH- من القاعدة لتكوين جزيئات الماء كما يأتي :
- الأمثلة الآتية توضح كتابة المعادلات الأيونية لتفاعلات محاليل الحموض والقواعد:
مثال (1) :
يتفاعل حمض الهيدروكلوريك HCl مع هيدروكسيد الكالسيوم Ca(OH)2 وفق المعادلة الكيميائية الموزونة الآتية :
1. أكتب المعادلة الأيونية :
2. أُحدد الأيونات المتفرجة في المحلول .
3. أكتب المعادلة الأيونية النهائية .
الإجابة :
1. يتضح من المعادلة أن المواد (HCl, Ca(OH)2 ) محاليل مائية، وبهذا أكتب المعادلة الأيونية كما يأتي :
2. أُحدد الأيونات المتفرجة في المحلول :
وألاحظ أن أيونات - Ca2+ ،2Cl موجودة في المواد المتفاعلة والناتجة
3. أكتب المعادلة الأيونية النهائية :
مثال (2) :
يتفاعل حمض النيتريك HNO3 مع هيدروكسيد البوتاسيوم KOH وفق المعادلة الكيميائية الموزونة الآتية :
1. أكتب المعادلة الأيونية .
2. أُحدد الأيونات المتفرجة في المحلول .
3. أكتب المعادلة الأيونية النهائية .
الإجابة :
1. أكتب المعادلة الأيونية :
2. أُحدد الأيونات المتفرجة في المحلول .
الأيونات K+ ، NO3-
3. أكتب المعادلة الأيونية النهائية :
مثال (3) :
يتفاعل محلول حمض الكبريتيك H2SO4 مع محلول هيدروكسيد المغنيسيوم Mg(OH)2 وفق المعادلة الكيميائية الآتية :
1. أكتب المعادلة الأيونية .
2. أكتب المعادلة الأيونية النهائية .
الإجابة :
1. أكتب المعادلة الأيونية:
2. أكتب المعادلة الأيونية النهائية :
سؤال (1) :
يتفاعل محلول حمض الكبريتيك H2SO4 مع محلول هيدروكسيد الليثيوم LiOH وفق المعادلة الكيميائية الموزونة الآتية :
1. أكتب المعادلة الأيونية .
2. أُحدد الأيونات المتفرجة في المحلول .
3. أكتب المعادلة الأيونية النهائية .
الإجابة :
1. أكتب المعادلة الأيونية :
2. أُحدد الأيونات المتفرجة في المحلول .
الأيونات المتفرجة هي : 2Li+, SO42-
3. أكتب المعادلة الأيونية النهائية :
- الأملاح : ( Salts)
- تعريف الملح : هو مركب أيوني ينتج من تفاعل محلول الحمض مع محلول قاعدة، ويوجد عادةً على شكل بلورات صلبة .
- الشكل الآتي يوضح شكل بلورات بعض الاملاح :


- يستخدم ملح الطعام كلوريد الصوديوم (NaCl) على نطاق واسع في الحياة اليومية كاستخدامه في الطعام وفي حفظ الأغذية والمحاليل الطبية.
- توجد أملاح أخرى غير كلوريد الصوديوم مثل كبريتات الفلزات وكربوناتها ونتراتها وأملاح الأمونيوم وغيرها؛ ومنها ما يستخدم في الأسمدة الكيميائية وما يستخدم في مكافحة الآفات كالفطريات والحشرات وما يستخدم في المجالات الطبية المتنوعة.
- تتألف صيغة الملح من من جزئين هما الأيون الموجب من القاعدة والأيون السالب من الحمض مثلًا:
عند تفاعل محلول HCl مع محلول NaOH يُستبدل أيون الهيدروجين H+ من الحمض مع الصوديوم Na+ من القاعدة؛ فينتج ملح NaCl كما هو موضح في المعادلة الآتية :
- يتحدد إسم الملح من الأيون السالب للحمض فمثلًا:
- يستدل من الإسم كلوريد الصوديوم NaCl أن الحمض الداخل في تكوين الملح هو حمض الهيدروكلوريك HCl إذ أن أيونه السالب هو الكلوريد Cl-.
- يوضح الجدول الآتي أمثلة لبعض الحموض وأيوناتها السالبة وإسم الملح المتكون منها وصيغته :
| الحمض | الأيون السالب من الحمض | اسم الملح المتكون |
| الهيدروكلوريك HCl | -Cl | كلوريد البوتاسيومKCl |
| النيتريك HNO3 | -NO3 | نترات الصوديوم NaNO3 |
| الكبريتيك H2SO4 | 2-SO4 | كبريتات المغنيسبيوم MgSO4 |
|
الفسفوريك H3PO4 |
3-PO4 |
فسفات الكالسيوم Ca3(PO4)2 |
سؤال (2) :
ما الحمض المستخدم في تكوين كل من الملح NaBr و الملح CH3COONa :
الإجابة :
الحمض المستخدم في تكوين الملح NaBr هو حمض HBr
الحمض المستخدم في تكوين الملح CH3COONa هو حمض CH3COOH
- تحضير الأملاح : (Preparation Salts)
- يمكن الحصول على الأملاح في المختبر بعدة طرائق، منها تفاعل الحموض مع القواعد أو القلويات فمثلًا :
- يمكن الحصول على ملح كلوريد البوتاسيوم KCl من تفاعل محلول حمض الهيدروكلوريك HCl مع محلول هيدروكسيد البوتاسيومKOH وفق المعادلة الآتية :
- يمكن الحصول على ملح كبريتات النحاس CuSO4 من تفاعل حمض الكبريتيك مع أكسيد النحاس CuO كما هو موضح في المعادلة الآتية :
- تتفاعل الحموض مع الفلزات وينتج عنها ملح الفلز ويتصاعد غاز الهيدروجين فمثلًا :
- يتفاعل حمض HCl مع فلز المغنيسيوم Mg وينتج ملح كلوريد المغنيسيوم MgCl2 كما هو موضح في المعادلة الآتية:
- الشكل الآتي يمثل ملح كلوريد المغنيسيوم :

- تفاعل الحموض مع كربونات الفلز كما في تفاعل حمض النيتريك مع كربونات النحاس فتنتج نترات النحاس والماء وغاز ثاني أكسيد الكربون وفق المعادلة الآتية :
- الشكل الآتي يمثل نترات النحاس :

- تفاعل الحموض مع القواعد التي لا تحتوي على أيون الهيدروكسيد OH- في تركيبها وينتج الملح فمثلًا:
- ملح كلوريد الأمونيوم NH4Cl الذي ينتج من تفاعل حمض HCl مع الأمونيا NH3 كما هو موضح في المعادلة الآتية :
- الشكل الآتي يمثل ملح كلوريد الأمونيوم :

- عند خلط محلولين لملحين مختلفين؛ ينتج عنهما ملحان آخران كما يحدث عند خلط محلولي الملحين كربونات البوتاسيوم K2CO3 وكلوريد الخارصين ZnCl2 فينتج محلول كلوريد البوتاسيوم ويترسب ملح كربونات الخارصين وفق المعادلة الآتية :
- تصنيف الأملاح : (Classification Salts)
- تصنف محاليل الأملاح إلى : (حمضية، قاعدية، متعادلة)
- يعتمد تصنيف الأملاح على نوع الحمض والقاعدة المكونين للملح.
- الأملاح المتعادلة : يكون الرقم الهيدروجيني لمحلولها (7) وتنتج من تفاعل محاليل الحموض القوية والقواعد القوية فمثلًا:
- ينتج ملح كلوريد الليثيوم LiCl من تفاعل حمض HCl القوي والقاعدة القوية هيدروكسيد الليثيوم LiOH كما في المعادلة الآتية :
- الأملاح الحمضية : يكون الرقم الهيدروجيني لمحلولها أقل من (7)، وتنتج من تفاعل محاليل الحموض القوية مع القواعد الضعيفة فمثلًا :
- ينتج ملح كلوريد الأمونيوم NH4Cl من تفاعل حمض HCl القوي مع القاعدة الضعيفة NH3 كما في المعادلة الآتية:
- الأملاح القاعدية : يكون الرقم الهيدروجيني لمحاليلها أكبر من (7)، وتنتج من تفاعل الحموض الضعيفة والقواعد القوية فمثلًا :
ملح إيثانوات الصوديوم CH3COONa الذي يتكون من تفاعل حمض الإيثانويك CH3COOH الضعيف مع القاعدة القوية NaOH كما في المعادلة الآتية :
سؤال (3) :
أكمل الجدول الآتي :
|
الحمض |
القاعدة |
الملح الناتج |
صنف الملح |
|
HCl |
NaOH |
|
|
|
CH3COOH |
|
CH3COONa |
قاعدي |
|
|
NH3 |
|
|
الإجابة :
|
الحمض |
القاعدة |
الملح الناتج |
صنف الملح |
|
HCl |
NaOH |
NaCl |
متعادل |
|
CH3COOH |
NaOH |
CH3COONa |
قاعدي |
|
HCl |
NH3 |
NH4Cl |
حمضي |
- التجربة (3) (قياس الرقم الهيدروجيني لمحاليل بعض الأملاح ) :
- الهدف من التجربة :
أستقصي الرقم الهيدروجيني لمحاليل بعض الأملاح
- المواد والأدوات المستخدمة :
- محلول كلوريد الأمونيوم NH4Cl (تركيزه 0.1M)
- محلول كلوريد الصوديوم NaCl (تركيزه 0.1M)
- محلول إيثانوات الصوديوم CH3COONa (تركيزه 0.1M)
- كأس زجاجية سعة 100ml عدد (3)
- أوراق الكاشف العام
- مخبار مدرج
- خطوات العمل :
- أقيس. 5ml من محلول NH4Cl باستخدام المخبار المدرج، وأضعها في كأس زجاجية
- أُلاحظ. أضع ورقة الكاشف العام في كل محلول، ثم أطابق لونها مع دليل الكاشف وأُقدر درجة حموضة المحلول، وأُسجل ملاحظاتي.
- أُكرر الخطوتين السابقتين مستخدمًا محاليل NaCl و CH3COONa وأُسجل ملاحظاتي.
- التحليل والإستنتاج:
1. أُصنف محاليل الأملاح إلى حمضية وقاعدية ومتعادلة
2. أُقارن قيم الرقم الهيدروجيني للمحاليل الثلاث.
- الملاحظات على التجربة :
1. محلول ملح NH4Cl محلول حمضي
محلول ملح NaCl محلول متعادل
محلول ملح CH3COONa محلول قاعدي
2. محلول ملح NH4Cl قيمة الرقم الهيدروجيني أقل من (7) لأن المحلول حمضي
محلول ملح NaCl قيمة الرقم الهيدروجيني يساوي (7) لأن المحلول متعادل
محلول ملح CH3COONa قيمة الرقم الهيدروجيني أكبر من (7) لأن المحلول قاعدي
- مؤشرات حدوث التفاعل الكيميائي :
- يمكن الاستدلال على حدوث تفاعل كيميائي عن طريق بعض المشاهدات التي ترافق حدوث التفاعل مثل :
- تصاعد غاز في أثناء حدوث التفاعل كما في الشكل الآتي والذي يمثل تفاعل فلز الخارصين Zn مع محلول حمض الهيدروكلوريك HCl وفق المعادلة الآتية :

- تكون مادة راسبة عن التفاعل، فمثلًا: عند خلط محلولي نترات الرصاص PbNO3 ويوديد البوتاسيوم KI ينتج محلول نترات البوتاسيوم KNO3 وتترسب مادة صفراء اللون من يوديد الرصاص PbI2 كما في الشكل الآتي :

- حدوث تغير في درجة حرارة المحلول الناتج كما يحدث عند تعادل حمض مع قاعدة .
سؤال (4) :
أذكر المؤشرات التي تدل على حدوث تفاعل ما :
الإجابة :
1. تغير درجة حرارة المحلول الناتج 2. تكون راسب 3 . خروج غازات 4. تغير اللون
- تحضير الحموض والقواعد صناعيًا :
1. حمض الكبريتيك H2SO4 :
- يدخل حمض الكبريتيك في العديد من الصناعات منها: صناعة الأسمدة الفوسفاتية، الورق، الأصباغ، المنظفات، المطاط، وبطاريات السيارات .
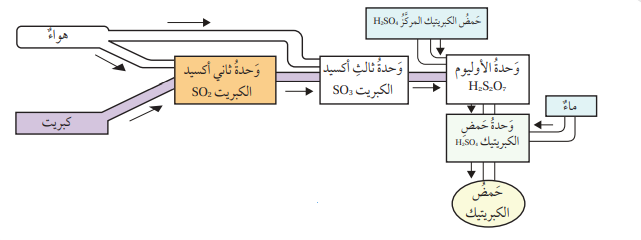
- يحضر حمض الكبريتيك بطريقة التلامس Contact Process،
- التي تتضمن صهر الكبريت الصلب ثم حرقه بوجود كمية كافية من الأكسجين لإنتاج غاز ثاني أكسيد الكبريت SO2 وفق معادلة التفاعل :
- ثم يخلط غاز ثاني اكسيد الكبريت مع الأكسجين ويسخن الخليط إلى درجة حرارة 450° وعند ضغط مناسب، يستخدم خامس أكسيد الفناديوم V2O5 عاملًا مساعدًا لتسريع حدوث التفاعل فينتج غاز ثالث أكسيد الكبريت SO3 وفق المعادلة الآتية:
- يمكن إذابة غاز SO3 في حمض الكبريتيك المركز المحضر سابقًا لإنتاج الأوليوم H2S2O7 ، الذي يتفاعل مع الماء لإنتاج حمض الكبريتيك وفق المعادلة الآتية:
- الشكل الآتي يمثل خطوات تحضير حمض الكبريتيك :
- الربط مع التاريخ :
اكتشف العالم العربي جابر بن حيان حمض الكبريتيك في القرن الثامن، وقد عرف أنذاك باسم زيت الزاج .
2. حمض الفسفوريك H3PO4 :
- يعد الأردن الدولة الثانية في العالم من حيث كميات خام الفوسفات الموجود فيها، ومن أهم المواد التي تُصنع من خام الفوسفات؛ حمض الفسفوريك، ويُستخدم في إنتاج الأسمدة الفوسفاتية، والأعلاف الحيوانية وصناعة السيراميك.
- يصنع حمض الفسفوريك بنقل الخام إلى المصنع ثم طحن صخور الفوسفات حتى تصبح حبيبات صغيرة، ثم يتفاعل فوسفات الكالسيوم مع حمض الكبريتيك وفق المعادلة الآتية :
- ثم ينقل حمض الفسفوريك إلى خزانات خاصة لحفظه.
- الربط مع الصناعة :
يعد المجمع الصناعي في مدينة العقبة التابع لشركة مناجم الفوسفات الأردنية، واحدًا من أكبر مجمعات إنتاج الأسمدة الفوسفاتية في الشرق الأوسط، ويضم المجمع وحدات متخصصة في إنتاج سماد ثنائي فوسفات الأمونيوم، وحمض الفسفوريك، وحمض الكبريتيك.
3. هيدروكسيد الصوديوم NaOH :
- يعرف هيدروكسيد الصوديوم NaOH بالصودا الكاوية، ويدخل في العديد من الصناعات مثل : صناعة الصابون ومواد التنظيف وإزالة عسر الماء وصناعة الزجاج والورق والنسيج وغيرها .
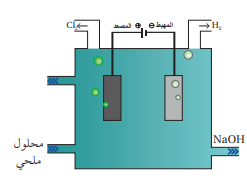
ينتج هيدروكسيد الصوديوم بعملية التحليل الكهربائي لمحلول كلوريد الصوديوم؛ حيث ينتج عن التحليل الكهربائي غاز الكلور وغاز الهيدروجين ومحلول هيدروكسيد الصوديوم وفق المعادلة الآتية :
- الشكل الآتي يمثل التحليل الكهربائي لمحلول كلوريد الصوديوم NaCl :
3. الأمونيا NH3:
- تعرف الأمونيا بــالنشادر؛ وهي غاز عديم اللون يمكن إسالته بالضغط أو التبريد، ويستخدم في تحضير حمض النيتريك وصناعة الأسمدة النيتروجينية والمطاط والنسيج، وبعض أنواع محاليل التنظيف المنزلية وغيرها.
- تُنتج الأمونيا صناعيًا بطريقة (هابر) حيث :
- يخلط غاز الهيدروجين والنيتروجين في مغاعل خاص عن درجة حرارة وضغط مناسبين، وباستخدام فلز الحديد عاملًا مساعدًا للتفاعل، ويحدث التفاعل الكيميائي الآتي :
- الشكل الآتي يوضح خطوات تحضير الأمونيا صناعيًا بواسطة طريقة (هابر):

- الإثراء والتوسع :
- المطر الحمضي :
- ينتج عن إحتراق الوقود الإحفوري عدد من الغازات منها : أكاسيد النيتروجين وغاز ثاني أكسيد الكبريت؛ وهذه الغازات تلوث الهواء الجوي؛ حيث تذوب في الماء مكونة حموضًا تسقط على الأرض على صورة هطول يسمى المطر الحمضي . فمثلًا :
يتحد غاز ثاني أكسيد الكبريت مع الماء والأكسجين مكونًا حمض الكبريتيك وفق المعادلة الآتية :
- يسبب المطر الحمضي:
1. تآكل المباني المصنوعة من الرخام والحجر الجيري والمحتوية على كربونات الكالسيوم.
2. تآكل الهياكل الفلزية.
3. ويؤثر في التربة فيغسلها من الأيونات الضرورية لنمو النباتات مثل أيونات الكالسيوم والمغنيسيوم.
4. ويؤدي أيضًا لنقل أيون الألمنيوم من التربة إلى مياه الأنهار والبحيرات؛ ما يسبب تلوثها ويؤدي إلى تسمم الأسماك التي تعيش فيه .
- إن تقليل إنبعاثات الغازات التي تسبب المطر الحمضي أمرٌ مكلف ويفاقم المشكلة إستمرارية هطول المطر الحمضي على على مناطق معينة.
- لتقليل كمية غاز ثاني أكسيد الكبريت المنبعثة في الغلاف الجوي؛ تزود محطات الطاقة والمصانع بمرشحات هواء لإزالة الكبريت من غاز المداخن؛ حيث تُخفَّض نسبة غاز ثاني اكسيد الكبريت قبل وصوله إلى الغلاف الجوي .
