- المفاهيم والمصطلحات :
عزيزي الطالب ستتعرف في هذا الدرس على هذه المفاهيم والمصطلحات العلمية :
|
نشاط الفلز |
Metal Reactivity |
|
أُكسيد الفلز |
Metal Oxide |
|
الملح |
Salt |
|
السبائك |
Alloys |
الدرس الأول: تفاعل الفلزات مع غاز الأكسجين، والماء، وحمض الهيدروكلوريك المخفف :
Reaction of Metals with Oxygen Gas, Water and Dilute Hydrochloric acid) ):
- تقع الفلزات على يسار الجدول الدوري ووسطه
- تعد المجموعتان الأولى (IA) والثانية (IIA) من أكثر الفلزات نشاطًا
- تعد العناصر الإنتقالية من الفلزات
- تختلف الفلزات في نشاطها الكيميائي مما يؤدي إلى التفاوت في سرعة تفاعلها فمثلًا :
الصوديوم والبوتاسيوم من أكثر الفلزات نشاطًا بينما الذهب والبلاتين أقلها نشاطًا
- الشكل الآتي يمثل مواقع الفلزات في الجدول الدوري :
- تتميز الفلزات بشكل عام بأنها :
أ) عناصر صلبة ب) لامعة جـ) قابلة للطرق والسحب د) موصلة للحرارة والكهرباء
- الشكل الآتي يبين الأشرطة اللامعة من فلزي النحاس والفضة :
- تكون الفلزات أيونات موجبة نتيجةً لفقدانها الإلكترونات في تفاعلاتها.
- تتفاوت الفلزات في سرعة تفاعلها مع غاز الأكسجين والماء وحمض الهيدروكلوريك المخفف.
- يوصف نشاط الفلز (Metal Reactivity) :بسرعة فقده الإلكترونات وتكوُّن أيونه الموجب.
- يختلف نشاط الفلزات بإختلاف :
1) مواقع الفلزات في الجدول الدوري 2) تركيبها الإلكتروني 3) تفاوت حجوم ذراتها في المجموعة الواحدة.
- تفاعل الفلزات مع غاز الأكسجين : (Reaction of Metal with Oxygen Gas) :
- تتفاعل الفلزات مع أكسجين الهواء الجوي، فيتغير لون سطحها ويصبح أقل لمعانًا؛ نتيجة تكون طبقة صلبة من أكسيد الفلز عليه.
- أكسيد الفلز : هو مركب كيميائي ينتج من تفاعل الفلز مع غاز الأكسجين
يعبر عن تفاعل الفلز مع غاز الأكسجين بالمعادلة العامة الآتية :
- الشكل الآتي يمثل تغير لون الأسطح عن تعرضها للهواء الجوي :
 |
 |
- تتفاعل الفلزات القلوية مثل (الليثيوم، الصوديوم، البوتاسيوم) بسرعة مع غاز الأكسجين فمثلًا:
- عند قطع فلز الصوديوم بالسكين، يتغير لون سطحه في مكان القطع من فضي إلى رمادي باهت خلال ثوانٍ نتيجة تفاعله مع أكسجين الهواء وتتكون طبقة رقيقة من أكسيد الصوديوم Na2O كما في الشكل الآتي :

- المعادلة الكيميائية الآتية تمثل تفاعل فلز الصوديوم مع غاز الأكسجين :
- تتفاعل الفلزات القلوية الأرضية مع غاز الأكسجين أيضًا، ولكن بسرعة أقل من سرعة تفاعل الفلزات القلوية فمثلًا:
- يتطلب تفاعل فلز الكالسيوم مع غاز الأكسجين بضع دقائق وهذا يشير إلى أن سرعة تفاعله مع غاز الأكسجين أقل من سرعة تفاعل الصوديوم
- المعادلة الكيميائية الآتية تمثل تفاعل فلز الكالسيوم مع غاز الأكسجين:
- يحتاج تفاعل فلز المغنيسيوم مع غاز الأكسجين مدة من الزمن؛ فعند تركه معرضًا للهواء يصبح سطحه قاتمًا نتيجة تكون طبقة من أكسيد المغنيسيوم MgO عليه كما في الشكل الآتي :

ولذلك، يتم حفظه في أوعية مغلقة .
- بينما، يتفاعل فلز المغنيسيوم مع غاز الأكسجين بسرعة عند حرقه، وينتج من ذلك التفاعل رمادً أبيض من أكسيد المغنيسيوم MgO تأثيره قاعدي في الماء .
- يتفاعل فلز الألمنيوم Al مع غاز الاكسجين بمرور الوقت، مكونًا طبقة رقيقة ومتماسكة من أكسيد الألمنيوم (Al2O3) على سطحه كما في الشكل الآتي الذي يمثل فلز الألمنيوم في إطارات النوافذ:
- يتكون صدأ الحديد نتيجة تفاعل فلز الحديد مع غاز الأكسجين بوجود الماء (الرطوبة)، فتظهر على سطحه مادة صلبة بُنية هشة تختلف في لونها وصلابتها كما في الشكل الآتي :

سؤال (1) :
أُعبر عن تفاعل فلز الليثيوم مع غاز الأكسجين بمعادلة كيميائية موزونة :
الإجابة :
سؤال (2) :
لماذا يحافظ فلز الذهب على بريقه لمئات السنين :
الإجابة:
لأن فلز الذهب Au هو فلز خامل غير نشط كيميائيًا، ولا يتفاعل مع الهواء والماء والحموض .
- الربط بالحياة:
الزنجار (جنزارةُ النحاس ) Patina
. تتعرض الأشياء المصنوعة من النحاس للهواء الجوي، فتتفاعل مع الأكسجين والماء وغاز ثاني أكسيد الكربون، ونتيجة لذلك تتكون على سطحها طبقة رقيقة، يتراوح لونها بين الأزرق الصافي والأخضر، بحسب نسبة تكون كربونات النحاس القاعدية (الزنجار)، فتغلف هذه الطبقة سطحها لحماية من التأكل .
الزنجار: هي مادة سامة، لذا لا ينصح بصنع أدوات الطهو من النحاس، ويستفاد من الزنجار عند خلطه بالشيد (الجير) في دهن سيقان الأشجار لحمايتها من الحشرات ولمعالجة التصمغ .

- تفاعل الفلزات مع الماء : (Reaction of Metal with Water) :
- تتعرض بعض الفلزات شائعة الإستخدام في حياتنا للماء، ولا يُلاحظ حدوث تفاعل لها معه فمثلًا :
- يمكننا الإستحمام ونحن نرتدي الحُلي المصنوعة من الذهب أو الفضة ويمكننا تنظيف الأواني المصنوعة من فلز الألمنيوم بالماء .
- تتفاعل الفلزات القلوية والفلزات القلوية الأرضية عمومًا مع الماء وينتج من تفاعلها هيدروكسيد الفلز وغاز الهيدروجين وكمية من الحرارة وفقًا لمعادلة التفاعل العامة الآتية :
- تتفاوت الفلزات القلوية في سرعة تفاعلها مع الماء، ويستدل على سرعة تفاعلها من كمية غاز الهيدروجين المتصاعد وكمية الحرارة الناتجة من تفاعله فمثلًا:
- يتفاعل الصوديوم مع الماء بسرعة كبيرةٍ، منتجًا كمية كبيرة من غاز الهيدروجين والحرارة
- يتفاعل البوتاسيوم مع الماء فيكون تفاعله سريعًا جدًا، منتجًا حرارة كبيرة تؤدي إلى إحتراق غاز الهيدروجين المتصاعد بسرعة كبيرة بفرقعة كما في الشكل الآتي الذي يمثل الفرق في سرعة وشدة تفاعل كل من فلزي البوتاسيوم والليثيوم:

- المعادلة الكيميائية الآتية تمثل تفاعل فلز البوتاسيوم مع الماء :
- تتفاوت الفلزات القلوية الأرضية في سرعة تفاعلها مع الماء فمثلًا :
- عند وضع حبيبات من الكالسيوم في الماء عند درجة حرارة الغرفة، تتصاعد فقاقيع من غاز الهيدروجين، ويتكون هيدروكسيد الكالسيوم قليل الذوبان في الماء، وينتج من هذا التفاعل كمية من الحرارة
- يتفاعل فلز المغنيسيوم ببطءٍ شديد عند وضعه في الماء البارد، منتجًا كمية قليلة من فقاقيع غاز الهيدروجين وتزداد كمية الغاز الناتج عند تسخين الماء وفقًا للمعادلة الكيميائية الآتية :
سؤال (3) :
لماذا يحفظ فلز البوتاسيوم في زيت البرافين :
الإجابة :
لأن فلز البوتاسيوم K سريع التفاعل مع الهواء والماء (الرطوبة) فيحفظ في البرافين لمنع تفاعله .
سؤال (4) :
أكتب المعادلة الكيميائية الموزونة لتفاعل فلز الصوديوم مع الماء، ثم أُسمي النواتج :
الإجابة :
النواتج هيدروكسيد الصوديوم NaOH وغاز الهيدروجين H2
سؤال (5) :
أُرتب الفلزات (Na, K, Mg, Ca) عموديًا وفقًا لسرعة تفاعلها مع الماء من الأكثر سرعة إلى الأقل سرعة
الإجابة :
K الأكثر نشاطًا
Na
Ca
Mg الأقل نشاطًا
- الربط بالصحة:
البلاتين : هو فلز لونه أبيض لامع، وله كثافة عالية وأقوى من الحديد وله مرونة الذهب، لا يلاحظ له تفاعل مع كثير من المواد ومنها الماء، لذلك يستخدم في صناعة حشوات الأسنان، وأجهزة تنظيم ضربات القلب التي تزرع داخل الجسم، وكذلك في صناعة البراغي والشرائح التي تستخدم في تثبيت كسور العظام،وأيضًا في المفاصل والمعدات والأدوات الطبية.
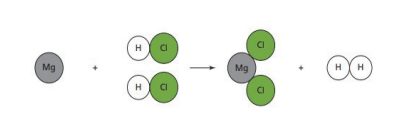
- تفاعل الفلزات مع حمض الهيدروكلوريك المخفف : (Reaction of Metal with Dilute Hydrochloric Acid) :
- تتفاعل العديد من الفلزات مع حمض الهيدروكلوريك HCl المخفف وتختلف في سرعة تفاعلها معه، فبعضها سريع التفاعل، وبعضها يتفاعل مع حمض HCl المخفف بسرعة أقل وهنالك بعض الفلزات لا تتفاعل مع حمض HCl المخفف.
- ينتج من تفاعل الفلزات مع حمض الهيدروكلوريك ملح بالإضافة إلى غاز الهيدروجين .
- الملح (Salt) : هو مركب أيوني ينتج من تفاعل الحمض؛ ما مع قاعدة وإما مع فلز.
- يسمى الملح الناتج من تفاعل الفلز مع حمض الهيدروكلوريك ( ملح كلوريد الفلز ) وفقًا لمعادلة التفاعل العامة الآتية :
- يتفاعل فلز المغنيسيوم بسرعة مع حمض الهيدروكلوريك المخفف، وينتج من تفاعله ملح كلوريد المغنيسيوم وكمية كبيرة من فقاقيع غاز الهيدروجين إلى أن يختفي المغنيسيوم كما في الشكل الآتي :
- المعادلة الكيميائية الآتية تمثل تفاعل فلز المغنيسيوم مع حمض الهيدروكلوريك المخفف :
- يلاحظ من معادلة التفاعل أن فلز المغنيسيوم حل محل الهيدروجين في حمض HCl، ويعد هذا التفاعل مثالًا على تفاعلات الإحلال
- الشكل الآتي يمثل تفاعل فلز المغنيسيوم مع حمض الهيدروكلوريك المخفف باستخدام نماذج والجزيئات :
- تتفاعل كل من الفلزات : الألمنيوم، والخارصين، والحديد، و الرصاص مع حمض الهيدروكلوريك HCl المخفف بسرعة متفاوتة ، منتجةً أملاح كلوريداتها وغاز الهيدروجين فمثلًا:
- يتفاعل فلز الألمنيوم Al مع حمض HCl المخفف بسرعة وتتصاعد كمية من فقاقيع غاز الهيدروجين إلى أن ينتهي التفاعل، ويتطلب التفاعل ثواني عدة ليظهر بوضوح، وذلك بسبب وجود طبقة رقيقة ومتماسكة من أكسيد الألمنيوم Al2O3 على سطحه .
- يتفاعل الخارصين Zn مع الحمض مُنتجًا غاز الهيدروجين بسرعةٍ أقل من الألمنيوم إلى أن يختفي الخارصين .
- يتفاعل الحديدFe ببطءٍ، منتجًا كمية أقل من فقاقيع الغاز .
- يتفاعل الرصاص Pb بطءٍ شديد مع حمض HCl المخفف، حيث يظهر قليل من فقاقيع الغاز على سطحه.
- لا يتفاعل النحاس CuوالفضةAg والذهب Au مع حمض الهيدروكلوريك المخفف .
- الشكل الآتي يبين تفاوت التصاعد لفقاقيع غاز الهيدروجين عند وضع فلزات مختلفة في حمض HCl المخفف :
- التفاوت في كمية الفقاقيع تُشير إلى تفاوت سرعة تفاعل الفلزات مع حمض الهيدروكلوريك المخفف
سؤال (6) :
لماذا لا ينصح بطهو الأغذية الغنية بالحموض في أوعية مصنوعة من فلز الألمنيوم :
الإجابة:
لأن فلز الألمنيوم يتفاعل مع الحموض وينتج أملاح الألمنيوم، مما يسبب تلف الأوعية المصنوعة منه وقد يسبب التسمم الغذائي.
سؤال (7) :
ما نواتج تفاعل فلز الألمنيوم Al مع حمض الهيدروكلوريك (HCl) المخفف:
الإجابة:
كلوريد الألمنيوم AlCl3 وغاز الهيدروجين H2
سؤال (8) :
اكتب المعادلة الكيميائية الموزونة لتفاعل فلز الخارصين Zn مع حمض الهيدروكلوريك (HCl) المخفف :
الإجابة:
- الربط بالصناعة:
إعادة تدوير (تصنيع) علب الألمنيوم :
- يُستخرج فلز الألمنيوم المستخدم في تصنيع علب المشروبات الغازية من خام البوكسيت، ولأن عملية استخراجه مكلفة، فإن إعادة استخدام العلب تعد مربحة إقتصاديًا وصديقة للبيئة .
- تتم عملية إعادة تدوير علب الألمنيوم بخطوات عدة تبدأ بجمعها، ثم ترقيقها ثم تنظيفها وسحقها، ثم صهرها انتهاءً بإعادة تشكيلها وإستخدامها.
- الجدول الأتي يمثل وصف تفاعلات الفلزات المختلفة مع الماء البارد وحمض الهيدروكلوريك المخفف :
|
الفلز |
رمزه |
وصف التفاعل مع الماء البارد |
وصف التفاعل مع حمض الهيدروكلوريك المخفف |
|
بوتاسيوم |
K |
تتفاعل بسرعة متفاوتة |
تتفاعل بسرعة كبيرة |
|
صوديوم |
Na |
||
|
ليثيوم |
Li |
||
|
كالسيوم |
Ca |
يتفاعل بسرعة |
|
|
مغنيسيوم |
Mg |
يتفاعل ببطء |
تتفاعل بسرعة متفاوتة |
|
ألمنيوم |
Al |
لا تتفاعل |
|
|
خارصين |
Zn |
||
|
حديد |
Fe |
||
|
قصدير |
Sn |
||
|
رصاص |
Pb |
||
|
نُحاس |
Cu |
لا تتفاعل |
لا تتفاعل |
|
فضة |
Ag |
||
|
ذهب |
Au |
- يتضح مما سبق أن :
- غالبية الفلزات نشطة كيميائية، وأن لها قابلية للتآكل بسبب تفاعلها مع الهواء والماء، ولتحسين خصائصها وملاءمتها للإستخدامات المختلفة؛ توصل الكيميائيون إلى تكوين السبائك (Alloys).
- السبائك (Alloys): هي خليط من الفلز وعناصر أخرى قد تكون فلزات أو لا فلزات مثل :
- سبيكة الفولاذ: التي تتكون من فلز الحديد مضافًا إليه نسبة محددة من الكربون وتستخدم هذه السبيكة في الإنشاءات، وخطوط السكك الحديدية؛ نظرًا لقوتها وصلابتها.
- سبيكة الفولاذ المقاوم للصدأ (Stainless Steel): هي مزج لسبيكة الفولاذ مع فلزات وعناصر أُخرى
- تتكون سبيكة الفولاذ المقاوم للصدأ من فلز الحديد مضافًا إليه الكروم والنيكل والكربون بنسبٍ محددة
- تستخدم سبيكة الفولاذ المقاوم للصدأ في صناعة أواني الطبخ
- سبيكة البرونز Bronze:
- تتكون سبيكة البرونز من النحاس مضافًا إلبه نسب محددة من الخارصين والقصدير .
- تستخدم سبيكة البرونز في صناعة التحف .
سؤال (9) :
أحدد مكونات سبيكة الفولاذ المقاوم للصدأ
الإجابة:
تتكون سبيكة الفولاذ المقاوم للصدأ من :
(الحديد + الكروم + النيكل + الكربون ) بنسب محددة
- الربط بالحياة:
سبائك العملات الفلزية
- تُعد سبائك النحاس من أقدم سبائك الفلزات التي عرفها الإنسان عبر التاريخ حيث؛ استخدمت قديمًا في مجالات عدة منها :
+ سبائك العملات النحاسية
+ سبائك العملة فضية اللون التي تصنع من خلط 75% من مصهور فلز النحاس مع 25% من فلز النيكل وتسمى (سبيكة كوبرنيكل)
+ سبائك العملة ذهبية اللون التي تصنع من خلط 97% من مصهور فلز النحاس مع 3% من فلزي القصدير والخارصين .
- التجربة (1) : تفاعل الفلزات مع كل من الماء وحمض الهيدروكلوريك HCl المخفف
- الهدف من التجربة :
أستقصي تفاعل بعض الفلزات مع كلٍ من الماء وحمض الهيدروكلوريكHCl المخفف
- المواد والأدوات المستخدمة :
- حبيبات الكالسيوم
- شريط مغنيسيوم طوله 5cm
- قطع نحاس
- قطع خارصين
- ماءٌ مقطر
- أنابيب إختبار عدد (8)
- حامل أنابيب
- ورق صنفرة
- ملعقة
- أعواد ثقاب
- مخباران مدرجان سعة كل منهما 25ml
- حمض الهيدروكلوريك المخفف تركيزه 0.5M
- ورق لاصق
- قلم تخطيط
- خطوات العمل :
- أُنظف شريط المغنيسيوم بورق الصنفرة لإزالة طبقة الأكسيد التي تغلفه
- أحضر أربعة أنابيب اختبار وألصق على كل منها اسم أحد الفلزات الأربعة، ثم أضعها على حامل الأنابيب
- أقيس: أضيف باستخدام المخبار المدرج 10ml من الماء المقطر إلى كل أنبوب
- أضع كمية مناسبة من الفلز في كل أنبوب اختبار وفقًا لإسم الفلز المكتوب عليه. ألاحظ ما يحدث في كل أنبوب، ثم أُدون ملاحظاتي.
- أجرب: أشعل عود ثقاب وأقربه من فوهة أنبوب الكالسيوم والماء، ثم أُدون ملاحظاتي.
- أُكرر الخطوات من 1 إلى 4 باستخدام حمض الهيدروكلوريك HCl المخفف.
- نظم البيانات : أدون ملاحظاتي الخاصة بتفاعلات الفلزات في جدول البيانات الآتي:
|
رمز الفلز |
حدوث تفاعل مع الماء وتصاعد فقاقيع غاز H2 نعم / لا |
حدوث تفاعل مع حمض الهيدروكلوريك HCl المخفف وتصاعد فقاقيع غاز H2 نعم / لا |
|
Ca |
|
|
|
Mg |
|
|
|
Cu |
|
|
|
Zn |
|
|
- التحليل والإستنتاج :
-
1. أُفسر حدوث فرقعة عند تقريب عود الثقاب المشتعل من فوهة أنبوب الكالسيوم Ca والماء .
2. أكتب المعادلة الكيميائية الموزونة لتفاعل فلز الكالسيوم Ca مع الماء.
3. أرتب الفلزات الأربعة وفقًا لسرعة تفاعلها مع حمض HCl المخفف عموديًا من الأكثر نشاطًا إلى الأقل نشاطًا.
- الملاحظات على التجربة :
1. ذلك لأن غاز الهيدروجين الناتج عن التفاعل يشتعل بفرقعة
2.
3. كالسيوم Ca الأكثر نشاطًا
مغنيسيوم Mg
خارصين Zn
النحاس Cu الأقل نشاطَا