التأيُّنُ الذاتي للماء: Autoionization of Water
تحتوي المحاليل المائيّة على أيونات الهيدرونيوم +H3O وأيونات الهيدروكسيد -OH الناتجة منَ التأيُّن الذاتي للماء،فما المقصودُ بالتأيُّن الذاتي للماء؟ وما العلاقةُ بين تراكيز أيونات الهيدرونيوم وأيونات الهيدروكسيد في المحلول المائي؟ وكيف يمكنُ حسابُ تراكيز هذه الأيونات في المحلول؟
يُوصَفُ الماءُ النقي بأنه غيرُ موصل للتيار الكهربائي، إلا أنَّ القياساتِ الدقيقةَ للموصليّة الكهربائيّة تشيرُ إلى أنه يمكن للماء أن يوصل التيار الكهربائي بدرجة ضئيلة جدًّا؛ ما يشيرُ إلى أنه يحتوي على نسبة ضئيلة منَ الأيونات الناتجة من تفاعل جُزيئات الماء في ما بينها؛
إذ يمكن لجزيء الماء أن يمنح البروتون ويتحوَّلَ إلى أيون الهيدروكسيد-OH؛ وبهذا فهو يسلك سلوك الحِمض، 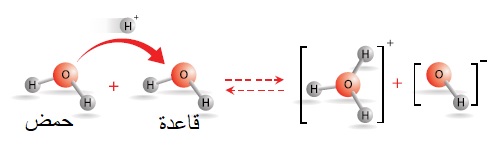
في حين يستقبلُه جزيءُ ماءٍ آخَرُ ويتكوَّنُ أيون الهيدرونيوم +H3O؛ وبهذا فهو يسلك سلوك القاعدة. كما في الشكل المجاور.
وعليه، فنجدُ أنَّ الماء يحتوي على تراكيزَ متساويةٍ من أيونات الهيدرونيوم وأيونات الهيدروكسيد،
وَيُطلقُ على هذا السلوك التأيُّن الذاتي للماء Autoionization of Water،
وهو أنَّ بعض جُزيئات الماء تسلك كحموض وبعضَها الآخر يسلك كقواعد في الماء نفسه، والمعادلة الآتية توضِّحُ ذلك:
H2O (l) + H2O (l) H3O+(aq) + OH-(aq)
وقد وُجد أنَّ تراكيز هذه الأيونات صغير جدًّا، ويمكن حسابُها باستخدام ثابت الاتزان للتفاعل على النَّحو الآتي:
ونظرًا إلى أنَّ تأين الماء قليل جدًّا نفترض أنَّ تركيز الماء يبقى ثابتًا؛ ويمكن دمجُهُ معَ ثابت الاتزان،
وَيُعَبَّرُ عنه بثابت جديد يسمّى ثابت تأيُّن الماء Dissociation Constant for Water، وَيُرمَزُ لهKw ،وَيُعرَّفُ أنه ثابتُ الاتزان لتأيُّن الماء،
وقد وُجد أنه يساوي عند درجة حرارة ، وَيُعَبَّرُ عنه على النَّحو الآتي:
يستفاد من ثابت تأيُّن الماء في حساب تراكيز أيونات +H3O أو أيونات -OH عندما يكون تركيزُ أحدهما معروفًا.
ونظرًا إلى أنَّ تركيز أيونات +H3O يكون مساويًا لتركيز أيونات-OH في الماء، فإن
يرتبط أيون +H3O بمفهوم الحِمض، بينما يرتبط أيون-OH بمفهوم القاعدة، ويمكنُ تصنيفُ المحاليل
| [ OH-] | [H3O+] | المحلول |
| متعادل | ||
| أقل من | أكبر من | حمضي |
| أكبر من | أقل من | قاعدي |
تبعًا لتراكيز هذه الأيونات إلى محاليلَ حِمضيّةٍ أو قاعديّة أو متعادلة، كما يبيِّنُ الجدولالمجاور:
والأمثلة الآتية توضح كيفية حساب تراكيز أيونات الهيدروجين وأيوات الهيدروكسيد في المحلول.
المثال (1): أحسب تركيز +H3O في محلول يحتوي على أيونات -OHتركيزُها
تحليل السؤال:
المطلوب: حساب تركيز +H3O
الحل:
المثال (2):أحسب تركيز -OH في محلول يحتوي على أيونات +H3O تركيزها
تحليل السؤال:
المطلوب: حساب تركيز -OH
الحل:
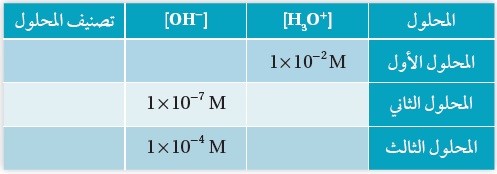
أتحقَّق: يُبَيِّنُ الجدولُ الآتي تراكيز +H3O و -OH لثلاثة محاليل.
أكمل الفراغات في الجدول بما يناسبها:
|
الاجابة:
|
 |
محاليلُ الحموض القويّة Strong Acid Solutions
ترتبط قوة الحِمض بقدرته على التأيُّن ومنح البروتون في التفاعل، فعند إذابة الحِمض في الماء يتأيَّن وَيُنتجُ أيونَ الهيدرونيوم +H3O وأيونًا آخَرَ سالبًا. فمثلا، عند إذابة منَ الحِمض HCl في من الماء يتأيَّن كُلِّيًّا؛ ممّا يؤدي إلى زيادة تركيز أيونات +H3O، كما في المعادلة الآتية:
ولمّا كان الماء يحتوي على أيونات الهيدرونيوم +H3O وأيونات الهيدروكسيد -OH في حالة اتزان معَ جُزيئات الماء غير المتأيِّنة،
كما يتضِحُ من معادلة التأيُّن الذاتي للماء:
H2O (l) + H2O (l) H3O+(aq) + OH-(aq)
فإنَّ موضع الاتزان في الماء يُزاح -وفقًا لمبدأ لوتشاتلييه- نحوَ اليسار؛ وبذلك يقلُّ تركيزُ أيونات-OH، ويبقى ثابتُ تأيُّن الماء Kw ثابتًا. ونظرًا إلى أنَّ تركيز أيونات+H3O الناتجة منَ التأيُّن الذاتي للماء يكون صغيرًا جدًّا مقارنة بتركيزها الناتج من تأيُّن الحِمض القوي فيجري إهمالُه، وَيُعَدُّ الحِمضُ المصدرَ الرئيس لهذه الأيونات، ويكون تركيزُها في المحلول مساويًا لتركيز الحِمض؛ أي أنَّ:
ويمكن حسابُ تركيز أيونات-OH في المحلول باستخدام ثابت تأيُّن الماء Kw، كما يأتي:
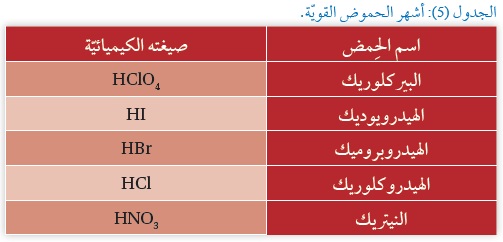
يتضِحُ ممّا سبق أنَّ إضافة حِمض قوي إلى الماء يؤدي إلى تكوين محلول حِمضي يكون فيه تركيز +H3O أكبرَ من تركيز أيونات-OH، ويبيِّنُ الجدول (5) أشهرَ الحموض القويّة،
والأمثلة الآتية توضِّحُ كيفيّة حساب تركيز أيونات +H3O وأيونات-OH في محلول حِمض قوي.
المثال(3):أحسب تركيزH3O+ وتركيز OH-في محلول يحتوي على منَ حِمض الهيدروبروميك HBr.
تحليل السؤال:
المطلوب: أحسب تركيز H3O+ وتركيز OH-
HBr(s) + H2O(l) H3O+ (aq) + Br-(aq): معادلة تأيُّن الحِمض
المثال (4): أحسب تركيزH3O+ وتركيز OH-في محلول جرى تحضيرُهُ بإذابة 0.02 mol من حِمض البيركلوريك HClO4 في 400 mL من الماء.
تحليل السؤال:
عدد مولات (n): HClO4 = 0.02 mol
حجم المحلول (v) : 400 mL = 0.4 L
المطلوب: أحسب تركيز +H3O و تركيز -OH
الحل:
أحسب أوَّلا تركيزَ الحِمض، الذي يساوي تركيز +H3O:
أحسب تركيز OH- باستخدام Kw كما يأتي:
أتحقق: أحسب تركيزَ +H3O وتركيزَ -OH في محلول حِمض النيتريك HNO3 تركيزه
الإجابة :
تحليل السؤال:
المطوب: أحسب تركيزَ +H3O وتركيزَ -OH
الحل:
HNO3 (aq) + H2O(l) H3O+ (aq) + NO3-(aq)
تركيزَ +H3O يساوي تركيز حِمض النيتريك HNO3 أي أن:
أحسب تركيز -OH باستخدام Kw كما يأتي:
محاليلُ القواعد القويّة Strong Bases Solutions
تتأيَّنُ القواعدُ القويّة كُلِّيًّا في الماء، وينتج أيونُ -OH وأيونٌ آخَرُ موجب. فمثلاً، عند إذابة منَ القاعدةNaOH في من الماء تتأيَّن كُلِّيًّا، ويزداد بذلك تركيزُ -OH، كما في المعادلة الآتية:
ووفقًا لمبدأ لوتشاتيلييه فإنَّ زيادة تركيز أيونات -OH في الماء تؤدي إلى إزاحة موضع الاتزان فيه نحو اليسار؛ ممّا يقلل من تركيز أيونات +H3O، ويبقى ثابتُ تأيُّن الماء Kw ثابتًا. ونظرًا إلى أنَّ تركيز أيونات -OH الناتجة من التأيُّن الذاتي للماء يكون صغيرًا جدًّا مقارنة بتركيزها الناتج من تأيُّن القاعدة فيمكن إهمالُها، وَتُعَدُّ القاعدة مصدرًا رئيسًا لهذه الأيونات، ويكون تركيزُها في المحلول مساويًا لتركيز القاعدة؛ أي أنَّ:
[ OH-] = [Base]
ويمكن حساب تركيز أيونات +H3O في المحلول باستخدام ثابت تأيُّن الماء Kw، كما يأتي:
يتضِحُ ممّا سبق أنَّ إضافة قاعدة قويّة إلى الماء تؤدي إلى زيادة تركيز -OH ونقص تركيز +H3O ، ويكون المحلول الناتج قاعديًّا، ويبيِّنُ الجدولُ (6) أشهرَ القواعد القويّة.
ويبيِّنُ الجدولُ (6) أشهرَ القواعد القويّة.
والأمثلة الآتية توضِّحُ كيفيّة حساب تركيز أيونات -OH وأيونات +H3O في محلول قاعدة قوية.
المثال (5): أحسب تركيزَ H3O+ وتركيز OH-في محلول يحتوي على من هيدروكسيد الليثيوم LiOH.
تحليل السؤال:
المطلوب: أحسب تركيزَ H3O+ وتركيز OH-
الحل:
القاعدة LiOH قاعدة قويّة تتأيَّنُ كُلِّيًّا وفقَ المعادلة الآتية:
أحسب تركيزَ -OH وفقَ العلاقة الآتية:
أحسب تركيزَ +H3O باستخدام ثابت تأين الماء Kw:
أتحقق: أحسب تركيزَ +H3O وتركيزَ -OH في المحاليل الآتية:
1) محلول القاعدة هيدروكسيد البوتاسيوم KOH الذي تركيزه 0.5 M
الحل:
1) أحسب تركيز -OH وفق العلاقة الآتية:
أحسب تركيزَ +H3O باستخدام ثابت تأين الماء Kw:
2) محلول جرى تحضيرُهُ بإذابة 8 g من بلورات هيدروكسيد الصوديوم NaOHفي 200 mL منَ الماء. علمًا أنَّ Mr(NaOH)= 40 g/mol
أحسب عدد مولات القاعدة NaOH ثم احسب تركيزها، كما يلي :
أحسب تركيز H3O+ باستخدام Kw كما يلي:
الربطُ مع الصناعة الشَّحمة Grease
تُستخدَمُ القواعدُ، مثل هيدروكسيد كلٍّ منَ الصوديوم والليثيوم بسبب ملمسها الزلق، في صناعة ما يُسَمّى بالشُّحوم الصابونيّة (الشَّحمة) التي تُستخدَمُ في تشحيم الآلات والسيارات وغيرها للتقليل منَ الاحتكاك؛ حيث تُضاف هذه القواعدُ إلى الدهون النباتيّة أو الحيوانيّة لصناعة أنواع مختلفة من تلك الشُّحوم أو ما يُسَمّى بالصابون الشَّحمي، مثل: الصّابون الليثيومي ،Lithium Grease والصّابون الصوديومي .Sodium Grease
الرَّقْمُ الهيدروجيني pH والرَّقْمُ الهيدروكسيلي pOH
تحتوي المحاليلُ المائيّة على تراكيزَ صغيرةٍ جدًّا من تراكيز أيونات الهيدروجين، التي تُعَبِّرُ عن حموضة المحلول، وأيونات الهيدروكسيد، التي تُعَبِّرُ عن قاعديّة المحلول. ولصعوبة التعامل معَ هذه الأرقام يستخدم الكيميائيون طرائقَ أسهل للتعبير عن حموضة المحلول أو قاعديته، مثل: الرَّقْم الهيدروجيني pH، والرَّقْم الهيدروكسيلي pOH.
فما المقصودُ بكلٍّ من الرَّقْم الهيدروجيني pH والرَّقْم الهيدروكسيلي pOH؟
وكيف يُستخدم كلٌّ منهما في التعبير عن حموضة المحلول أو قاعديته؟
الرَّقْمُ الهيدروجيني pH Hydrogen Power
اقترح الكيميائيون استخدام مفهوم الرَّقْم الهيدروجيني Hydrogen Power للتعبير عن حموضة المحلول، وهو اللوغاريتم السالب لتركيز أيون الهيدرونيوم +H3O في المحلول للأساس 10،
وَيُعَبَّرُ عنه رياضيًّا بالعلاقة الآتية: pH = - log [H3O+]
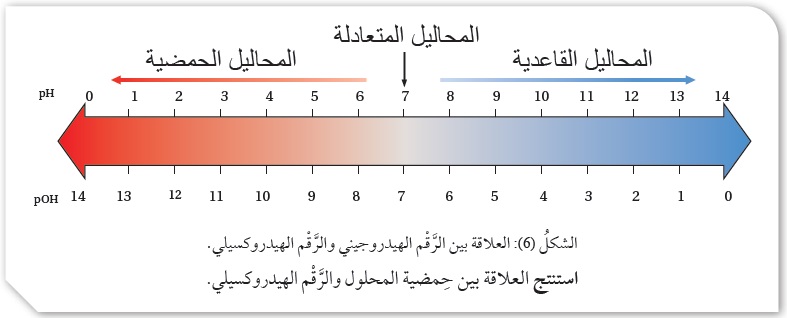
وَيُعَدُّ مقياسًا كميًّا لحموضة المحلول، فهو مقياس مُدّرَّجٌ من صفر إلى 14، ويبيِّنُ الشكلُ(5)العلاقة بين حموضة المحاليل وَرَقْمها الهيدروجيني pH وتركيز أيونات الهيدرونيوم+H3O.
يتضِحُ منَ الشكل أنَّ:
المحاليل الحِمضيّة يكون تركيزُ +H3O فيها أكبرَ من7- 10، وتكون قيمة الرَّقْم الهيدروجيني pH أقلَّ من 7،
وفي المحاليل المتعادلة يكون تركيزُ +H3O مساويًا 7- 10، وقيمة الرَّقْم الهيدروجيني pH تساوي7،
أمّا في المحاليل القاعدية فيكون تركيزُ +H3O أقلَّ من7- 10، وقيمة الرَّقْم الهيدروجيني pH أكبرَ من 7.
أتحقق:
1) أُحَدِّدُ، بالاعتماد على الشكل (5)، الرَّقْمَ الهيدروجيني للمحاليل الآتية:
أ) محلولٌ تركيزُ +H3O فيه يساوي الجواب:
ب) محلولٌ تركيزُ +H3O فيه يساوي الجواب:
2) أستنتج أيَّ المحلولين السابقين حِمضي وأيهما قاعدي.
الجواب: المحلول في الفرع (أ): حمضياً ، وفي الفرع (ب) قاعدياً
الحساباتُ المتعلقة بالرَّقْم الهيدروجيني
تتفاوت تراكيزُ أيونات الهيدرونيوم H3O+ وأيونات الهيدركسيد OH- في المحاليل المائيّة للحموض والقواعد، ويحسب الرَّقْمُ الهيدروجيني pH للمحلول بالاعتماد على تركيز أيونات H3O+ وباستخدام العلاقة الآتية: pH = -log [H3O+]
الأمثلة الآتية توضِّحُ كيفيّة حساب الرَّقْمُ الهيدروجيني pH للمحلول :
المثال(6) : أحسب الرَّقْمَ الهيدروجيني pH لمحلول حِمض النيتريك HNO3 تركيزه
تحليل السؤال: HNO3] = 0.25 M]
المطلوب: أحسب الرَّقْمُ الهيدروجيني pH للمحلول
الحل: يتأيَّنُ الحِمضُ HNO3 كُلِّيًّا، كما في المعادلة الآتية:
المثال (7):أحسب الرَّقْمَ الهيدروجيني pH لمحلول حِمض البيركلوريك HClO4 تركيزه 0.04 M علمًا أنَّlog 4 = 0.6
تحليل السؤال:
المطلوب: أحسب pH للمحلول.
الحل:
يتأيَّنُ الحِمض HClO4 كُلِّيًّا وفقَ المعادلة الآتية:
يُكتَبُ أحيانًا على بعض عبوات الأغذية والعصير الرَّقْمُ الهيدروجيني للمادة التي تحتويها, ويمكن حساب تركيز أيونات الهيدرونيوم +H3O فيها باستخدام العلاقة الآتية:
[ H3O+] = 10-pH
أفكِّر: أستنتج تركيز المحلول إذا كان رَقْمُهُ الهيدروجيني يساوي صفرًا (pH = 0).
الجواب: الرقم الهيدروجيني يساوي صفر ، أي أن لوغاريتم تركيز أيون الهيدروجين يساوي صفر ، وهو لوغاريتم 1
[ H3O+] = 100 = 1 M
أي ان تركيز الحمض يساوي 1M
المثال (8): أحسب [H3O+] لعبوة منَ الخلِّ مكتوب عليها أنَّ الرَّقْمَ الهيدروجيني pH يساوي 4
تحليل السؤال: pH = 4
المطلوب: أحسب [+H3O]
الحل:
المثال (9): أحسب [H3O+] لعبوة من عصير الليمون مكتوب عليها أنَّ الرَّقْمَ الهيدروجيني pH يساوي 2.2 (علمًا أنَّ log 6.3 = 0.8)
تحليل السؤال: pH = 2.2
المطلوب: أحسب [+H3O]
الحل:
المثال (10): أحسب الرَّقْمَ الهيدروجيني pH لمحلول القاعدة هيدروكسيد الصوديوم NaOH تركيزه 0.02 M
علمًا أنَّ log 5 = 0.7
تحليل السؤال:
المطلوب: أحسب pH لمحلول القاعدة
الحل:
تتأيَّنُ القاعدة NaOH كُلِّيًّا وفقَ المعادلة الآتية:
أحسب تركيزَ +H3O باستخدام ثابت تأين الماء Kw ، كما يأتي:
أحسب الرقم الهيدروجيني pH كما يأتي:
أتحقق:
1) أحسب pH لمحلول حِمض الهيدرويوديك HI تركيزه علمًا أنَّ log 3 = 0.48.
الحل:
2) أحسب [+H3O] لعينة من عصير البندورة رَقْمُها الهيدروجيني يساوي 4.3 علمًا أنَّ log5 =0.7.
الحل:
3) أحسب pH لمحلول القاعدة LiOH تركيزه علمًا أنَّ log 2.5 = 0.4.
الحل:
أحسب تركيز H3O+ باستخدام ثابت تأين الماء Kw كما يأتي:
أحسب pH لمحلول كما يأتي:
الرَّقْمُ الهيدروكسيلي pOH
يُستخدم الرَّقْمُ الهيدروكسيلي pOH Hydroxyl Power للتعبير عن قاعديّة المحلول، وَيُعرَّف بأنه اللوغاريتم السالب لتركيز أيونات الهيدروكسيد -OH في المحلول للأساس 10، وَيُعَبَّرُ عنه بالعلاقة الآتية:
pOH = -log [OH-]
الأمثلة الآتية توضِّحُ كيفيّة حساب الرَّقْمُ الهيدروكسيلي pOH للمحلول :
المثال (11): أحسب الرَّقْمَ الهيدروكسيلي pOH لمحلول القاعدة KOH تركيزه 0.01 M
تحليل السؤال:
المطلوب: أحسب الرَّقْمَ الهيدروكسيلي pOH
الحل:
تتأيَّنُ القاعدة القويّة KOH كُلِّيًّا في المحلول، كما في المعادلة:
ويمكن حسابُ تركيز -OH في المحلول، كما يأتي:
ويمكن حسابُ تركيز أيونات الهيدروكسيد -OH في المحلول بمعرفة الرَّقْم الهيدروكسيلي pOH فيه
باستخدام العلاقة الآتية:
المثال (12):أحسب [OH-] لعبوة من حليب المغنيسيا مكتوب عليها أنَّ الرَّقْمَ الهيدروكسيلي pOH يساوي 4
تحليل السؤال:
حليب المغنيسيا مادة قاعديّة؛ فهي تحتوي على تركيز عالٍ نسبيًّا من -OH
pOH = 4
المطلوب: أحسب تركيزَ -OH في الحليب
الحل:
أتحقق:
1) أحسب الرَّقْمَ الهيدروكسيلي pOH لمحلول هيدروكسيد الليثيوم LiOH تركيزه
الحل:
2) أحسب [-OH] لعبوة مكتوب عليها أنَّ الرَّقْمَ الهيدروكسيلي pOH يساوي 3.2 (علمًا أنَّ log 6.3 = 0.8)
العلاقة بين pH و pOH
يرتبط الرَّقْمُ الهيدروجيني pH بتركيز أيونات الهيدرونيوم في المحلول، في حين يرتبط الرَّقْمُ الهيدروكسيلي pOH بتركيز أيونات الهيدروكسيد، وحاصل ضرب تركيز الأيونين في المحلول يعطي قيمة ثابتة، يُعَبِّرُ عنها ثابتُ تأيُّن الماء Kwبالعلاقة الآتية:
إذا أخذنا لوغاريتم الطرفين نجد أنَّ:
وبضرب المعادلة بإشارة (-) نحصل على:
وحيث إنَّ:
فإنه يمكن التعبير عن العلاقة السابقة على النَّحو الآتي:
يتضِحُ منَ الشكل(6) أنَّ القيم المتقابلة عموديًّا تمثلُ مجموع الرَّقْم الهيدروجينيpH والرَّقْم الهيدروكسيلي pOH للمحلول. فمثلاً، عندما تكون pH تساوي 2 تكون قيمة pOH المقابلة لها تساوي 12؛ وبهذا يمكن معرفة قيمة أيٍّ منهما للمحلول بمعرفة الأخرى.
المثال (13): أحسب الرَّقْمَ الهيدروجيني pH والرَّقْمَ الهيدروكسيلي pOH لمحلول حِمض الهيدروكلوريك HCl، الذي تركيزه 1X10-3 M.
تحليل السؤال:
الحل:
أحسب pH للمحلول، كما يأتي:
أحسب pOH، كما يأتي:
اجابة سؤال أتحقق:
أحسب كلًّا من pH وpOH لكلٍّ منَ المحاليل الآتية:
1) محلولٌ تركيزُ أيونات +H3O فيه يساوي
2) محلولٌ تركيزُ أيونات -OH فيه يساوي
معايرةُ حِمض قوي وقاعدة قوية Acid Base Titration Strong
تعرفُ التفاعلات التي تحدث بين محلول حِمض ومحلول قاعدة بتفاعلات التعادل؛ حيث تتعادل أيوناتُ الهيدرونيوم +H3O والهيدروكسيد -OH في المحلول، وينتج عن ذلك الماء، كما في المعادلة:
ماذا يستفاد من تفاعل التعادل؟ وما علاقته بعملية المعايرة؟
يُستفاد من تفاعل التعادل في تعيين تركيز مجهول من حِمض أو تركيز مجهول من قاعدة؛
حيث يجري أولًا تحضيرُ حجم معيّن من محلول معلوم التركيز من حِمض أو قاعدة يسمّى المحلولَ القياسي، ثمَّ يُضافُ المحلولُ القياسي تدريجيًّا (نقطة بعد نقطة) إلى المحلول مجهول التركيز المراد تعيين تركيزه، وتسمّى هذه العمليّة المعايرة Titration،
وتستمرُّ عمليّة الإضافة إلى حين الوصول إلى نقطة معيَّنة يكون عندها عددُ مولات أيونات الهيدروكسيد-OH مكافئًا لعدد مولات أيونات الهيدرونيوم+ H3O في المحلول، وتسمّى هذه النقطةُ نقطةَ التكافؤ Equivalence Point ، وعند معايرة حِمض قوي وقاعدة قويةّ يُطلَقُ على هذه النقطة اسمُ نقطة التعادل Neutralization point، وهي النقطة التي تتعادلُ عندها تمامًا أيونات الهيدرونيوم معَ أيونات الهيدروكسيد جميعها خلالَ عمليّة المعايرة، ويتكوَّنُ الملح، وتكون PH للمحلول تساوي 7.
وتسمّى النقطةُ التي تُضافُ من المحلول القياسي إلى المحلول مجهول التركيز ويتغيَّرُ عندها لونُ الكاشف نقطةَ النهاية End Point، وهي تُحَدِّدُ انتهاءَ عمليّة المعايرة.
وَيُستخدم عادة كاشفُ الفينولفثالين عند معايرة حِمض قوي بقاعدة قويّة؛ إذ يتغيَّر لونُهُ من عديم اللون إلى اللون الزهري عند مدى منَ الرَّقْمِ الهيدروجيني (8.2 – 10)، 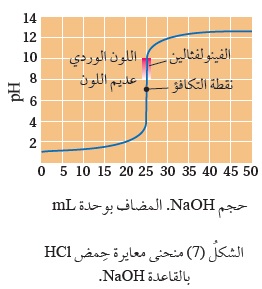
كيف يتم رسم منحنى عملية المعايرة؟
ولتوضيح تغيُّرات الرَّقْم الهيدروجيني في أثناء عمليّة المعايرة تجري قراءةُ مقياس الرَّقْم الهيدروجيني لمحلول الحِمض عند بداية المعايرة وبعد كلِّ إضافة منَ القاعدة وتسجيلها، وَيُنَظَّمُ جدولٌ يُسَجَّلُ فيه حجمُ القاعدة المضافة والرَّقْم الهيدروجيني للمحلول عند الإضافة إلى حين الوصول إلى ما بعد نهاية المعايرة، ثُمَّ يُرسَمُ منحنى المعايرة، وَيُبَيِّنُ الشكلُ (7) منحنى معايرة حِمض HCl بالقاعدة NaOH.
والأمثلة الآتية توضِّحُ الحساباتِ المتعلِّقةَ بمعايرة حِمض قوي معَ قاعدة قويّة:
المثال (14): أحسب تركيزَ محلول الحِمض HCl إذا تعادل 250 mL منه تمامًا معَ 200 mL منَ محلول القاعدة NaOH تركيزُها 0.02 M وفقَ المعادلة الآتية:
HCl(aq) + NaOH(aq) NaCl(aq) + H2O(l)
تحليل السؤال:
حجم الحِمض HCl =
حجم القاعدة NaOH =
تركيز القاعدة =
المطلوب: أحسب تركيز الحِمض.
الحل: أحسب عددَ مولات القاعدة
عند التعادل يكون عددُ مولات الحِمض مساويًا لعدد مولات القاعدة؛ أي أنَّ:
المثال (15):
أحسب تركيزَ محلول الحِمض HNO3 إذا تعادل10 mL منه تمامًا مع 20 mL من محلول القاعدة LiOH تركيزُه 0.2 M وفقَ المعادلة الآتية:
تحليل السؤال:
حجم الحِمض HNO3 =
حجم القاعدة LiOH =
تركيز القاعدة =
المطلوب: أحسب تركيز الحِمض HNO3.
الحل:
:أحسب عدد مولات القاعدة
عند التعادل يكون عددُ مولات الحِمض مساويًا لعدد مولات القاعدة؛ أي أنَّ:
إجابة سؤال أتحقق:
أحسب تركيزَ محلول القاعدة KOH إذا تعادل منها تمامًا معَ من محلول الحِمض HBr تركيزُه وفقَ المعادلة الآتية:
أحسب عدد مولات الحمض كما يلي:
عند التعادل يكون عدد مولات الحمض مساوياً عدد مولات القاعدة، أي ان:
الكواشف: Indicators
ما هي الكواشف؟ وكيف يستفاد منها؟
يستخدم الكيميائيون الكواشف لتحديد نقطة التكافؤ في أثناء عمليّة المعايرة، ومن ثَمَّ معرفة انتهائها،
فالكواشفُ Indicators موادُّ كيميائيّةٌ يتغيَّرُ لونُها حَسَبَ الرَّقْم الهيدروجيني للوسط الذي توجد فيه،
فهي تتكوَّنُ من حموضٍ عضويّةٍ ضعيفة أو قواعدَ عضويّةٍ ضعيفة يتغيَّرُ لونُها في مدًى معيَّنٍ منَ الرَّقْم الهيدروجيني،
فإذا رمزنا للكاشف الحِمضي بالرمز HIn فإنه يتأيَّنُ في المحلول، كما في المعادلة الآتية:
HIn(aq) + H2O(l) In-(aq) + H3O+(aq)
لون 2 لون1
كيف يعمل الكاشف في المحلول الحمضي؟
وعند إضافة محلول الكاشف HIn إلى محلول حِمض يحتوي على تركيز مرتفع من أيونات+H3O مقارنةً بمحلول الكاشف،فإنَّ التفاعل -وفقًا لمبدأ لوتشاتلييه- سوف يندفع بالاتجاه العكسي في محلول الكاشف للتقليل من تركيز +H3O؛ ممّا يقلِّلُ من تركيز الأيون -In ويختفي لونُهُ (2)، في حين يزداد تركيزُ الكاشف HIn غيرِ المتأيِّن ويظهرُ لونُهُ (1) في المحلول.
كيف يعمل الكاشف في المحلول القاعدي؟
عند إضافة محلول الكاشف إلى محلول قاعدة يحتوي على تركيز عالٍ من أيونات-OH فإن أيونات+H3O سَتُستَهلَكُ في محلول الكاشف، ووفقًا لمبدأ لوتشاتلييه سوف يندفع التفاعل بالاتجاه الأمامي لتعويض النقص في تركيز +H3O في معادلة الكاشف؛ ممّا يزيد من تركيز الأيون -In ويظهرُ لونُهُ (2) في المحلول، بينما يقلُّ تركيزُ الكاشف HIn غيرِ المتأيِّن ويختفي لونُهُ (1) منَ المحلول.
يتغيَّرُ لونُ الكاشف في مدًى معيَّنٍ منَ الرَّقْم الهيدروجيني يعتمدُ على النسبة بين تركيز ما يتأيَّنُ منه إلى نسبته الأصليّة. ويبيِّنُ الجدول (7) مدى الرَّقْم الهيدروجيني الذي يتغيَّرُ عنده لونُ بعض الكواشف.
الجدول(7)مدى الرَّقْم الهيدروجيني لتغيُّر ألوان بعض الكواشف. ( الجدول للاطلاع، ليس للحفظ)
| مدى الرقم الهيدروجيني لتغير اللون | الى | من | اسم الكاشف |
| 3.1 - 4.4 | أصفر | أحمر | الميثيل البرتقالي |
| 4.2 - 6.3 | أصفر | أحمر | الميثيل الأحمر |
| 6.0 - 7.6 | أزرق | أصفر | البروموثايمول الأزرق |
| 6.8 - 8.4 | أحمر | أصفر | الفينول الأحمر |
| 8.2 - 10.0 | زهري | عديم اللون | الفينولفثالين |
تعتمد دقة نتائج المعايرة على اختيار الكاشف المناسب؛
حيث يجري اختيارُ كاشف يتغيَّرُ لونُهُ عند رَقْم هيدروجيني قريب جدًّا لنقطة التعادل .
فمثلاً، عند معايرة الحِمض HCl بالقاعدة NaOH يُستخدمُ كاشفُ الفينولفثالين أو الميثيل الأحمر؛
حيث يتغيَّرُ لونُهما في مدًى قريبٍ من نقطة التعادل.
إجابة سؤال أتحقق:
أُحَدِّدُ، باستخدام الجدول (5)، لونَ الكاشف في كلٍّ منَ المحاليل الآتية:
- الميثيل الأحمر في محلول قاعدي. الإجابة : أصفر
- البروموثايمول الأزرق في محلول حمضي. الإجابة : أصفر