الخلايا الكهركيميائيّة Electrochemical Cells
 ما المقصود بالخلايا الكهركيميائية؟
ما المقصود بالخلايا الكهركيميائية؟
تسمّى الخلايا التي تحدث فيها تفاعلاتُ تأكسد واختزال منتجة للطاقة الكهربائيّة أو مستهلكة لها الخلايا الكهركيميائيّة .
وتقسم إلى نوعين: الخلايا الجلفانيّة، وخلايا التحليل الكهربائي.
وفي هذا الدرس سَتُدرَسُ الخلايا الجلفانيّة.
تُستخدَمُ الخلايا الجلفانيّة في مجالات واسعة في الحياة؛ فالبطّاريات بأنواعها، كالبطّاريّة القابلة للشحن التي تُستخدَمُ في
الهواتف الخلويّة والحواسيب المحمولة، أنظرُ الشكل ( 4)،وخلايا الوقود هي خلايا جلفانيّة Galvanic Cells
تحدث فيها تفاعلاتُ تأكسد واختزال تؤدي إلى إنتاج تيار كهربائي؛ أي تتحوَّلُ الطاقة الكيميائيّة فيها إلى طاقة كهربائيّة.
فما مكوِّناتُ الخليّة الجلفانيّة؟
كيمياء الخلايا الجلفانيّة Chemistry of Galvanic Cells
تتكوَّنُ الخليّة الجلفانيّة من وعاءين، يُسَمّى كُلٌّ منهما نصف خليّة ،Half Cell
ويحتوي كل وعاء على صفيحة فِلِزّيّة مغموسة في محلول يحتوي على أيونات الفِلِزّ؛
فنصف خليّة الخارصين تتكوَّنُ من صفيحة خارصين Zn مغموسة في محلول يحتوي على أيونات الخارصين +Zn2 ،
مثل محلول كبريتات الخارصين، وَيُعَبَّرُ عنها بالرمز Zn2+|Zn ،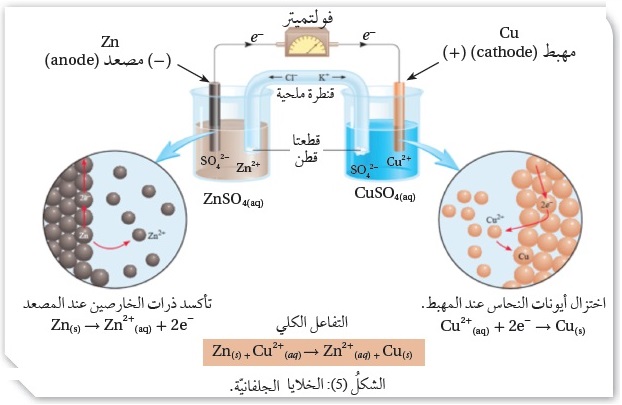
أمّا نصف خليّة النحاس فتتكوَّنُ من صفيحة نحاس Cu مغموسة في محلول يحتوي على أيونات النحاس +Cu2 ، مثل محلول كبريتات النحاس، وَيُعَبَّرُ عنها بالرمز Cu2+|Cu ،
ولتكوين خليّة جلفانيّة منهما تُوصَلُ الأقطابُ بموصل خارجي (الأسلاك) وَتُوصَلُ المحاليلُ بموصل
آخرَ هو القنطرة الملحيّة Salt Bridge ، التي تتكوَّنُ من أنبوب على شكل حرف U يحتوي على محلول ملحي
مشبع، لا تتفاعل أيوناته معَ الأيونات الموجودة في نصفي الخليّة الجلفانيّة أو معَ الأقطاب فيها،
مثل KCl ، وَيُستخدَمُ جهازُ فولتميتر لقياس فرق الجهد بين قطبي الخليّة،
ويوضِّحُ الشكل ( 5) مكوِّنات الخليّة الجلفانيّة.
عند تركيب الخليّة الجلفانيّة يُلاحظ انحرافُ مؤشِّر الفولتميتر نحو قطب النحاس بسبب حدوث تفاعل تأكسد واختزال؛
حيث تتأكسد ذرّاتُ الخارصين حَسَبَ المعادلة:
Zn(s) → Zn2+ (aq) + 2e-
وتنتقلُ الإلكتروناتُ من قطب الخارصين Zn عبرَ الأسلاك إلى قطب النحاس Cu ؛ حيث تكتسبُها أيونات النحاس +Cu2
وتُختزَلُ متحوِّلةً إلى ذرّات تترسَّبُ على قطب النحاس، حَسَبَ المعادلة:
Cu2+(aq) + 2e- → Cu(s)
ونتيجة تأكسد ذرّات الخارصين وتحوُّلها إلى أيونات الخارصين الموجبة +Zn2 يزداد تركيزُها في نصف خليّة الخارصين مقارنةً بتركيز أيونات الكبريتات -2 SO4 فيها،
وكذلك الحالُ في نصف خليّة النحاس؛ إذ يقلُّ تركيزُ السالبة أيونات النحاس الموجبة +Cu2 مقارنةً بتركيز أيونات الكبريتات السالبة بسبب اختزالها،
ويؤدي هذا إلى عدم اتزان كهربائيٍّ في الخليّة؛ لذا تُعادِلُ القنطرةُ الملحيّة الشحناتِ الكهربائيّةَ في نصفي الخليّة الجلفانيّة؛
حيث تتحرَّكُ أيوناتُ الكلوريد السالبة -Cl منَ القنطرة الملحيّة إلى نصف خليّة الخارصين لمعادلة الزيادة في تركيز أيونات +Zn2 ،
وتتحرَّكُ أيوناتُ +K الموجبة إلى نصف خليّة النحاس لمعادلة أيونات -2 SO4 الزائدة.
يسمّى القطبُ الذي يحدث عنده تفاعلُ التأكسد المِصعد Anode ، وهو قطبُ الخارصين Zn ،
وشحنتُهُ سالبة لأنه مصدر الإلكترونات بسبب تأكسد ذرّاته، فتقل كتلتُه،
أمّا القطبُ الذي يحدث عنده تفاعلُ الاختزال فيسمّى المِهبط ،Cathode وهو قطبُ النحاس Cu ، وشحنتُهُ موجبة؛
إذ تتحرَّكُ الإلكتروناتُ نحوه، وتزداد كتلتُهُ نتيجة اختزال أيونات النحاس وترسُّبها عليه.
أمّا المعادلةُ الكليّة في الخليّة الجلفانيّة فهي مجموعُ نصفي تفاعل التأكسد والاختزال:
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
وقد عَبَّرَ الكيميائيون عن الخليّة الجلفانيّة بطريقة مُختصرة وسهلة لوصفها:
القنطرة الملحيّة
Zn(s)|Zn2+(aq) ║Cu2+ (aq)|Cu(s)
نصف خليّة الاختزال نصف خليّة التأكسد
حيث يجري البدءُ بكتابة مكوِّنات نصف خليّة التأكسد منَ اليسار، فتكتبُ المادَّة التي يحدث لها تأكسدٌ أوَّلاً ثمَّ ناتجُ عملية التأكسد،
وَيَفصِلُ بينهما خط (|) كالآتي: Zn(s)|Zn2+(aq)
ثمَّ يُرسَمُ خطّان متوازيان ǁ يرمزان للقنطرة الملحيّة،
ثم تُكتبُ مكوِّنات نصف خليّة الاختزال، فَتُكتبُ المادَّة التي يحدث لها اختزال، ثمَّ ناتجُ عمليّة الاختزال،
وَيَفصِلُ بينهما خط(|) كالآتي: Cu2+ (aq)|Cu(s)
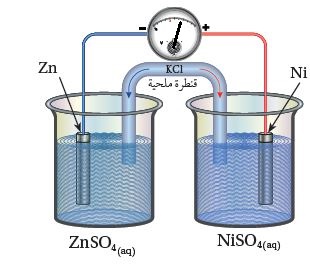
المثال (1): أدرسُ الشكلَ المجاور، الذي يمثلُ خليّة جلفانيّة مكوَّنة من نصف خليّة الخارصين Zn2+|Zn ونصف خليّة النيكل Ni2+|Ni،
ثمَّ أُجيبُ عنِ الأسئلة الآتية الآتي:
1- أُحَدِّدُ كلًّا منَ المِصعد والمِهبط في الخليّة.
2- أُحَدِّدُ اتجاه حركة الإلكترونات عبرَ أسلاكها.
3- أكتبُ نصفي تفاعل التأكسد والاختزال.
4- أُحَدِّدُ اتجاه حركة الأيونات الموجبة والسالبة عبرَ القنطرة الملحيّة.
5- ما التغيُّرُ في كتلة كلٍّ من قطبي النيكل والخارصين؟
خطواتُ الحل:
1- يُلاحظ من الشكل انحرافُ مؤشِّر الفولتميتر باتجاه قطب النيكل؛
أي أنَّ الخارصين Zn يمثلُ المِصعد، والنيكل Ni يمثلُ المِهبط.
2- تتحرَّكُ الإلكتروناتُ عبرَ الأسلاك من قطب الخارصين Zn ؛ حيث تتأكسد ذرّاته إلى قطب النيكل Ni وَتُختزََلُ أيوناتُه.
3- أكتبُ نصف تفاعل التأكسد ونصف تفاعل الاختزال:
نصف تفاعل تأكسد: -Zn(s) → Zn2+(aq) + 2e
نصف تفاعل اختزال: Ni2+(aq) + 2e- → Ni(s)
4- تتحرَّكُ الأيوناتُ السالبة -Cl منَ القنطرة الملحيّة باتجاه نصف خليّة الخارصين Zn2+| Zn ،
وتتحرَّكُ الأيوناتُ الموجبة +K منَ القنطرة الملحيّة إلى نصف خليّة النيكل Ni2+|Ni .
5 - تقلُّ كتلةُ قطب الخارصين نتيجة تأكسد ذرّاته وتحوُّلِها إلى أيونات +Zn2 تنتقلُ إلى المحلول،
وتزدادُ كتلةُ قطب النيكل نتيجة اختزال أيوناته +Ni2 وترسُّبها على القطب.
أتحقَّق:
في الخليّة الجلفانيّة، التي يحدث فيها التفاعل الآتي:
Cr(s) + 3Ag+(aq) → Cr3+(aq) + 3Ag(s)
1 - أكتبُ نصفي تفاعل التأكسد والاختزال.
2- أُحَدِّدُ كلًّ منَ المِصعد والمِهبط واتجاه حركة الإلكترونات في الدارة الخارجيّة.
3- أُحَدِّدُ اتجاه حركة الأيونات السالبة عبرَ القنطرة الملحيّة.
4 - ما القطبُ الذي تزدادُ كتلته؟ ولماذا؟
5- أكتبُ رمزَ الخليّة الجلفانيّة.
الإجابة:
1- نصف تفاعل التأكسد: -Cr Cr3+ + 3e
نصف تفاعل الاختزال: 3Ag+ + 3e- → -3Ag
2- المصعد: Cr ، المهبط:Ag
وتتحرك الإلكترونات من المصعد وهو قطب الكروم Cr إلى المهبط وهو قطب Ag عبر الدارة الخارجية.
3- يزداد تركيز أيونات +Cr3 في نصف خلية الكروم بسبب تأكسد ذراته، لذلك تتحرك الأيونات السالبة من القنطرة الملحية باتجاهها لمعادلة هذه الزيادة .
4- تزداد كتلة قطب Ag بسبب اختزال أيونات +Ag وترسبها عليه.
5- Cr(s)|Cr2+(aq) ║Ag+ (aq)|Ag(s)
جهدُ الخليّة الجلفانيّة Cell Potential
ما المقصود بجهد الخلية الغلفانية ؟ وكيف يتم قياسه؟
يُعَدُّ جهدُ الخليّة الجلفانيّة Cell Potential مقياسًا لقدرة الخليّة على إنتاج تيار كهربائي، وَيُقاسُ بالفولت،
وهو القوَّةُ الدافعة الكهربائيّة المتولِّدةُ بين قطبي الخليّة بسبب فرق الجهد بين القطبين،
الذي يزدادُ بزيادة ميل كلٍّ من نصفي تفاعل التأكسد والاختزال للحدوث،
وبالرجوع إلى خليّة (خارصين – نحاس) السابقة، ولمّا كان الخارصينُ أكثرَ نشاطًا منَ النحاس ، فهو أكثرُ ميلاً للتأكسد منَ النحاس؛
ممّا يولِّدُ قوَّةً دافعة كهربائيّة تدفع الإلكترونات إلى الحركة من قطب الخارصين Zn (المِصعد) إلى قطب النحاس Cu (المِهبط)
حيث أيونات النحاس +Cu2 أكثرُ ميلاً للاختزال.
يُعَبَّرُ عن ميل نصف تفاعل الاختزال للحدوث بجهد الاختزال، وَيُرمَزُ له بالرمز (Ereduction) ،
وَيُعَبَّرُ عن ميل نصف تفاعل التأكسد للحدوث بجهد التأكسد، وَيُرمَزُ له بالرمز (Eoxidatio).
تمتلك نصف الخليّة التي يحدث فيها تفاعل الاختزال جهدَ اختزال أعلى من نصف الخليّة التي يحدث فيها تفاعل التأكسد،
والفرقُ بين جهود الاختزال لكلا التفاعلين يساوي جهد الخليّة.
جهد الخليّة = جهد الاختزال لنصف تفاعل المِهبط - جهد الاختزال لنصف تفاعل المِصعد
(Ecell = Ereduction(cathode) - Ereduction(anode
أمّا عندما يقاسُ جهدُ الخليّة في الظروف المعياريّة: درجة حرارة 25˚C ، وتركيز الأيونات يساوي 1M ، وضغط الغاز يساوي 1atm ،
فيسمّى جهدَ الخليّة المعياري Standard cell potential ، وَيُرمَزُ له E˚cell ، وتصبحُ معادلة حساب جهد الخليّة المعياري:
(E˚cell = E˚reduction(cathode) - E˚reduction(anode
ويمكن التعبيرُ عنها باختصار كالآتي:
E˚cell = E˚cathode - E˚anode
وقد وُجد أنَّ جهد خليّة ( Zn – Cu ) المعياري يساوي 1.1 فولت ( 1.1 V ).
ولكن، هل يمكنُ قياسُ جهد الاختزال لنصف خليّة معيَّنة منفردة؟
وكيف جرى التوصُّلُ إلى قِيَمِ جهود الاختزال للأقطاب المختلفة؟
جهدُ الاختزال المعياري Standard Reduction potential
لا يمكن قياسُ جهد نصف خليّة منفردة، ولكن عند وصل نصفي خليّة لتكوين خليّة جلفانيّة؛ يمكنُ قياسُ فرق الجهد بينهما أي جهد الخليّة؛
لذلك اختار العلماءُ قطب مرجعي هو قطبَ الهيدروجين المعياري لقياس جهود اختزال أقطاب العناصر الأخرى،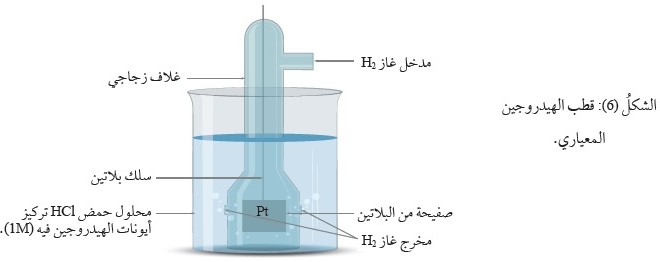
وجرى اختيارُ الهيدروجين لأنَّ نشاطه الكيميائي متوسط بين العناصر،
وقد اصطلح العلماءُ على أنَّ جهد الاختزال المعياري له يساوي صفر( ).
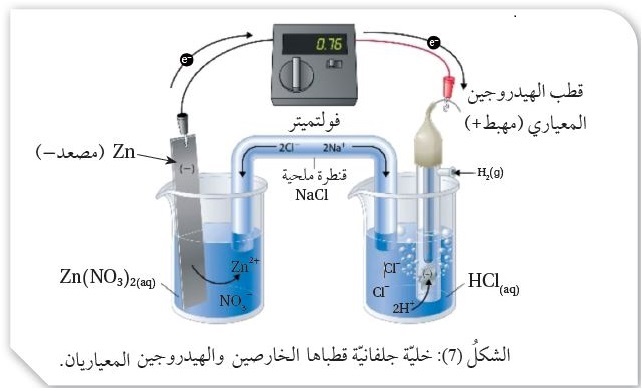
يتكوَّنُ قطبُ الهيدروجين المعياري من وعاء يحتوي على صفيحة منَ البلاتين مغموسة في محلول حمض
الهيدروكلوريك HCl تركيزُ أيونات الهيدروجين +H فيه 1M ، ويجري ضَخُّ غاز الهيدروجين إلى المحلول عند ضغط للغاز
يساوي 1 ضغط جوي ( 1 atm ) ودرجة حرارة ، أنظرُ الشكل ( 6).
يمكنُ تمثيلُ التفاعل الذي يحدث في نصف خليّة الهيدروجين بالمعادلة:
E˚ = 0.00 V (2H+(aq) + 2e- H2(g
يشيرُ السهمُ المزدوج إلى أنَّ نصف التفاعل منعكس؛ إذ يمكنُ لأيونات الهيدروجين +H أن تُختزل، كما يمكنُ لجُزيئات غاز الهيدروجين أن تتأكسد.
ولكن، كيف يُقاسُ جهدُ الاختزال المعياري لنصف خليّة ما باستخدام قطب الهيدروجين المعياري؟
لتوضيح ذلك، تُكَوَّنُ خليّة جلفانيّة من نصف خلية الهيدروجين المعيارية ونصف خليّة الخارصين مثلاً، فمثلاًظروف المعياريّة، كما في الشكل ( 7)،
يُلاحظ أنَّ قراءة الفولتميتر ( 0.76 V )، وهي قراءةٌ تمثلُ فرقَ الجهد بين قطبي الخارصين والهيدروجين المعياريين،
ولكي يُحَدَّدَ جهدُ الاختزال المعياري للخارصين يجب تحديدُ المِصعد والمِهبط في الخليّة؛
حيث يُلاحظُ أنَّ اتجاه حركة الإلكترونات من قطب الخارصين باتجاه قطب الهيدروجين المعياريين؛
أي أنَّ قطب الخارصين Zn يمثلُ المِصعد وحدثت له عمليّة تأكسد، حَسَبَ المعادلة:
نصفُ تفاعل التأكسد: -Zn(s) → Zn2+(aq) + 2e
بينما قطب الهيدروجين يمثلُ المِهبط وحدثت عمليّة اختزال لأيوناته، حَسَبَ المعادلة:
نصفُ تفاعل الاختزال: E°H2 = 0.00 Volt 2H+(aq) + 2e- → H2(g)
المعادلة الكُليّة : Zn(s) + 2H+(aq) → Zn2+(aq) + H2(g) E°cell = 0.76 V
لحساب جهد الاختزال المعياري للخارصين، تُستخدَمُ العلاقة:
E°cell = E°cathode - E°anode
بالتعويض:
0 - E°anode = 0.76 V
E°Zn = - 0.76 V
أي أنَّ جهد الاختزال المعياري لقطب الخارصين = ( )
القيمة السالبة لجهد الاختزال المعياري لقطب الخارصين تعني أنَّ أيونات الخارصين أقلُّ ميلً للاختزال من أيونات الهيدروجين؛
لذلك اختُزِلَت أيوناتُ الهيدروجين وتأكسدت ذرّاتُ الخارصين في التفاعل الذي حدث في الخليّة الجلفانيّة.
وَيُعَرَّفُ جهدُ الاختزال المعياري Standard Reduction potential للقطب بأنه مقياسٌ لميل نصف تفاعل الاختزال للحدوث في الظروف المعياريّة.
وكذلك، فإنَّ ذرّات الخارصين أكثرُ ميلً للتأكسد من جُزيئات الهيدروجين؛ لذلك فإنَّ جهد التأكسد المعياري للخارصين يساوي ()؛
أي أنَّ جهد التأكسد المعياري للقطب يساوي جهد اختزاله المعياري ويعاكسُهُ في الإشارة.
جهد التأكسد المعياري= E°reduction-
E°reduction = E°oxidation-
المثال 14 : في الخليّة الجلفانيّة الممثلة بالرمز الآتي:
Pt | H2(g) | 2H+ (aq) ǁ Cu2+|Cu
0.34 V = E°cell إذا علمتُ أنَّ
فأحسبُ جهد الاختزال المعياري للنحاس.
خطواتُ الحل:
1-أُحَدِّدُ، من خلال مخطط الخليّة الجلفانيّة، نصفَ تفاعل التأكسد ونصفَ تفاعل الاختزال؛
حيث يمثلُ قطبُ الهيدروجين المعياري نصفَ خليّة التأكسد، أمّا قطبُ النحاس المعياري فيمثلُ نصفَ خليّة الاختزال.
نصف تفاعل التأكسد: -H2(g) → 2H+(aq) + 2e
نصف تفاعل الاختزال: Cu2+(aq) + 2e- → Cu(s)
المعادلة الكُليّة: H2(g) + Cu2+ (aq) → 2H+(aq) + Cu(s)
2- بمعرفة جهد الخليّة المعياري وجهد قطب الهيدروجين المعياري، أحسبُ جهدَ الاختزال المعياري للنحاس
باستخدام العلاقة: E°cell = E°cathode - E°anode
0.34 V = E°Cu - 0.00 :بالتعويض فيها
E°Cu = 0.34 V ومنها جهد الاختزال
جهد الاختزال المعياري للنحاس أكبرُ منه للهيدروجين؛ ممّا يعني أنَّ أيونات النحاس أكثرُ ميلً للاختزال من أيونات الهيدروجين؛
لذلك تأكسدت جُزيئاتُ الهيدروجين واختُزِلَت أيوناتُ النحاس في التفاعل التلقائي الذي حدث في الخليّة الجلفانيّة.
أتحقَّق:
خليَّة جلفانيّة مكوَّنَة من نصف خليّة الهيدروجين 2H+|H₂ |Pt ونصف خليّة الكادميوم Cd2+|Cd المعياريين،
أحسبُ جهدَ الاختزال المعياري للكادميوم إذا علمتُ أنَّ جهد الخليّة المعياري يساوي
ونقصت كتلةُ قطب الكادميوم بعد تشغيل الخليّة لفترة منَ الزمن.
الاجابة:
نقص كتلة قطب الكادميوم دليل على تأكسد ذ ا رته واختزالها لأيونات الهيدروجين حسب المعادلة:
Cd(s) + 2H+(aq) → + Cd2+ (aq) H2(g)
E°cell = E°cathode - E°anode
0.40 V = 0.00 - E°anode
E°anode = - 0.40 V
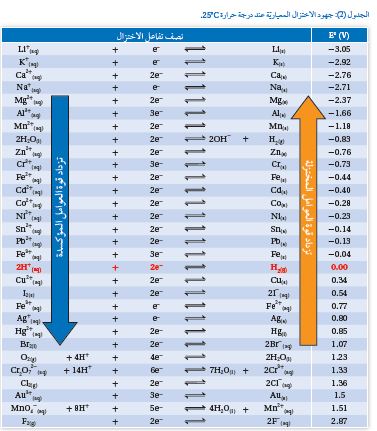
جدولُ جهود الاختزال المعياريّة Standard Reduction Potentials
ما هو جدول جهودالاختزال ؟ وكيف تم بناء هذا الجدول؟
استُخدِمَ قطبُ الهيدروجين المعياري في بناء خلايا جلفانيّة متعدِّدة،
ومن خلال قياس جهودها المعياريّة حُسِبَت جهودُ الاختزال المعياريّة للأقطاب المختلفة التي استُخدِمت فيها، واتفقَ الكيميائيون على كتابة أنصاف التفاعلات على شكل أنصاف تفاعل اختزال في الاتجاه الأمامي وترتيبها وفقًا لتزايد جهود الاختزال المعياريّة في
جدول سُمِّيَ جدولَ جهود الاختزال المعياريّة، أنظرُ الجدول ( 2).
أُلاحظُ أنَّ أنصافَ تفاعلات الاختزال في الجدول منعكسة، ومن ثَمَّ فإنَّ
الموادَّ على يسار المعادلة تمثلُ عواملَ مؤكسدةً تحدثُ لها عمليّةُ اختزال،
بينما تمثلُ الموادُّ على يمين المعادلة عواملَ مُختزلَةً تحدثُ لها عمليّة تأكسد
كما أنَّ جهود الاختزال تزداد من أعلى إلى أسفل في الجدول.
يُستفاد من جدول جهود الاختزال المعياريّة في حساب جهد الخليّة المعياري،
والتنبُّؤ بتلقائيّة تفاعلات التأكسد والاختزال، إضافة إلى مقارنة قوّة العوامل المؤكسدة
والمُختزلة.
حسابُ جهد الخليّة المعياري
بمعرفة جهود الاختزال المعياريّة للأقطاب المكوَّنة للخليّة الجلفانيّة يمكنُ حسابُ جهد الخليّة المعياري، حَسَبَ المعادلة:
E°cell = E°(cathode) - E°(anode)
والأمثلة الآتية توضِّحُ ذلك.
المثال 15: أحسبُ جهدَ الخليّة المعياري للخليّة الجلفانيّة التي يحدث فيها التفاعل الآتي:
Co2+(aq) + Fe(s) → Co(s) + Fe2+(aq)
تحليل السؤال :
المعطيات: المعادلة الكُليّة للتفاعل.
المطلوب: حساب جهد الخليّة المعياري E°cell .
خطواتُ الحل:
1- أُحَدِّدُ نصفَ تفاعل التأكسد ونصفَ تفاعل الاختزال اعتمادًا على معادلة التفاعل الكُليّة:
نصف تفاعل التأكسد: -Fe(s) → Fe2+ (aq) + 2e
نصف تفاعل الاختزال: Co2+ (aq) + 2e- → Co(s)
2-أكتبُ، منَ الجدول ( 2)، نصفي تفاعل الاختزال وجهودَ الاختزال المعياريّة لنصفي التفاعل السابقين:
Fe2+(aq) + 2e- Fe(s) E° Fe = - 0.44 V
Co2+ (aq) + 2e- Co(s) E°Co = - 0.28 V
3- أحسبُ جهدَ الخليّة المعياري E°cell .
E°cell = E°(cathode) - E°(anode)
E°cell = - 0.28 - ( - 0.44 ) = + 0.16 V
المثال 16 : خليّة جلفانيّة مكوَّنة من نصف خليّة الفضّة Ag+|Ag ونصف خليّة المغنيسيوم Mg2+|Mg في الظروف المعياريّة.
بالرجوع إلى جهود الاختزال المعياريّة لكلٍّ منهما في الجدول ( 2)،
أكتب المعادلة الكلية الموزونة للتفاعل، وأحسب جهدَ الخليّة المعياري.
تحليل السؤال:
المعطيات: تتكوَّنُ الخليّة الجلفانيّة من نصف خليّة الفضة ونصف خليّة المغنيسيوم في الظروف المعياريّة.
المطلوب: حساب جهد الخليّة المعياري E°cell .
خطواتُ الحل:
1-أكتبُ نصفي تفاعل الاختزال لكلٍّ من قطبي الفضّة والمغنيسيوم:
Ag+(aq) + e- Ag(s) E°Ag = 0.80 V
Mg2+(aq) + 2e- Mg(s) E°Mg = - 2.37 V
2-أكتبُ نصفي تفاعل التأكسد والاختزال الحادثين في الخليّة الجلفانيّة
ألاحظ أنَّ جهدَ الاختزال المعياري للفضّة أعلى منه للمغنيسيوم؛ أي أنَّ أيونات الفضّة +Ag أكثرُ ميلً للاختزال من أيونات +Mg2 ؛
لذلك فإنَّ قطب الفضّة Ag يمثلُ المِهبط في الخليّة الجلفانيّة؛ حيث تُختَزَلُ أيوناتُه،
بينما يمثلُ قطبُ المغنيسيوم Mg المِصعد فيها؛ حيث تتأكسدُ ذرّاتُه، كما في المعادلات الآتية:
نصف تفاعل التأكسد : -Mg(s) → Mg2+(aq) + 2e
Ag+(aq) + e- → Ag(s) :نصف تفاعل الاختزال
للحصول على المعادلة الكُليّة أضربُ معادلة نصف تفاعل الاختزال 2 × حتى يتساوى عددُ الإلكترونات المفقودة والمكتسبة، ثمَّ أجمعُ نصفي تفاعل التأكسد والاختزال.
Mg(s) + 2Ag+(aq) → Mg2+(aq) + 2Ag(s)
3- حساب جهد الخليّة المعياري E°cell.
E°cell = E°(cathode) - E°(anode)
E°cell = 0.80 - ( - 2.37 ) = + 3.17V
أُلاحظُ أنَّ جهدَ الاختزال المعياري للفضّة لم يتأثر بضرب نصف تفاعل الاختزال بالمعامل ( 2)؛
لأنَّ جهد الاختزال يعتمد على نوع المادَّة وليس على كميَّتها (عدد مولاتها).
إجابة سؤال أتحقَّق:
خليّة جلفانيّة مكوَّنة من نصف خليّة الكروم Cr3+|Cr ونصف خليّة النحاس Cu2+|Cu المعياريين.
بالرجوع إلى جهود الاختزال المعياريّة لكلٍّ منهما في الجدول ( 2)، أحسبُ جهدَ الخليّة المعياري.
إجابة سؤال
2Cr(s) + 3Cu2+(aq) → 2Cr3+(aq) + 3Cu(s)
E°cell = E°(cathode) - E°(anode)
E°cell = 0.34 - ( - 0.73 ) = + 1.07 V
التنبُّؤُ بتلقائيّة حدوث تفاعلات التأكسد والاختزال
تتفاعلُ بعضُ الِفِلِزّات معَ محلول حِمض الهيدروكلوريك المُخفَّف فينطلقُ غاز الهيدروجين، بينما لا يتفاعلُ بعضُها الآخر،
ومثالُ ذلك تفاعلُ النيكل معَ حِمض الهيدروكلوريك وإطلاقُ غاز الهيدروجين، أمّا النحاسُ فلا يتفاعل،
ويحلُّ النحاسُ محلَّ الفضة في محلول نترات الفضّة، بينما لا تحلُّ الفضّةُ محلَّهُ في محلول نترات النحاس.
هل يمكنُ استخدامُ جهود الاختزال المعياريّة في التنبُّؤ بتلقائية حدوث تفاعلات التأكسد والاختزال؟ وكيف؟
تُستخدَمُ جهودُ الاختزال المعياريّة للتنبُّؤ بتلقائية حدوث تفاعل التأكسد والاختزال؛ فتلقائيّة التفاعل Spontaneity of Reaction هي حدوثُ التفاعل،
وتكون النواتجُ دونَ الحاجة إلى طاقة كهربائيّة لإحداثه، ويتمُّ ذلك بحساب جهد الخليّة المعياري للتفاعل؛ فإذا كان:
جهد الخليّة المعياري للتفاعل موجبًا يكونُ التفاعلُ تلقائيًّا، أمّا إذا كان سالبًا فيكونُ التفاعلُ غيرَ تلقائي.
المثال 17 :أتوقعُ، بالاستعانة بالجدول ( 2)، أيَّ تفاعلاتِ التأكسد والاختزال الممثلة بالمعادلات الآتية يحدثُ بشكل تلقائي، وَأُفَسِّرُ ذلك.
أ. (Pb2+(aq) + 2Cl-(aq) → Pb(s) + Cl2(g
2Fe3+(aq) + Sn(s) → 2Fe2+ (aq) + Sn2+(aq) .ب
خطوات الحل:
أ) (Pb2+(aq) + 2Cl-(aq) → Pb(s) + Cl2(g
1- أكتبُ، بالاستعانة بمعادلة التفاعل الكيميائيّة، نصفَ تفاعل التأكسد ونصفَ تفاعل الاختزال:
نصف تفاعل الاختزال: Pb2+(aq) + 2e- → Pb(s)
نصف تفاعل التأكسد : -2Cl-(aq) → Cl2(g) + 2e
2- بالرُّجوع إلى جدول جهود الاختزال المعياريّة، أجدُ أنَّ:
E°Pb = - 0.13 V جهد الاختزال المعياري للرصاص
E°Cl2= 1.36 V جهد الاختزال المعياري للكلور
3- أحسبُ جهدَ الخليّة المعياري E°cell للتفاعل، كما ورد في المعادلة:
E°cell = E°(cathode) - E°(anode)
E°cell = - 0.13 - 1.36 = - 1.49 V
ألاحظ أنَّ قيمة جهد الخليّة المعياري للتفاعل سالبٌ؛ ممّا يعنى أنَّ التفاعل غيرُ تلقائيِّ الحدوث.
ويمكنُ التوصُّلُ إلى النتيجة السابقة نفسِها عند مقارنة جهود الاختزال المعياريّة لكلٍّ منَ الرصاص والكلور؛
ألاحظ أنَّ جهد الاختزال للكلور أكبرُ من جهد اختزال الرصاص؛ أي أنَّ ميلَ جُزيئات الكلور للاختزال أكبر،
ومن ثَمَّ لا تتأكسدُ أيوناتُ الكلوريد - Cl ولا تُختَزَلُ أيوناتُ الرصاص +Pb2.
2Fe3+(aq) + Sn(s) → 2Fe2+(aq) + Sn2+(aq) .ب
1- أكتبُ، بالاستعانة بالمعادلة الكيميائية، نصفَ تفاعل التأكسد ونصفَ تفاعل الاختزال:
2Fe3+(aq) + 2e- → 2Fe2+(aq) :نصف تفاعل الاختزال
Sn(s) → Sn2+(aq) + 2e- :نصف تفاعل التأكسد
2-بالرُّجوع إلى جدول جهود الاختزال المعياريّة، أختارُ أنصافَ تفاعل الاختزال للقصدير وأيونات الحديد +Fe3 :
Sn2+(aq) + 2e- Sn(S) E°Sn = - 0.14 V
2Fe3+(aq) + 2e- 2Fe2+(aq) E°Fe3+|Fe2+ = 0.77 V
3-أحسبُ جهدَ الخليّة المعياريE°cell للتفاعل:
E°cell = E°(cathode) - E°(anode)
E°cell = 0.77 - ( - 0.14 ) = 0.91 V
ألاحظ أنَّ جهد الخليّة المعياري للتفاعل موجبٌ؛ ممّا يعنى أنَّ التفاعلَ تلقائيُّ الحدوث.
المثال 18: أُفَسِّر: يتفاعلُ فِلِزّ النيكل Ni معَ محلول حِمض الهيدروكلوريك HCl وينطلقَ غازَ الهيدروجين.
خطوات الحل:
1- أكتبُ معادلة أيونيّة تمثلُ تفاعل فِلِزّ النيكل معَ حِمض الهيدروكلوريك، حَسَبَ المعادلة:
Ni(s) + 2H+(aq) → Ni2+(aq) + H2(g)
2- أكتبُ، بالاستعانة بمعادلة التفاعل السابقة، نصفَ تفاعل التأكسد ونصفَ تفاعل الاختزال.
ألاحظ، حَسَبَ المعادلات الآتية، أنَّ النيكل يتأكسدُ وَيَختَزِلُ أيونات الهيدروجين:
Ni(s) → Ni2+(aq) + 2e- :نصف تفاعل التأكسد
2H+(aq) + 2e- → H2(g) :نصف تفاعل الاختزال
3- بالرُّجوع إلى جدول جهود الاختزال المعياريّة، أجدُ أنَّ:
جهد الاختزال المعياري للنيكل E°Ni = - 0.23 V
جهد الاختزال المعياري للهيدروجين E°H2= 0.00 V
ألاحظ أنَّ جهد الاختزال المعياري للهيدروجين أكبرُ من جهد الاختزال المعياري للنيكل؛
أي أنَّ أيونات الهيدروجين أكثرُ ميلً لكسب الإلكترونات من أيونات النيكل؛
لذلك تُختَزَلُ أيوناتُ الهيدروجين وتتأكسدُ ذرّاتُ النيكل ويكونُ التفاعلُ تلقائيًّا وجهدُ الخليّة موجبًا،
كما يَتَّضِحُ عند حساب جهد الخليّة المعياري للتفاعل:
E°cell = E°cathode(H2) - E°anode(Ni)
E°cell = 0.00 - ( -0.23 ) = + 0.23 V
لذلك يتفاعلُ النيكل معَ حِمض الهيدروكلوريك ويتصاعدُ غازُ الهيدروجين.
المثال 19: أُفَسِّر: لا يتفاعلُ فِلِزّ النحاس Cu معَ محلول حِمض الهيدروكلوريك HCl المُخفَّف، ولا ينطلقُ غاز الهيدروجين.
خطواتُ الحل:
1 - أفترضُ حدوثَ التفاعل، وأكتبُ معادلتَه:
Cu(s) + 2H+(aq) → Cu2+(aq) + H2(g)
2- أكتبُ، بالاستعانة بمعادلة التفاعل المُفترض، نصفَ تفاعل التأكسد ونصفَ تفاعل الاختزال.
نصف تفاعل التأكسد: -Cu(s) → Cu2+(aq) + 2e
نصف تفاعل الاختزال: 2H+(aq) + 2e- → H2(g)
3- بالرُّجوع إلى جدول جهود الاختزال المعياريّة، أجدُ أنَّ:
جهد الاختزال المعياري للنحاس E°Cu = 0.34 V
جهد الاختزال المعياري للهيدروجين E°H2 = 0.00 V
ألاحظ أنَّ جهدَ الاختزال المعياري للنحاس أكبرُ منه للهيدروجين؛ أي أنَّ أيونات النحاس أكثرُ ميلً للاختزال من أيونات الهيدروجين؛
لذلك لا يتأكسدُ النحاسُ ولا تُختَزَلُ أيوناتُ الهيدروجين.
ويمكن حسابُ جهد الخليّة المعياري للتفاعل المُفترض، والتنبُّؤ بتلقائيّة حدوث التفاعل:
E°cell = E°cathode(H2) - E°anode(Cu)
E°cell = 0.00 - 0.34 = - 0.34 V
ألاحظ أنَّ جهد الخليّة المعياري للتفاعل المُفترض سالبٌ؛ أي أنَّ التفاعل غيرُ تلقائيِّ الحدوث.
ويمكن أيضًا استخدامُ جهود الاختزال المعياريّة للتنبُّؤ بإمكانيّة تفاعل الفِلِزّات أو اللافِلِزّات معَ محاليل الأملاح، كما في الأمثلة الآتية:
المثال 20: هل يمكن تحريكُ محلول نترات الفضّة AgNO3 بِمِلعقة منَ الكروم Cr ؟
المعطيات:
المحلول المستخدم AgNO3 ، المِلعقة مصنوعة من الكرومCr ؟
المطلوب:
هل يحدث تفاعلٌ بين نترات الفضّة AgNO3 والكروم Cr ؟
الحل:
حتى يحرَّكَ محلولٌ ما بِمِلعقة معيَّنة يجب ألّا يحدث تفاعلٌ بينها وبين أيونات المحلول عند تحريكه بها.
ولمعرفة ذلك، يُفترَضُ حدوثُ تفاعل وكتابة معادلته كالآتي:
3Ag+(aq) + Cr(s) → 3Ag(s) + Cr3+(aq)
ألاحظ أنَّ التفاعل المتوقع هو تأكسدُ ذرّات الكروم واختزال أيونات الفضّة.
وللحكم على إمكانيّة حدوث التفاعل يُرجَعُ إلى جهود الاختزال المعياريّة للفضّة والكروم، وهي ( E°Cr =-0.73 V , E°Ag =0.8 V );
إذ يلاحظ أن جهد اختزال الفضّة المعياري أعلى من جهد اختزال الكروم المعياري؛ أي أنَّ أيونات الفضّة أكثرُ ميلً للاختزال من أيونات الكروم؛
لذلك يتأكسدُ الكروم وَيَختَزِلُ أيونات الفضّة؛ أي أنَّ التفاعل بينهما تلقائي.
ويمكنُ أيضُا حسابُ جهد الخليّة المعياري للتفاعل كالآتي:
E°cell = E°cathode(Ag) - E°anode(Cr)
E°cell = 0.8 - (- 0.73 ) = + 1.53 V
ألاحظ أنَّ جهد الخليّة المعياري للتفاعل موجبٌ؛ أي أنَّ التفاعل تلقائي الحدوث، ومن ثَمَّ لا يمكن تحريُك محلول نترات الفضّة بِمِلعقة منَ الكروم.
المثال 21:هل يمكنُ تحضيرُ البروم Br2 من محلول بروميد البوتاسيوم KBr باستخدام اليود I2؟
تحليل السؤال:
المعطيات: المحلول المستخدم للتحضير منه بروميد البوتاسيوم KBr ، المادة المستخدمة للتحضير اليود I2 .
المطلوب: هل يحدثُ تفاعلٌ بين محلول بروميد البوتاسيوم KBr واليود I2 ويتكون البروم Br2؟
الحل
كتابة معادلة التفاعل المتوقع: 2Br-(aq) + I2(s) → 2I-(aq) + Br2(l)
ألاحظ أنَّ التفاعل المتوقع هو تأكسدُ أيونات البروميد -Br واختزال اليود I2 .
وللحكم على إمكانيّة حدوث التفاعل يُرجَعُ إلى جهود الاختزال المعياريّة للبروم واليود: (E°Br2=1.07 V , E°I2=0.54 V)
إذ يُلاحظُ أنَّ جهد الاختزال المعياري للبروم أعلى من جهد الاختزال المعياري لليود، ومن ثَمَّ فإنَّ البروم Br2 أكثرُ ميلً للاختزال من اليود I2 ؛
لذلك لا تتأكسدُ أيونات البروميد -Br ولا تَختَزِلُ اليود I2 ؛ أي أنَّ التفاعل بينهما غيرُ تلقائي.
ويمكنُ أيضًا حسابُ جهد الخليّة المعياري للتفاعل كالآتي:
E°cell = E°cathode(I2) - E°anode(Br2)
E°cell = 0.54 – 1.07 = - 0.53 V
ألاحظ أنَّ جهد الخليّة المعياري للتفاعل سالبٌ؛ أي أنَّ التفاعل غيرُ تلقائي الحدوث،
وبالتالي لا يمكنُ تحضيرُ البروم Br2 من محلول بروميد البوتاسيوم KBr باستخدام اليود I2 .
أتحقَّق:
باستخدام جدول جهود الاختزال المعياريّة أُجيبُ عنِ الأسئلة الآتية:
1- أتوقع: هل يمكنُ حفظُ محلول كبريتات الحديد FeSO4 II في وعاء منَ الألمنيوم Al ؟ أُبَرِّرُ إجابتي.
2- أتوقع: هل يمكن حفظُ محلول نترات المغنيسيوم 2(Mg(NO3 بوعاء منَ القصدير Sn ؟ أُبَرِّرُ إجابتي.
إجابة سؤال أتحقق:
1- أكتب معادلة التفاعل المتوقع بين أيونات +Fe2 والألمنيوم، ثم أحسب جهد الخلية المعياري للتفاعل:
2Al + 3Fe2+ 2Al3+ + 3Fe
E°cell = E°cathode(Fe) - E°anode(Al )
E°cell = -0. 44 - (- 1.66 ) = + 1.22 V
جهد الخلية المعياري للتفاعل موجب، أي أنه يحدث تفاعل تلقائي بينهما، لذلك لا يمكن حفظ محلول FeSO4 في وعاء من الألمنيوم.
ويمكن الحل بطريقة أخرى وهي : مقارنة جهود الاختزال المعيارية لكل من الألمنيوم ( ) والحديد ( )،
جهد الاختزال المعياري للحديد أكبر، أي أن ميل أيوناته للاختزال أكبر لذلك
تؤكسد أيونات الحديد +Fe2 ذرات الألمنيوم وبالتالي لا يمكن حفظ محلول FeSO4في وعاء من الألمنيوم.
2- أكتب معادلة الأيونية للتفاعل المتوقع، ثم أحسب جهد الخلية المعياري للتفاعل:
Sn + Mg2+ 2Sn2+ + Mg
E°cell = E°cathode - E°anode
E°cell = - 2.37 - ( - 0.14 ) = - 2.23 V
جهد الخليّة المعياري للتفاعل سالبٌ؛ أي أنَّ التفاعل غير تلقائي الحدوث، ومن ثم يمكن حفظ محلول نترات المغنيسيوم بوعاء من القصدير.
ويمكن الحل بطريقة أخرى وهي : مقارنة جهود الاختزال المعيارية لكل من القصدير والمغنيسيوم : ( E°Sn =-0.14 V , E°Mg = - 2.37 V )
جهد الاختزال المعياري للقصدير أعلى من جهد الاختزال المعياري للمغنيسيوم، ومن ثمَّ فإنَّ أيونات +Sn2 أكثر ميلا للاختزال من أيونات +Mg2 ؛
لذلك لا يتأكسد القصدير ولا يختزل أيونات المغنيسيوم؛ أي أنَّ التفاعل بينهما غير تلقائي ويمكن حفظ محلول نترات المغنيسيوم بوعاء من القصدير.
الربطُ مع الحياة:
يحدث أحيانا انتفاخ لعلب الأغذية؛ أحد أسباب حدوثه تفاعل الأغذيةُ الحامضيّة معَ الفِلزّ المُكوِّن للعُلبة المحفوظةِ فيها، وينتجُ عن ذلكَ غازُ
الهيدروجين؛ فيتسبّب في انتفاخ العُلبة، وغالبًا ما تكون هذه التفاعلاتُ جزءًا منَ العوامل التي تُحَدِّدُ مدّةَ صلاحيّة هذه المُنتجات.
مقارنةُ قوّة العوامل المؤكسدة والمختزلة
بالرجوع إلى جدول جهود الاختزال المعياريّة، يَتَّضِحُ أنَّ جهود الاختزال المعياريّة تزداد من أعلى إلى أسفل في الجدول؛
أي يزداد ميلُ نصف تفاعل الاختزال للحدوث؛ ما يعني أنَّ قوّة العوامل المؤكسدة تزداد أيضًا،
فيكونُ الفلور F2 أقوى عامل مؤكسد، بينما يكونُ أيون الليثيوم +Li أضعفَ عامل مؤكسد،
أمّا العواملُ المختزلة فإنَّ قوَّتها تقلُّ بزيادة جهد الاختزال المعياري؛
أي أنَّ الليثيوم Li يمثلُ أقوى عامل مختزل بينما يمثلُ أيونُ الفلوريد -F أضعفَ عامل مختزل.
والأمثلةُ الآتية توضِّحُ كيفيّة توظيف جهود الاختزال لمقارنة قوّة العوامل المؤكسدة والمختزلة.
المثال 22: أستعينُ بجدول جهود الاختزال المعياريّة، وَأُرَتِّبُ الموادَّ الآتية تصاعديًّا وفقَ قوَّتها كعوامل مؤكسدة في الظروف المعياريّة:
| نصف تفاعل الاختزال | E° ( V) |
| Al3+ + 3e- Al | -1.66 |
| Cd2+ + 2e- Cd | - 0.40 |
| Cl2 + 2e- 2Cl- | + 1.36 |
| MnO4- + 8H+ + 5e- Mn 2+ + 4H2O | + 1.51 |
+Cl2 ، Cd2+ ، MnO4- ، Al3
الحل:
1 - بالعودة إلى جدول جهود الاختزال المعياريّة، أختارُ أنصافَ التفاعلات للمواد السابقة، وَأُرَتِّبُها وفقَ تزايد جهود الاختزال المعيارية،
فيكون أعلى يسار الجدول أضعفَ عامل مؤكسد له أقلُّ جهد اختزال معياري؛
أي أنَّ أيونات الألمنيوم +Al3 أضعفُ عامل مؤكسد، وأنَّ لِ -MnO4 أعلى جهد اختزال معياري؛
أي أنه أقوى عامل مؤكسد. أمّا ترتيبُ الموادِّ حَسَبَ قوَّتها كعوامل مؤكسدة، فهو:
+MnO4- > Cl2 > Cd2+ > Al3
المثال 23 : أستعينُ بجدول جهود الاختزال المعياريّة، ثُمَّ أُجيبُ عنِ الأسئلة الآتية:
| نصف تفاعل الاختزال | E° ( V) |
| K+ + e- K | - 2.92 |
| Co2+ + 2e- Co | - 0.28 |
| I2 + 2e- 2I- | + 0.54 |
| Ag+ + e- Ag | + 0.80 |
1 - أُرَتِّبُ الموادَّ الآتية تصاعديًّا وفقَ قوَّتها كعواملَ مختزلة في الظروف المعياريّة:
Ag , K , I- , Co
هل يمكنُ لأيونات الكوبلت +Co2 أكسدةُ أيونات اليوديد - I؟ أُفَسِّرُ إجابتي.
الحل:
1 - بالعودة إلى جدول جهود الاختزال المعياريّة، أختارُ أنصافَ التفاعلات للموادِّ السابقة،
وَأُرَتِّبُها وفقَ تزايد جهود الاختزال المعيارية،
فيكونُ أسفلُ يمين الجدول، وهو Ag ، أضعفَ عامل مختزل؛ أي أقلها ميلً للتأكسد،
ويكونُ أعلى يمين الجدول، وهو K، أقوى عامل مختزل؛ أي أكثرها ميلً للتأكسد،
ويكونُ ترتيبُ بقيّة العوامل المختزلة تصاعديًّا كالآتي:
K > Co > I- > Ag
أُقارنُ جهودَ الاختزال المعياريّة للكوبلت واليود، فَأُلاحِظُ أنَّ جهد الاختزال المعياري لليود أعلى منه للكوبلت؛
أي أنَّ اليود أكثرُ ميلً للاختزال من أيونات الكوبلت؛ لذلك لا تؤكسِدُ أيوناتُ الكوبلت +Co2 أيونات اليوديد -I .
المثال 24
أدرسُ جهودَ الاختزال المعياريّة في الجدول، ثمَّ أُجيبُ عنِ الأسئلة الآتية:
| نصف تفاعل الاختزال | E° ( V) |
| Cr3+ + 3e- Cr | - 0.73 |
| Cl2 + 2e- 2Cl- | + 1.36 |
| Ni2+ + 2e- Ni | - 0.23 |
| Pb2+ + 2e- Pb | - 0.13 |
1 - أُحَدِّدُ أقوى عامل مؤكسد.
2 - أُحَدِّدُ أقوى عامل مختزل.
3 - هل يستطيع النيكل Ni اختزالَ جُزيئات الكلور Cl2 ؟ أُفَسِّرُ إجابتي.
4- هل تستطيع أيوناتُ الكروم +Cr3 أكسدة الرصاص Pb ؟ أُفَسِّرُ إجابتي.
الحل:
1 - أُحَدِّدُ أقوى عامل مؤكسد: تحدثُ للعامل المؤكسد عمليّةُ اختزال، وأقوى عامل مؤكسد هو المادَّةُ التي لها أعلى جهد اختزال معياري،
وَيَتَّضِحُ منَ الجدول أنه الكلور Cl2 ،وجهدُ اختزاله المعياري E°=1.36 V
2-أُحَدِّدُ أقوى عامل مختزل: تحدثُ للعامل المختزل عمليّةُ تأكسد، وأقوى عامل مختزل هو المادَّةُ التي لها أقلُّ جهد اختزال معياري،
وَيَتَّضِحُ منَ الجدول أنه الكروم Cr ، وجهدُ اختزاله المعياري E°= -0.73 V
3-أُقارنُ جهدَ اختزال النيكل ( E°= -0.23 V) وجهدَ اختزال الكلور ( E°= +1.36 V )، فَأُلاحِظُ أنَّ
جهد اختزال النيكل المعياري أقلُّ من جهد اختزال الكلور المعياري؛ لذلك يتأكسدُ النيكل ويختزلُ جُزيئات الكلور.
ويمكنُ كتابةُ معادلة التفاعل المتوقع وحسابُ جهد الخليّة المعياري للتفاعل كالآتي:
-Ni + Cl2 → Ni2+ + 2Cl
E°cell = E°cathode(Cl2) - E°anode(Ni)
E°cell = 1.36 – ( - 0.23 ) = 1.59 V
بما أنَّ الجهد موجبٌ فالتفاعلُ تلقائي.
4-أُقارنُ جهدَ اختزال الرصاص ( E°= -0.13 V ) وجهدَ اختزال الكروم (E°= -0.73 V )،
فَأُلاحِظُ أنَّ جهد اختزال الرصاص المعياري أعلى من جهد اختزال الكروم المعياري؛
لذلك لا تستطيعُ أيوناتُ الكروم +Cr3 أكسدة الرصاص.
ويمكنُ كتابةُ معادلة التفاعل المتوقع وحسابُ جهد الخليّة المعياري للتفاعل كالآتي:
Cr3+(aq) + 3Pb(s) → 3Pb2+(aq) + 2Cr(s)
E° cell = -0.73 – (- 0.13 ) = - 0.60 V
بما أنَّ الجهد سالبٌ فالتفاعلُ غيرُ تلقائي.
أتحقَّق:
| نصف تفاعل الاختزال | E° ( V) |
| Cr2O72- + 14H+ + 6e- 2Cr2+ + 7H2O | + 1.33 |
| Ag+ + e- Ag | + 0.80 |
| Sn 2+ + 2e- Sn | - 0.14 |
| Au3+ + 3e- Au | + 1.50 |
أدرسُ الجدولَ الآتي، الذي يتضمَّنُ جهودَ الاختزال المعياريّة لبعض المواد، ثمَّ أُجيبُ عنِ الأسئلة الآتية:
1 - أُحَدِّدُ أقوى عامل مؤكسد وأقوى عامل مختزل.
2-أستنتج أيُّ الفِلِزّاتِ تختزلُ أيونات 2-Cr2O7 ولا تختزلُ أيونات +Sn2 ؟
إجابة سؤال أتحقق:
1- أقوى عامل مؤكسد: +Au3 ، أقوى عامل مختزل: Sn
2- Ag
أفكر: أرتب الفلزات ذوات الرموز الإفتراضية X ، Y ، Z وفق قوتها كعوامل مختزلة إذا علمت أن:
الفلز X يختزل أيونات +Z2 ولا يختزل أيونات +Y
إجابة سؤال أفكر: ترتيب الفلزات حسب قوتها كعوامل مختزلة: Y > X > Z
تطبيقاتٌ عمليّة للخليّة الجلفانيّة Applications of the Galvanic Cell
البطّاريات Batteries
تُعَدُّ البطّارياتُ منَ التطبيقات العمليّة المهمّة للخلايا الجلفانيّة؛ إذ تحدثُ فيها تفاعلاتُ تأكسد واختزال تلقائيّة
تتحوَّلُ فيها الطاقة الكيميائيّة إلى طاقة كهربائيّة،
وتختلفُ البطّاريات في ما بينها في مكوَّناتها، ومن ثَمَّ تختلفُ تفاعلاتُ التأكسد والاختزال التي تُولِّدُ الطاقة الكهربائيّة فيها. هناك أنواعٌ مختلفة منَ البطّاريات، منها:
البطّارياتُ الأوليّة التي تُستخدَمُ مرّةً واحدة ولا يمكن إعادة شحنها، مثل:
البطّاريات الجافّة، والبطّاريات الجافّة القلويّة.
ومن أنواعها أيضًا البطّارياتُ الثانويّة، وهي قابلةٌ لإعادة الشحن،
مثل: بطّاريات التخزين، كالمركم الرصاصي (بطّاريّة الرصاص الحِمضيّة)، وبطّاريّة أيون الليثيوم،
أنظرُ الشكل ( 8).
بطّاريّةُ الرصاص للتخزين Lead Storage Battery
تُعَدُّ بطّاريّة الرصاص الحِمضيّة مثالً على البطّاريات الثانويّة؛ أي يمكنُ إعادةُ شحنها،
وتتكوَّنُ من سِتِّ خلايا جلفانيّة تتكوَّنُ كلٌّ منها من ألواح منَ الرصاص تمثلُ فيها المِصعد،
وألواحٍ منَ الرصاص المغلَّف بأكسيد الرصاص PbO2 IV تمثلُ المِهبط.
تُرَتَّبُ هذه الأقطابُ (الخلايا) بوعاء بلاستيكي مقوّى بطريقة متبادلة تفصلُ بينها صفائحُ عازلةٌ،
وَتُغمَرُ في محلول حِمض الكبريتيك الذي كثافته 1.28g/cm3 ، وتوصلُ ببعضها على التوالي، كما يوضِّحُ الشكل ( 9)،
أمّا أنصافُ التفاعلات التي تحدثُ فيها فهي:
Pb + HSO4- → PbSO4 + H+ + 2e- :تفاعل المِصعد
PbO2 + 3H+ + HSO4- + 2e- → PbSO4+2H2O :تفاعل المِهبط ______________________________________________________________________________
Pb + PbO2 + 2H+ + 2HSO4- → 2PbSO4 + 2H2O :التفاعل الكلي
جهد الخليّة الواحدة يساوي 2V تقريبًا؛ أي أنَّ البطّاريّة تعطي فرقَ جهد يساوي 12V .
يُلاحظُ منَ المعادلات الكيميائيّة أنَّ حِمض الكبريتيك يُستهلَكُ نتيجة استخدام البطّاريّة؛
ممّا يؤدي إلى نقصان كثافته؛ لذلك يمكنُ مراقبة كفاءة البطّاريّة من خلال قياس كثافة حِمضِها.
عند شحن البطّاريّة بواسطة تيّار كهربائي يجري عكسُ تفاعُلَيِّ التأكسدِ والاختزال، ومن ثَمَّ التفاعل الكُلي في البطّاريّة،
وفي السيارات تجري عمليّةُ الشحن بشكل تلقائي ومستمرٍّ بواسطة مولِّد التيّار (الدينامو) المُتَّصِلِ بمحرّك السيّارة.
ويتراوح عمرُ البطّاريّة من 3- 5 سنوات تقريبًا؛ إذ إنها تفقدُ صلاحيَّتَها نتيجة فقدان جزء من مكوِّناتها، مثل PbSO4(s) الذي يتكوَّنُ نتيجة عمليَّتي التأكسدِ
الاختزال اللتين تحدثان فيها، ونتيجة الحركة المستمرَّة للمركَبات على الطرق، التي تؤدي إلى تساقطه عن ألواح الرصاص، ومن ثَمَّ عدم دخوله في التفاعل
العكسي، الذي يؤدي إلى إعادة شحن البطّاريّة.
بطّاريّة أيون الليثيوم Lithium – Ion Battery
تُعَدُّ بطّاريّة أيون الليثيوم من أكثر أنواع البطّاريات استخدامًا في الوقت الحاضر،
وقد استُخدمت للمرَّة الأولى عام 1991 ، أمّا اليوم فإنها تُعَدُّ مصدرَ الطاقة الرئيس للعديد من وسائل التكنولوجيا وأدواتها في المجالات المختلفة؛
حيث تُستخدَمُ في السيارات الكهربائيّة والحواسيب والهواتف المحمولة والعديد منَ الأجهزة الكهربائيّة الاستهلاكيّة الأخرى،
أنظرُ الشكل ( 10 )؛
مِمَّ تتكوَّنُ بطّاريّة أيون الليثيوم؟ وما التفاعلاتُ الكيميائيّة التي تحدثُ فيها؟ وما ميزاتُها؟
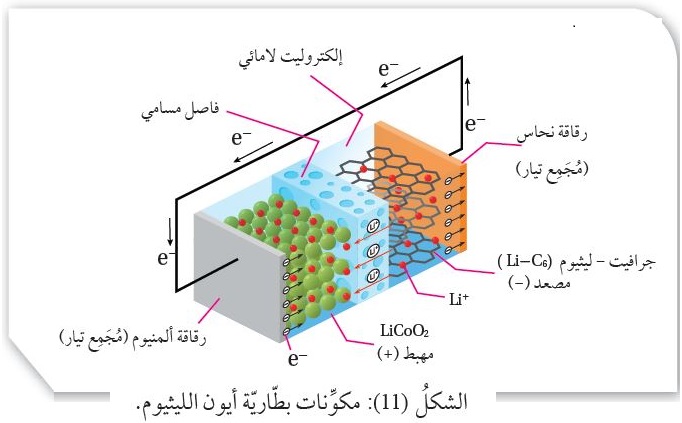
تتكوَّنُ بطّاريّة أيون الليثيوم من عدّة خلايا مُتَّصلة ببعضها، تتكوَّنُ كلٌّ منها من ثلاثة مكوِّنات رئيسة، هي:
- المِصعد (القطب السالب): يتكوَّنُ عادةً منَ الجرافيت، الذي يتميَّزُ بقدرته على تخزين (استيعاب) ذرّات الليثيوم وأيوناته دونَ التأثير فيها.
- المِهبط (القطب الموجب): يتكوَّنُ من بلّورات لأكسيد عنصر انتقالي، مثل أكسيد الكوبلت CoO2) IV ) الذي يمكنه أيضًا تخزينُ (استيعاب) أيونات الليثيوم، مثل الجرافيت،
أنظرُ الشكل ( 11 ).
- المحلول الإلكتروليتي: يتكوَّنُ من محلول لامائي لأحد أملاح الليثيوم ومذيب عضوي يذوب فيه الملح،
وعادةً يُستخدَمُ LiPF6 مُذابًا في كربونات الإيثيلين CH2CH2CO3 ،
وتولِّدُ خلايا أيون الليثيوم الكهرباءَ من خلال تفاعل التأكسد والاختزال الآتي:
نصف تفاعل التأكسد: -Li → Li+ + e
نصف تفاعل الاختزال: Li+ + CoO2 + e- → LiCoO2
التفاعل الكلي: Li + CoO2 → LiCoO2 E°cell = 3.4 V
حيث تتأكسدُ ذرّات الليثيوم عند المِصعد متحوِّلة إلى أيونات + Li ، تنتقلُ عبرَ المحلول الإلكتروليتي باتجاه المِهبط،
بينما تتحرَّكُ الإلكتروناتُ عبرَ الدارة الخارجيّة منَ المِصعد إلى المِهبط؛ حيث تختزِلُ أيونات الكوبلت من +Co4 في أكسيد الكوبلت CoO2 إلى +Co3 في LiCoO2 ،
وهي عمليّةٌ ينعكسُ مسارُها خلالَ شحن البطّاريّة: فيتأكسدُ LiCoO2 وتتحرَّكُ أيوناتُ الليثيوم +Li عبرَ المحلول الإلكتروليتي باتجاه نصف خليّة الجرافيت؛ حيث تُختَزَل.
تستمدُ بطّاريّة أيون الليثيوم ميزاتِها من أنَّ لليثيوم أقلَّ جهد اختزال معياري؛ أي أنه أقوى عامل مختزل، وكذلك فإنه أخفُّ عنصر فِلِزّي؛
حيث إنَّ g 6.941 منه (كتلته الموليّة) كافيةٌ لإنتاج 1 مول منَ الإلكترونات؛ أي أنَّ البطّاريّة خفيفة الوزن، وكثافة طاقتها عالية، ويمكن إعادة شحنها مئات المرّات.
الربطُ معَ الحياة:
خلايا الوقود هي خلايا جلفانيّةٌ تنتج الطاقة الكهربائية من تفاعل غازي الأكسجين والهيدروجين وفق المعادلة الآتية: 2H2 + O2 → 2H2O ،
وتتميز عن البطاريات بأنها لا تنضب ولا تحتاج إلى شحن، وقد استخدمت هذه الخلايا في تزويد المركبات الفضائية بالطاقة،
وتستخدمها المستشفيات في توليد الطاقة حال انقطاع التيار الكهربائي، وتستخدم في دول عدّة في تشغيل بعض الحاف الت والسيارات.
تآكلُ الفِلِزّات Corrosion of Metals
يُعَرَّفُ تآكلُ الفِلِزّات Corrosion of Metals بأنه تفاعلُها معَ الهواء الجوي والموادِّ في البيئة المحيطة،
فتفقدُ العديدَ من خصائصها وتتحوَّلُ إلى موادَّ جديدةٍ أكثرَ ثباتًا كيميائيًّا، كأكاسيد الفِلِزّات وهيدروكسيداتها وكبريتيداتها وكربوناتها.
ولهذه العمليّة أضرارٌ اقتصاديّة كبيرة؛ فمثلً يتآكلُ الحديدُ بفعل الهواء الجوي الرطب وينتج صدأ الحديد الصُّلب الهش،
الذي يحتاجُ تعويضُ خسائره إلى خمس كميّة الحديد المُستخرَج سنويًّا.
يُصنَعُ منَ الحديد الهياكلُ الرئيسة للجسور والمباني والسيارات؛ لذلك فإنَّ منع تآكله يُعَدُّ أمرًا بالغ الأهميّة،
ولتحقيق ذلك لا بُدَّ أوَّلً من معرفة آليّة تآكل الحديد؛
فالحديد يتآكلُ بفعل تفاعل كهروكيميائي يحدث بوجود الأكسجين والماء معًا؛
إذ يتأكسدُ الحديدُ عند تَكَشُّفِ سطحه بفعل شقٍّ أو كشطٍ أو كسرٍ إلى أيونات الحديد +Fe2 ،فيصبحُ هذا الجزءُ مِصعدَ الخليّة،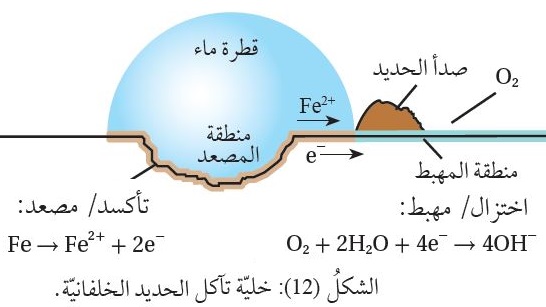
وتتحرَّكُ الإلكتروناتُ الناتجة عن تأكسده من منطقة الحديد المُغَطّاه بقطرة الماء إلى حافتها حيثُ يوجدُ الهواءُ والقليلُ منَ الماء،
وهناك يُختَزَلُ أكسجينُ الهواء مكوِّنًا أيوناتِ الهيدروكسيد -OH، وتمثلُ هذه المنطقةُ مِهبط الخليّة،
كما يوضِّحُ الشكل ( 12 ).
تتحرَّكُ أيوناتُ الحديد +Fe2 من مركز القطرة باتجاه حافتها، وتتحرَّكُ أيوناتُ الهيدروكسيد -OH بالاتجاه المعاكس،
وتتفاعلان عند التقائهما وينتج هيدروكسيد الحديد Fe(OH)2 II ، الذي سرعان ما يتأكسدُ مكوِّنًا الصَّدأ،
حَسَبَ المعادلة الكيميائيّة الآتية:
4Fe(OH)2(s) + O2(g) → 2Fe2O3 . H2O(s) + 2H2O(l)
وصدأ الحديد مادَّةٌ صُلبةٌ هَشَّةٌ بُنِّيَةِ اللون تتكوَّنُ على الأشياء الحديديّة وتتقشَّرُ بسهولة مُعَرِّضَةً سطحَ الحديد أسفلَ منها لمزيد منَ التآكل.
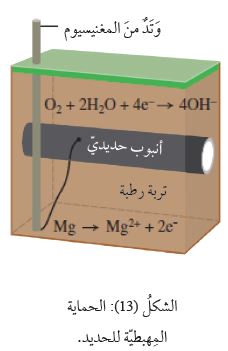
وَتُستعمَلُ طرائقُ عِدَّةٌ لحماية الحديد منَ التآكل، منها
طريقةُ الحماية المِهبطيّة Cathodic Protection ،
التي تُستخدَمُ لحماية خطوط الأنابيب الحديديّة المدفونة في الأرض (الغاز أو النَّفط) وأجسام السُّفن،
وتعتمدُ هذه الطريقة على تشكيل خليّة جلفانيّة يكونُ فيها الحديدُ المِهبط، وأحدُ الفِلِزّات النَّشِطة (مغنيسيوم، خارصين) المِصعد،
أمّا التربةُ الرطبةُ أو مياهُ البحر فتمثلُ المحلولَ الإلكتروليتي.
فمثلً، إذا وُصِلَت الأنابيبُ الحديديّة بأوتاد منَ المغنيسيوم، أنظرُ الشكل ( 13 )،
فَسَأُلاحِظُ تأكسدَ المغنيسيوم (المِصعد) وانتقالَ الإلكترونات عبرَ السلك المعزول إلى الأنبوب الفولاذي (المِهبط)،
فَتُختَزَلُ جُزيئاتُ الأكسجين، وبذلك يتأكسد المغنيسيوم ويحمي الحديدَ منَ التآكل.
أمّا في السُّفن، فَتُوصَلُ أقطابٌ منَ المغنيسيوم بهيكل السفينة لتجري حمايتُها بالطريقة السابقة نفسِها،
وَتُستَبْدَلُ أقطاب المغنسيوم المتآكلة بأقطابٌ أخرى بشكل دوري.
أتحقَّق:
1- أكتبُ معادلة التفاعل الكُلي الذي يحدثُ في بطّاريّة الرصاص الحِمضية خلالَ شحنها.
2- أُفَسِّر: يُعَدُّ تآكلُ الحديد خليّةً جلفانيّة.
إجابة سؤال أتحقق:
2PbSO4 + 2H2O → Pb + PbO2 + 2H+ + 2HSO4-
يتآكلُ الحديد بفعل بوجود الأكسجين والماء معًا؛ إذ يتأكسدُ الحديدُ عند تَكَشُّفِ سطحه الى أيونات الحديد +Fe2 ، فيصبحُ هذا الجزءُ مِصعدَ الخليّة،
وتتحرَّكُ الإلكتروناتُ الناتجة عن تأكسده من منطقة الحديد المُغَطّاه بقطرة الماء إلى حافتها حيثُ يوجدُ الهواءُ والقليلُ منَ الماء،
وهناك يُختَزَلُ أكسجينُ الهواء مكوِّنًا أيوناتِ الهيدروكسيد OH- ، وتمثلُ هذه المنطقةُ مِهبط الخليّة،
تتحرَّكُ أيوناتُ الحديد +Fe2 من مركز القطرة باتجاه حافتها، وتتحرَّكُ أيوناتُ الهيدروكسيد -OH بالاتجاه المعاكس، وتتفاعلان عند التقائهما
وينتج هيدروكسيد الحديد Fe(OH)2 II ، الذي سرعان ما يتأكسدُ مكوِّنًا الصَّدأ، حَسَبَ المعادلة الكيميائيّة الآتية:
4Fe(OH)2(s) + O2(g) → 2Fe2O3 . H2O(s) + 2H2O(l)