- المفاهيم والمصطلحات :
عزيزي الطالب ستتعرف في هذا الدرس على هذه المفاهيم والمصطلحات العلمية :
|
التأكسد |
Oxidation |
|
الاختزال |
Reduction |
|
تفاعلات التأكسد والاختزال |
Oxidation – Reduction Reaction |
|
نصف تفاعل التأكسد |
Half Oxidation Reaction |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Anode |
|
|
|
|
|
|
الدرس الأول: التأكسد والاختزال والخلايا الغلفانية Oxidation – Reduction and Galvanic Cell)):
- مفهوم التأكسد والاختزال : (Oxidation – Reduction Concept):
- من الأمثلة على تفاعلات التأكسد والاختزال :
- صدأ الحديد
- احتراق الفحم
- تحول لون قطعة التفاح إلى اللون البني
- الشكل الأتي يمثل إحتراق الفحم:

- مفهوم التأكسد والاختزال بالإعتماد على الأكسجين : ( Oxidation – Reduction Concept depending on Oxygen):
- اعتمد الكيميائيون قديمًا مفهوم التأكسد إشارةً إلى تفاعل العنصر مع الأكسجين منجًا أكسيد العنصر
- التأكسد (Oxidation) : عملية إضافة الاكسجين إلى العنصر أو المركب
- الاختزال (Reduction) : عملية نزع الأكسجين من المركب
- فمثلًا :
- يتفاعل فلز النحاس Cu مع غاز الاكسجين O2 فينتج أكسيد النحاس CuO (ll) وفقًا للمعادلة الآتية :
- وبهذا، فإن فلز النحاس Cu قد تحول بعد التفاعل إلى أكسيد النحاس CuO (ll) أي أن النحاس قد تأكسد
- تُعد تفاعلات التنافس على الأكسجين أيضًا من تفاعلات التأكسد والاختزال مثل :
- تفاعل فلز الخارصين Zn مع أكسيد النحاس CuO (ll) الموضح في المعادلة الآتية :
- يتضح من المعادلة السابقة أن :
+ فلز الخارصين Zn تفاعل مع الأكسجين، فنتج عنه أكسيد الخارصين ZnO أي أن الخارصين قد تأكسد
+ أكسيد النحاس CuO (ll) تحول إلى Cu وذلك بنزع الأكسجين منه وهذا يعني إختزال أيون Cu2+ في أكسيد النحاس CuO (ll).
- تفاعلات التأكسد والاختزال (Oxidation - Reduction Reaction ) :
"هي التفاعلات التي تحدث فيه عمليتان مترافقتان، إحداهما تأكسد والأخرى اختزال"
مثال (1) :
يستخدم تفاعل الثيرمايت في لحام السكك الحديدية، إذ ينتج من هذا التفاعل كمية كبيرة من الطاقة الحرارية الكافية لصهر الحديد، ما يتيح صب الحديد المصهور مباشرة في الشقوق في مسار السكة الحديدية، الثيرمايت هو تفاعل أكسيد الحديد Fe2O3 (lll) مع فلز الألمنيوم Al منتجًا أكسيد الألمنيوم Al2O3 وفلز الحديد Fe، أُحدد المادة التي تأكسدت والمادة التي اختزلت في المعادلة الأتية :
الإجابة :
ألاحظ من المعادلة أن ذرة الألمنيوم Al تحولت إلى أكسيد الألمنيوم Al2O3 وهذا يعني إضافة الأكسجين إليها، أي أن ذرة الألمنيوم تأكسدت، ونلاحظ من المعادلة تحول أكسيد الحديد Fe2O3 (lll) إلى ذرة حديد Fe وهذا يعني نزع الاكسجين منه، أي أن أيون الحديد Fe3+ في أكسيد الحديد Fe2O3 حدث له اختزال.
سؤال (1):
أُحدد المادة التي تأكسدت وتلك المادة التي اختزلت في معادلة تفاعل اكسيد الحديد Fe2O3 (lll) مع أول أكسيد الكربون CO :
الإجابة :
المادة التي تأكسدت هي الكربون C : لأنها ارتبطت بالأكسجين
المادة التي اختزلت هي أيونات الحديد Fe3+ في مركب Fe2O3: لأن الأكسجين قد نزع منها
- مفهوم التأكسد والاختزال بالإعتماد على إنتقال الإلكترونات : ( Oxidation – Reduction Concept depending on Electron Transfer):
ملاحظة (1) :
- يصف تفاعل العنصر أو المركب مع الأكسجين بأنه تفاعل تأكسد
- يصف نزع الأكسجين من المركب بأنه تفاعل إختزال
- بعض التعريفات المهمة :
- التأكسد : هو فقد الإلكترونات في أثناء التفاعل
- الإختزال : هو إكتساب الإلكترونات في أثناء التفاعل
- نصف تفاعل التأكسد : هي المعادلة التي تظهر فيها الإلكترونات جهة المواد الناتجة
- نصف تفاعل الإختزال : هي المعادلة التي تظهر فيها الإلكترونات جهة المواد المتفاعلة
- مثال للتوضيح :
في معادلة تفاعل فلز الخارصين Zn مع أكسيد النحاس CuO (ll) الآتية :
- حدد المادة التي تأكسدت والمادة التي اختزلت واكتب نصف تفاعل التأكسد ونصف تفاعل الإختزال :
الإجابة :
- نكتب المعادلة على الصورة الأيونية الآتية :
- نحذف الأيونات المتفرجة التي تظهر على طرفي المعادلة وهي أيونات الأكسجين فتبقى المعادلة الأيونية النهائية :
- نلاحظ من المعادلة أن ذرة الخارصين Zn في المواد المتفاعلة تحولت إلى أيون الخارصين Zn2+ في المواد الناتجة وأن أيون النحاس Cu2+ في المتفاعلات قد تحول إلى ذرة النحاس Cu في المواد الناتجة كما يأتي :
أقسم المعادلة إلى قسمين كما يأتي :
- أُضيف عددًا من الإلكترونات إلى كل نصفٍ بعدد الشحنات الموجبة نفسها لموازنتها كما يأتي :
- بهذا فإن أيونات النحاس Cu2+ قد اكتسبت إلكترونين لتكوين ذرة النحاس Cu ويوصف أيون النحاس Cu2+ أنه اختزل .
- في حين فقدت ذرة الخارصين Zn إلكترونين وتكون أيون الخارصين Zn2+ ، فتوصف ذرة الخارصين Zn بأنها تأكسدت .
- نصف تفاعل التأكسد : هي المعادلة التي تظهر فيها الإلكترونات جهة المواد الناتجة :
- نصف تفاعل الاختزال : هي المعادلة التي تظهر فيها الإلكترونات جهة المواد المتفاعلة :
ملاحظة (2) :
إن عدد الإلكترونات المفقودة في نصف تفاعل التأكسد يساوي عدد الإلكترونات المكتسبة في نصف تفاعل الاختزال، لذلك لا تكتب الإلكترونات في معادلة تفاعل التأكسد والإختزال .
مثال (2) :
احدد المادة التي تأكسدت وتلك التي تختزل في معادلة التفاعل الآتية :
الإجابة :
نلاحظ تحول ذرة الخارصين Zn إلى أيون الخارصين +Zn2 وهذا يعني أن الذرة فقدت إلكترونين، أي أنها تأكسدت
نصف تفاعل التأكسد :
نلاحظ تحول أيون النيكل Ni2+ إلى ذرة النيكل Ni وهذا يعني أن أيون النيكل قد اكتسب إلكترونين، أي أنه اختزل .
نصف تفاعل الإختزال :
مثال (3) :
يتفاعل فلز الألمنيوم Al مع أيونات الفضة Ag+ وفقًا للمعادلة الآتية :
أكتب نصف تفاعل التأكسد ونصف تفاعل الإختزال :
الإجابة :
نلاحظ تحول ذرة الألمنيوم Al إلى أيون الألمنيوم +Al3 وهذا يعني ان ذرة الألمنيوم قد فقدت ثلاث إلكترونات أي أنها قد تأكسدت
نصف تفاعل التأكسد :
نلاحظ تحول أيون الفضة Ag+ إلى ذرة الفضة Ag وهذا يعني أن أيون الفضة قد اكتسب إلكترونًا واحدًا، أي حدث له إختزال .
نصف تفاعل الإختزال :
ولكي يكون عدد الإلكترونات المفقودة يساوي عدد الإلكترونات المكتسبة فإن ذرة الألمنيوم Al)) الواحدة تفقد ثلاث إلكترونات، وكل أيون فضة (Ag+) يكسب إلكترونًا واحدًا، لذلك؛ يجب توافر ثلاث أيونات فضة (Ag+) لإكتساب الإلكترونات الثلاث، ويتحقق ذلك من خلال :
ضرب معادلة نصف تفاعل الإختزال في العدد 3 لذلك يمكن التعبير عن نصف تفاعل الإختزال كما يأتي :
سؤال (2):
هل أيون النحاس Cu2+ يتأكسد أم يختزل وفقًا لنصف التفاعل الآتي : أُفسر إجابتي :
الإجابة :
أيون النحاس قد اختزل لأنه قد اكتسب إلكترون وتحول إلى Cu+
- العامل المؤكسد والعامل المختزل (Oxidizing Agent and Reducing Agent):
- إن عمليتي التأكسد والاختزال هما عمليتين مترافقتين حيث أنه إذا حدث تأكسد لمادة في التفاعل الكيميائي يجب أن يقابله اختزال مادة في نفس التفاعل.
- العامل المؤكسد : هي المادة التي تختزل وتسبب التأكسد لغيرها.
- العامل المختزل : هي المادة التي تتأكسد وتسبب الاختزال لغيرها .
- ملاحظة (3)
بالرغم من أن التأكسد والإختزال يحدث لذرة واحدة واحدة في المركب أو الأيون متعدد الذرات، إلا أن كامل المركب أو الأيون يسمى العامل المؤكسد أو العامل المختزل وليس ذرة لوحدها
- مثال للتوضيح :
في تفاعل فلز الخارصين Zn مع أكسيد النحاس CuO (ll) كما في المعادلة الآتية :
حدد العامل المؤكسد والعامل المختزل :
- العامل المؤكسد : هي المادة التي تختزل وتسبب التأكسد لغيرها : وفي هذا التفاعل فإن المادة التي اختزلت هي أكسيد النحاس CuO (ll) وتسببت في أكسدة الخارصين .
- العامل المختزل : هي المادة التي تأكسدت وتسببت في اختزال غيرها ، وفي هذا التفاعل فأن المادة التي تأكسدت هي الخارصين Zn وتسببت في اختزال أكسيد النحاس CuO (ll)
- إذا العامل المؤكسد : أكسيد النحاس CuO (ll)
- العامل المختزل : الخارصين Zn
- نلاحظ من التفاعل أن :
الاختزال حدث لأيون النحاس في أكسيد النحاس CuO (ll) إلا أن أكسيد النحاس يسمى عاملًا مؤكسدًا وليس أيون النحاس لوحده .
مثال (4) :
أحدد العامل المختزل في نصف التفاعل الآتي :
الإجابة :
نلاحظ أن ذرة الصوديوم Na)) قد فقدت إلكترونًا واحدًا وتكون أيون الصوديوم (+Na) أي أن ذرد الصوديوم (Na) قد تأكسدت وبالتالي فهي العامل المختزل
العامل المختزل : Na
سؤال (3):
أحدد العامل المؤكسد في نصف التفاعل الآتي :
الإجابة : العامل المؤكسد : Sn2+
- الربط بالحياة :
تعد الألعاب النارية مثالًا على تفاعلات التأكسد والإختزال، وتتضمن الألعاب النارية وجود العوامل المؤكسدة والعوامل المختزلة والمواد الملونة .
العوامل المؤكسدة مثل : النترات والكلورات التي تنتج الأكسجين اللازم للإحتراق
العوامل المختزلة مثل : الكبريت والكربون التي تتفاعل مع الاكسجين لإنتاج الطاقة الحرارية الكافية لحدوث الإنفجار
الألوان الناتجة تعود إلى وجود أيونات الفلزات حيث أن :
أيونات الفلزات المسؤولة عن اللون الأحمر هما : أيونات الليثيوم والسترونشيوم
أيونات الفلزات المسؤولة عن اللون الأبيض هما : أيونات المغنيسيوم والكالسيوم
أيونات الفلزات المسؤولة عن اللون الأزرق هي : أيونات النحاس
- يجب توخي الحذر عند استخدام الألعاب النارية لما قد تسببه من أضرار
- التأكسد والاختزال وعلاقته بإنتاج الكهرباء : (Oxidation – Reduction Produce Electricity):
- الشكل الآتي يمثل قنديل بحر مضيء :

إن إضاءة قنديل البحر تكون ناتجة عن حدوث تفاعل تأكسد واختزال منتج للطاقة الضوئية
- حدوث عملية البناء الضوئي في النباتات ، يحدث تفاعل تأكسد اختزال يمتص الضوء .
- تتفاوت الفلزات في نشاطها حيث أن :
- الفلز الأنشط يحل محل الفلز الأقل نشاطًا، ويتم ذلك من خلال تفاعل التأكسد والاختزال حيث :
- يتأكسد الفلز الأنشط ويختزل أيونات الأقل نشاطًا الموجود معه في وعاء التفاعل .
- مثال للتوضيح :
عند وضع مسمار من الحديد Fe في محلول كبريتات النحاس CuSO4
- فإن الحديد يتأكسد بفقد إلكترونين ويتحول إلى أيون الحديد +Fe2 حسب نصف التفاعل الآتي :
- تنتقل الإلكترونات مباشرة إلى أيونات النحاس Cu2+ الموجودة في المحلول، حيث تكتسبها وتحولها إلى ذرات نحاس Cu حسب نصف التفاعل الآتي :
- يترسب النحاس على مسمار الحديد كما في الشكل الآتي :
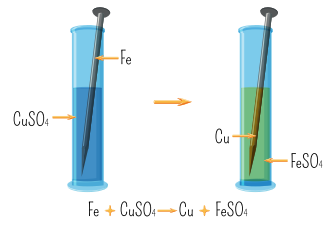
- توصل العلماء إلى أنه يمكن الإستفادة من تفاعلي التأكسد والإختزال اللذين حدثا بوصفهما مصدرًا للطاقة الكهربائية .
- الخلايا الكهركيميائية : (Electrochemical Cells) :
- تعريفها : هي الأدوات التي تحدث فيها تفاعلات التأكسد والاختزال منتجة الطاقة الكهربائية أو مستهلكة لها .
- أقسامها : تقسم الخلايا الكهركيميائية إلى : ( خلايا غلفانية ، خلايا التحليل الكهربائي )
- الخلايا الغلفانية : (Galvanic Cells)
- تعريفها : هي الأدوات التي يحدث فيها تفاعلات تأكسد واختزال يؤديان إلى إنتاج تيار كهربائي، حيث تتحول الطاقة الكيميائية إلى الطاقة الكهربائية
- أشهر الأمثلة عليها : تعد البطاريات أكثر الأمثلة شيوعًا على الخلايا الغلفانية حيث أن جميع البطاريات مثل :
- بطاريات الساعة، الهاتف المحمول، السيارة الكهربائية، فضلًا عن البطاريات المستخدمة في كثير من الأجهزة والألعاب.
- الخلايا الغلفانية البسيطة : (Simple Galvanic Cells) :
- مكوناتها :
1- وعاء يحتوي صفيحتين فلزيتين مغموستين في محلول كهرلي لأحد أملاح الفلز الأقل نشاطًا، حيث تشكل الصفيحتان قطبي الخلية
2- فولتميتر يشير إلى حركة الإلكترونات في الخلية بين الأقطاب ويعطي القراءة التي تمثل قيمة فرق الجهد الكهربائي المتولد في الخلية .
3- أسلاك توصيل تربط بين الأقطاب والفولتميتر .
- بعض المصطلحات المهمة :
- القطب (Electrode) : هو مادة صلبة موصلة في دارة كهربائية ينقل الإلكترونات من المحلول أو المصهور وإليه .
- المحلول الكهرلي (المادة الكهرلية) (Electrolyte): هو مادة تتفكك إلى أيونات موجبة وأخرى سالبة حرة الحركة عند صهرها أو إذابتها في الماء تسمح بمرور التيار الكهربائي .
- المادة غير الكهرلية (Non- Electrolyte) : هي مادة لا تتفكك إلى أيونات حرة الحركة عند صهرها أو ذوبانها في الماء بل تبقى على هيئة جزيئات متعادلة .
- المصعد (Anode) : هو القطب الذي يحدث عليه نصف تفاعل التأكسد ويمثل القطب السالب في الخلية
- المهبط (Cathode) : هو القطب الذي يحدث عليه نصف تفاعل الاختزال ويمثل القطب الموجب في الخلية
ملاحظة (3) :
يمثل المصعد القطب الذي يحدث عليه تفاعل التأكسد وهو القطب السالب في الخلية وذلك لأنه مصدر الإلكترونات في الخلية .
يمثل المصعد القطب الذي يحدث عليه تفاعل الاختزال وهو القطب الموجب في الخلية وذلك لأن الإلكترونات تتحرك نحوه.
تقل كتلة المصعد لأنه تأكسد وتحولت ذراته إلى أيونات وتزداد كتلة المهبط لأنه اختزل وتحولت أيوناته إلى ذرات
تكون حركة الإلكترونات في الخلية الغلفانية من المصعد إلى المهبط .
مثال للتوضيح :
خلية غلفانية بسيطة قطباها هما فلز النحاس Cu وفلز الخارصين Zn في محلول كبريتات النحاس CuSO4 كما في الشكل الآتي :
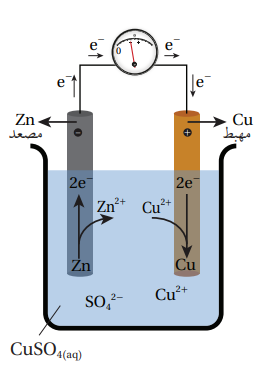
- نلاحظ أن الخلية الغلفانية تتكون من صفيحتي الخارصين والنحاس، حيث تشكل الصفيحتين قطبي الخلية وينقلان الإلكترونات من المحلول وإليه .
- الصفيحتان مغموستان في محلول كبريتات النحاس CuSO4 حيث يتفكك ملح كبريتات النحاس في الماء إلى أيونات حرة الحركة
- تتصل كل صفيحة بسلكٍ يتصل بالفولتميتر ، حيث:
- تشير حركة مؤشر الفولتميتر إلى مرور التيار الكهربائي
- يشير اتجاه حركة مؤشر الفلوتميتر إلى اتجاه حركة الإلكترونات .
- قراءة الفولتميتر تمثل فرق الجهد الكهربائي المتولد في الخلية .
- في هذه الخلية:
- تكون حركة الإلكترونات من قطب الخارصين Zn، إلى قطب النحاس Cu .
- عند المقارنة بين الخارصين والنحاس، نجد أن الخارصين أكثر نشاطًا من النحاس أي أنه أكثر ميلًا لفقد الإلكترونات أي أنه أكثر ميلًا للتأكسد وهو ما يولد فرق جهد كهربائي بين قطبي الخلية يقوم بدفع الإلكترونات الناتجة من تأكسد ذرات الخارصين Zn إلى الحركة من قطب الخارصين Zn عبر الأسلاك باتجاه قطب النحاس Cu، حيث تكتسبها أيونات النحاس Cu2+ الموجودة في المحلول وتُختزل مكونة ذرات النحاس Cu التي تترسب على صفيحة النحاس .
- في هذه الخلية :
- المصعد هو الذي يحدث عليه نصف تفاعل التأكسد ويمثله هنا قطب الخارصين حيث تأكسدت ذراته كما توضح المعادلة الآتية التي تمثل نصف تفاعل التاكسد :
- المهبط هو الذي يحدث عليه نصف تفاعل الاختزال ويمثله هنا قطب النحاس حيث اختزلت أيوناته كما توضح المعادلة الآتية التي تمثل نصف تفاعل الاختزال :
- التفاعل الكلي الذي يحدث في الخلية الغلفانية : هو مجموع نصفي تفاعل التأكسد والاختزال حيث :
أجمع المواد يسار السهم معًا والمواد يمين السهم معًا، أما الإلكترونات فيجب أن يكون عدد الإلكترونات المفقودة مساويًا لعدد الإلكترونات المكتسبة كما يتضح من المعادلات الآتية :
سؤال (4):
أتوقع التغير الذي يحدث لكتلة قطب الخارصين Zn في الخلية :
الإجابة :
تقل كتلة الخارصين Zn بسبب تأكسد ذراته وتحولها إلى أيونات Zn2+
مثال (5):
خلية غلفانية بسيطة قطباها هما فلز المغنيسيوم Mg وفلز النحاس Cu في محلول كبريتات النحاس CuSO4، أستعين بسلسلة النشاط الكيميائي للإجابة عن الأسئلة الآتية :
1. أرسم الخلية الغلفانية، ثم أحدد المصعد والمهبط واتجاه حركة الإلكترونات فيها على الرسم .
2. أكتب نصفي تفاعل التأكسد والاختزال في الخلية .
3. أكتب معادلة كيميائية تمثل التفاعل الكلي في الخلية.
4. أتوقع التغير في كتلة صفيحة النحاس بعد استخدام الخلية مدةً من الزمن .
الإجابة:
1. أرجع إلى سلسلة النشاط الكيميائي وأحدد موضع كلًّ من المغنيسيوم والنحاس في السلسلة، سأجد أن المغنيسيوم يقع أعلى من النحاس فيها، أي أنه أكثر نشاطًا منه، أي أنه أكثر ميلًا لفقد الإلكترونات أو التأكسد وعليه، فإن المغنيسيوم يمثل المصعد في الخلية الغلفانية ويمثل النحاس المهبط، وتتحرك الإلكترونات من المصعد Mg إلى المهبط Cu، حيث تكتسبها أيونات النحاس Cu2+ وتُختزل .
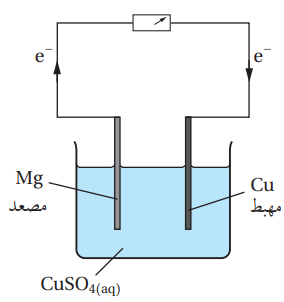
2.
3. أجمع نصفي تفاعل التأكسد والإختزال :
4. أتوقع زيادة كتلة صفيحة النحاس نظرًا إلى ترسب ذرات النحاس Cu عليها .
- يمكن تكوين الخلية الغلفانية باستخدام وعائين أيضًا، كل وعاء يحتوي صفيحة فلزية تمثل القطب، مغموسة في محلول لأحد أملاح الفلز المكون للصفيحة، يتصل القطبان بأسلاك توصيل وبفولتميتر، أما الوعاءان، فيوصلان بقنطرة ملحية .
القنطرة الملحية : هي أنبوب على شكل الحرف U يحتوي محلولًا مُشبعًا لأحد الأملاح KCl، وظيفتها المحافظة على التعادل الكهربائي في الخلية.
مثال (6):
خلية غلفانية بقطباها من الألمنيوم Al في محلول نترات الألمنيوم Al(NO3)3 والفضة (Ag) في محلول نترات الفضة AgNO3، أجيب عن الأسئلة الآتية مستعينًا بالشكل الآتي :
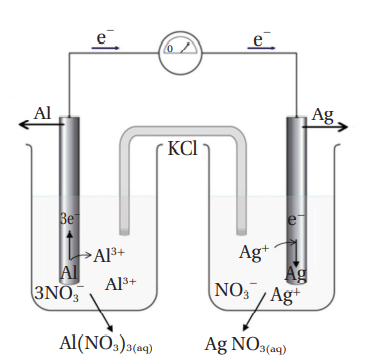
1. أُحدد المصعد والمهبط وشحنة كل منهما.
2. أكتب نصفي تفاعل التأكسد والاختزال .
3. أكتب معادلة التفاعل الكيميائي الكلية في الخلية الغلفانية
4. ما وظيفة القنطرة الملحية في الخلية .
الإجابة :
1. نلاحظ من الشكل حركة الإلكترونات من قطب الألمنيوم Al بإتجاه قطب الفضة Ag، فيكون قطب Al هو المصعد وشحنته (-)، وقطب Ag هو المهبط وشحنته (+) .
2.
3. أجمع نصفي تفاعل التأكسد والإختزال معًا بعد التأكد من أن عدد الإلكترونات المفقودة تساوي عدد الإلكترونات المكتسبة، وإذا كانت غير متساوية، أضرب كل نصف تفاعل في معامل، بحيث تصبح متساوية، وفي هذا التفاعل سيضرب نصف تفاعل الاختزال في الرقم (3) كما يآتي :
4. وظيفة القنطرة الملحية : المحافظة على التعادل الكهربائي في الخلية.
سؤال (5):
خلية غلفانية بسيطة قطباها فلز الحديد Fe وفلز الرصاص Pb في محلول نترات الرصاص Pb(NO3)2، مستعينًا بسلسلة النشاط الكيميائي أجيب عن الأسئلة الآتية :
1. أحدد المصعد والمهبط واتجاه حركة الإلكترونات في الخلية الغلفانية .
2. أكتب نصفي تفاعل التأكسد والإختزال فيها .
3. أُفسر نقصان كتلة صفيحة الحديدFe بعد تشغيل الخلية مدة من الزمن .
الإجابة:
1. بالرجوع إلى سلسلة النشاط، نجد أن الحديد Fe أكثر نشاطًا من الرصاص Pb لذلك فإن :
الحديد Fe يمثل المصعد في الخلية والرصاص Pb يمثل المهبط ، فتتحرك الإلكترونات من المصعد Fe إلى المهبط الرصاص Pb
2. نصف تفاعل التأكسد :
نصف تفاعل الإختزال :
3. بسبب تأكسد ذرات الحديد Fe وتحولها إلى أيونات Fe2+
- التجربة (1) (بناء خلية غلفانية) :
- الهدف من التجربة :
أتعرف إلى طريقة بناء خلية غلفانية
- المواد والأدوات المستخدمة :
- محلول تركيزه (1M) من كبريتات النحاس CuSO4
- صفيحتا خارصين Zn و نحاس Cu
- أسلاك توصيل
- ورق صنفرة
- فولتميتر
- كأس زجاجية سعتها 200 ml
- مِخبار مدرج
- خطوات العمل :
- أقيس: أحضر كأسًا زجاجية، وأقيس بالمخبار المدرج 150 ml من محلول كبريتات النحاس ثم أسكبها بالكأس.
- فرق الجهد الكهربائي في الخلايا الغلفانية المختلفة : ( Electric Potential Difference in different Galvanic Cell)
- إن فرق الجهد الكهربائي يعتمد على موقع في سلسلة النشاط الكيميائي حيث أنه :
- كلما زاد الفرق بين الفلزين في النشاط زاد فرق الجهد الكهربائي الناتج من الخلية الغلفانية المكونة منها .
-
فمثلًا :
+ عند تشكيل خلية غلفانية قطباها من الخارصين Zn والحديد Fe فإنه ينتج فرق جهد كهربائي أقل من فرق الجهد الكهربائي الناتج من خلية غلفانية قطباها من الخارصين Zn والنحاس Cu، وذلك من خلال سلسلة النشاط الكيميائي كما في الشكل الآتي :
أجرب: أنظف صفيحتي النحاس والخرصين جيدًا بورق الصنفرة - ألاحظ: أصل أسلاك التوصيل من طرف بالصفيحة ومن الطرف الأخر بالفولتميتر، بحيث أصل صفيحة النحاس بالطرف الموجب (+)، وصفيحة الخارصين بالسالب ثم أضع صفيحتي النحاس والخارصين في الكأس على أن تكونا متباعدتين، ثم ألاحظ تحرك مؤشر الفولتميتر ثم أدون قراءته
- التحليل والإستنتاج:
1. أحدد : اتجاه حركة مؤشر الفولتميتر .
2. أحدد : المصعد والمهبط في الخلية الغلفانية .
3. أتوقع: التغير في كتلتي صفيحتي الخارصين والنحاس.
4. أكتب التفاعل الكلي في الخلية الغلفانية.
الملاحظات على التجربة :
1) يتحرك مؤشر الفولتميتر نحو قطب النحاس .
2) المصعد هو قطب الخارصين Zn والمهبط هو قطب النحاس Cu .
3) تقل كتلة صفيحة الخارصين وتزداد كتلة صفيحة النحاس.
4) التفاعل الكلي :
- فرق الجهد الكهربائي في الخلايا الغلفانية المختلفة : ( Electric Potential Difference in different Galvanic Cell)
- إن فرق الجهد الكهربائي يعتمد على موقع في سلسلة النشاط الكيميائي حيث أنه :
- كلما زاد الفرق بين الفلزين في النشاط زاد فرق الجهد الكهربائي الناتج من الخلية الغلفانية المكونة منها .
فمثلًا :
+ عند تشكيل خلية غلفانية قطباها من الخارصين Zn والحديد Fe فإنه ينتج فرق جهد كهربائي أقل من فرق الجهد الكهربائي الناتج من خلية غلفانية قطباها من الخارصين Zn والنحاس Cu، وذلك من خلال سلسلة النشاط الكيميائي كما في الشكل الآتي :
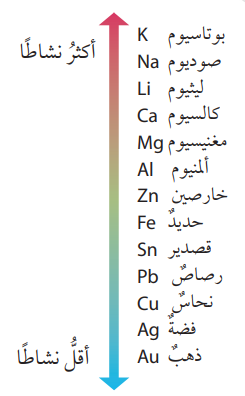
+ نلاحظ أن الخارصين والحديد متتاليان في السلسلة وهذا يعني أن فرقًا قليلًا في النشاط الكيميائي بينهما ، أما الخارصين والنحاس فهما أكثر تباعدًا وهذا يدل على وجود فرقٍ كبير في النشاط الكيميائي بينهما وهو ما يولد فرق جهد كبير في خلية الخارصين – نحاس
(Zn- Cu) مقارنة بفرق الجهد الكهربائي المتولد في خلية الخارصين – حديد (Zn – Fe) .
سؤال (6):
هل يمكن تحديد فلزين يشكلان خلية غلفانية لها أقل فرق جهد كهربائي اعتمادًا على سلسلة النشاط الكيميائي، أفسر إجابتي :
الإجابة :
الفلزان الذين يشكلان خلية غلفانية لها أقل فرق جهد كهربائي يجب أن يكونا متتابعين في سلسلة النشاط الكيميائي، ونظرًا لأن السلسلة لا تتضمن قيم عددية تدل على نشاط كل فلز لذلك لا يمكن تحديد أي فلزين متتابعين يمكن أن يشكلان خلية غلفانية لها أقل فرق جهد .
سؤال (7):
أتوقع التغير في فرق الجهد الكهربائي الناتج إذا استخدم قطب من الألمنيوم بدلًا من قطب الخارصين في خلية (خارصين – حديد)
هل سيزداد أم سيقل أم انه لن يتغير :
الإجابة:
يزداد فرق الجهد الناتج، لأن الألمنيوم أكثر نشاطًا من الخارصين وبالتالي يزداد الفرق في النشاط بين الفلزين المشكلين لخلية (الألمنيوم – حديد ).
- الربط بتاريخ العلم :
أسهمت أعمال العالمين لويجي جالفاني Luigi Galvani وأليساندرو فولتا Alessandro Volta في التوصل إلى بناء أول بطارية،
- لاحظ جالفاني أنه عند وصل قطبين فلزيين مثل الخارصين والنحاس بسلك ووضعهما في عضلة ساق ضفدع، فإن ساق الضفدع تنتفض، وهذا يشير إلى تولد تيار كهربائي .
- توصل فولتا إلى أنه يمكن الحصول على النتيجة نفسها باستخدام عمودٍ من أقراص الخارصين والنحاس بالتناوب مفصولةً بلوحٍ مقوى منقوع في محلول ملحي، وعندما صل سلكًا بطرفي العمود، تدفق تيار كهربائي، فبات هذا الجهاز هو أول بطارية، وقد سميت وحدة فرق الجهد الكهربائي (فولت) تكريمًا للعالم فولتا.
- التجربة (2) (مقارنة فرق الجهد الكهربائي في الخلايا الغلفانية المختلفة) :
- الهدف من التجربة :
أتعرف إلى طريقة اختيار أعلى وأقل قيمة لفرق الجهد الكهربائي الناتج عن تغيير أقطاب خلايا غلفانية مختلفة
- المواد والأدوات المستخدمة :
- محلول تركيزه (1M) من كبريتات النحاس CuSO4
- صفائح من : النحاس، الرصاص ، الألمنيوم، شريط من المغنيسيوم
- أسلاك توصيل
- ورق صنفرة
- فولتميتر
- 3 كؤوس زجاجية سعتها 250 ml
- مِخبار مدرج
- خطوات العمل :
- أحضر 3 كؤوس زجاجية نظيفة وجافة، وأضع على كل منها شريطًا لاصقًا وأرقمها من (1 – 3)، ثم أدون على كل كأس الأقطاب المستخدمة في تشكيل الخلايا الغلفانية (Mg – Cu) ، (Al – Cu) ، (Pb – Cu) على الترتيب.
- أقيس : بالمخبار المدرج 150 ml من محلول كبريتات النحاس ثم أسكبها في الكأس (1)، وأكرر ذلك بالنسبة للكأسين 2 ، 3
- أجرب : أنظف صفائح النحاس والألمنيوم والرصاص وشريط المغنيسيوم جيدًا بورق الصنفرة، وألف شريط المغنيسيوم لفًا حلزونيًا كما في الشكل الأتي :
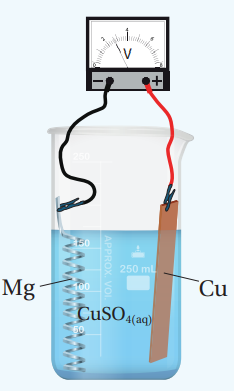
- ألاحظ : أصل أسلاك التوصيل من طرف بالصفيحة ومن الطرف الأخر بالفولتميتر، بحيث أصل صفيحة النحاس بالطرف الموجب (+) وشريط المغنيسيوم بالطرف السالب (-)، ثم أضع صفيحة النحاس وشريط المفنيسيوم في الكأس (1) على أن يكونا متباعدين، ثم ألاحظ تحرك مؤشر الفولتميتر، ثم ادون قراءته.
- أجرب : أكرر الخطوة السابقة باستخدام الأقطاب (ألمنيوم – نحاس)، (رصاص - نحاس ) بإستخدام الكأسين (2)،(3) ( إذا لم تتوافر صفائح عدة من النحاس، تغسل الصفيحة بالماء وتجفف ويعاد استخدامها )
- التحليل والإستنتاج:
1. أتوقع : ترتيب الفلزات وفقًا لنشاطها بناءً على قيم فرق الجهد الكهربائي المقيس للخلايا الغلفانية
2. أقارن : بين الترتيب الذي حصلت عليه وترتيب الفلزات في سلسلة النشاط الكيميائي.
- الملاحظات على التجربة :
|
قطبا الخلية |
فرق الجهد الكهربائي |
اتجاه حركة مؤشر الفولتميتر |
المصعد |
|
مغنيسيوم – نحاس |
أعلى قيمة لفرق الجهد |
من قطب Mg إلى قطب Cu |
Mg |
|
ألمنيوم – نحاس |
أقل من فرق الجهد في الخلية الأولى |
من قطب Al إلى قطب Cu |
Al |
|
رصاص – نحاس |
أقل قيمة لفرق الجهد |
من قطب Pb إلى قطب Cu |
Pb |
1) Mg > Al > Pb > Cu
2) يتفق ذلك مع ترتيب الفلزات في سلسلة النشاط الكيميائي.
- تطبيقات الخلايا الغلفانية (Galvanic Cells Applications) :
- البطاريات (Batteries) :
- تعد البطاريات مثالًا على الخلايا الغلفانية التي يحدث فيها تفاعل التأكسد والاختزال حيث :
-
تتحول الطاقة الكيميائية فيها إلى طاقة كهربائية.
- يوجد أنواع مختلفة من البطاريات منها :
- البطارية الأولية: وهي البطارية التي لا يمكن إعادة شحنها عندما تنفذ مثل: ( البطارية الجافة )
- البطارية الثانوية : وهي البطاريات القابلة لإعادة الشحن، مثل ( بطارية السيارة ).
- البطارية الجافة (Dry Cell) :
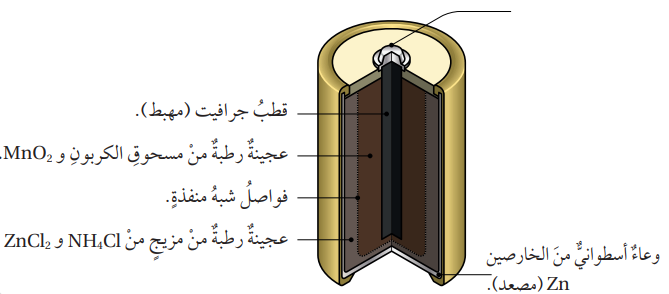
- تعد البطارية الجافة من أقدم أنواع البطاريات وأكثرها استخدامًا، ومن أشهر الأمثلة عليها بطارية (خارصين – غرافيت) التي تتكون من الأجزاء الآتية :
- المهبط : يتكون من قطب من الجرافيت، ويحاط بعجينة رطبة من مزيجٍ من أكسيد المنغنيز MnO2 IV ومسحوق الجرافيت (الكربون)
- المصعد : يتكون من وعاء إسطواني من فلز الخارصين، ويفصله عن العجينة الرطبة غشاء شبه منفذ .
- المحلول الكهرلي : عجينة رطبة من مزيج من مادتي كلوريد الأمونيوم NH4Cl وكلوريد الخارصين ZnCl2، ولها خصائص حمضية.
- تبلغ قيمة فرق الجهد الناتج من هذه الخلية (1.5 V).
- الشكل الآتي يوضح أجزاء البطارية الجافة :
- بطارية السيارة (بطارية الرصاص الحمضية) (Lead – Acid Battery) :
- تعد بطارية الرصاص الحمضية مثالًا على البطاريات الثانوية التي يعاد شحنها، وتحتوي على :
- 6 خلايا غلفانية وتتكون كل خلية من :
+ المصعد الذي يتكون من ألواح الرصاص Pb
+ المهبط يتكون من ألواح الرصاص المغطاة بأكسيد الرصاص PbO2 IV
+ تغمر الألواح في محلول الكبريتيك H2SO4 الذي يمثل المحلول الكهرلي .
+ تنتج بطارية السيارة فرق جهد يساوي 12 V
+ التفاعل الكلي الذي يحدث فيها، هو :
- الشكل الأتي يوضح أجزاء بطارية السيارة:

- الربط بالتكنولجيا :
- رافق التطور الكبير في الأجهزة الإلكترونية تطور بطارياتها ، فظهرت بطارية أيون الليثيوم، التي تمتاز بوزنها الخفيف، وتنتج كميات كبيرة من الطاقة بالنسبة لحجمها، نظرًا إلى النشاط الكبير لفلز الليثيوم ، ويمكن أن تكون أولية أو ثانوية .
- باتت بطارية الليثيوم شائعة الإستخدام في : الهواتف ، الحواسيب المحمولة، والسيارات الكهربائية وغيرها .
- ينصح بعدم التخلص من هذه البطاريات عند تلفها مع النفايات المنزلية لأنه تشكل خطرًا، فضلًا عن احتوائها عناصر مهمة يمكن إعادة تدويرها والإستفادة منها من قبل الجهات المختصة .
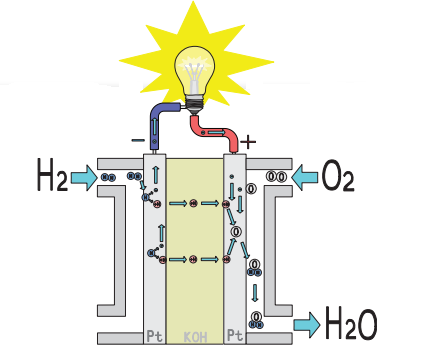
- خلية الوقود (Fuel Cell) :
- تعد خلية الوقود خلية غلفانية، لكنها تختلف عن غيرها بتزويدها بالمواد المتفاعلة أو الوقود باستمرار وهو غالبًا غاز الهيدروجين .
- خلية الوقود تستخدم غازي الهيدروجين والأكسجين وتتكون من :
- قطبين من البلاتين يمثلان المصعد والمهبط
- محلول كهرلي من هيدروكسيد البوتاسيومKOH .
- يضخ غاز الهيدروجين إلى المصعد وغاز الأكسجين إلى المهبط في الخلية.
- تحدث التفاعلات الآتية في خلية الوقود :
- تستخدم خلايا الوقود في المركبات الفضائية للحصول على الطاقة، كما يستفيد رواد الفضاء من الماء الناتج للشرب.
- قي بعض الدول تستخدم في وسائل النقل، مثل السيارت والباصات .
- تستخدم أيضًا كمصدرًا احتياطيًا للطاقة للتشغيل عند الضرورة .
- تتميز خلية الوقود بأنها غير ملوثة للبيئة، وتنتج كمية كبيرة من الطاقة .
- الشكل الآتي يوضح أجزاء خلية الوقود :
سؤال (7):
أكتب معادلة التفاعل الكلية لخلية الوقود :
الإجابة :
سؤال (8):
أقارن بين الخلية الجافة وبطارية السيارة من حيث نوع البطارية وفرق الجهد الكهربائي الناتج منها :
الإجابة:
| إسم البطارية | البطارية الجافة | بطارية السيارة | |
| وجه المقارنة | نوع البطرية | أولية | ثانوية |
| فرق الجهد | V 1.5 | 12 V | |
- الربط بالطب :
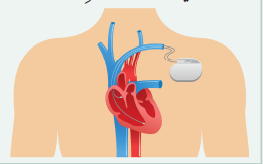
- منظم ضربات القلب :
- هو جهاز صغير الحجم يزرع في الصدر للتحكم في نبضات القلب ويتكون من جزأين وهما :
1. مولد النبضات 2. موصلات ( أقطاب)
- مولد النبضات : يتكون من حافظة معدنية صغيرة تضم بطارية ودارات كهربائية تتحكم في معدل النبضات الكهربائية المرسلة إلى القلب .
- الموصلات (الأقطاب) : يوضع سلك إلى ثلاث أسلاك مرنة ومعزولة في حجرة واحدة أو أكثر من حجرات القلب، وترسل النبضات الكهربائية لضبط معدل نبضات القلب .
- الأجهزة الحديثة لا تتطلب موصلات إنما تزرع مباشرة في عضلة القلب .