مُركبات الكربونيل
الألديهايدات والكيتونات
♯ الألديهايدات Aldehydes
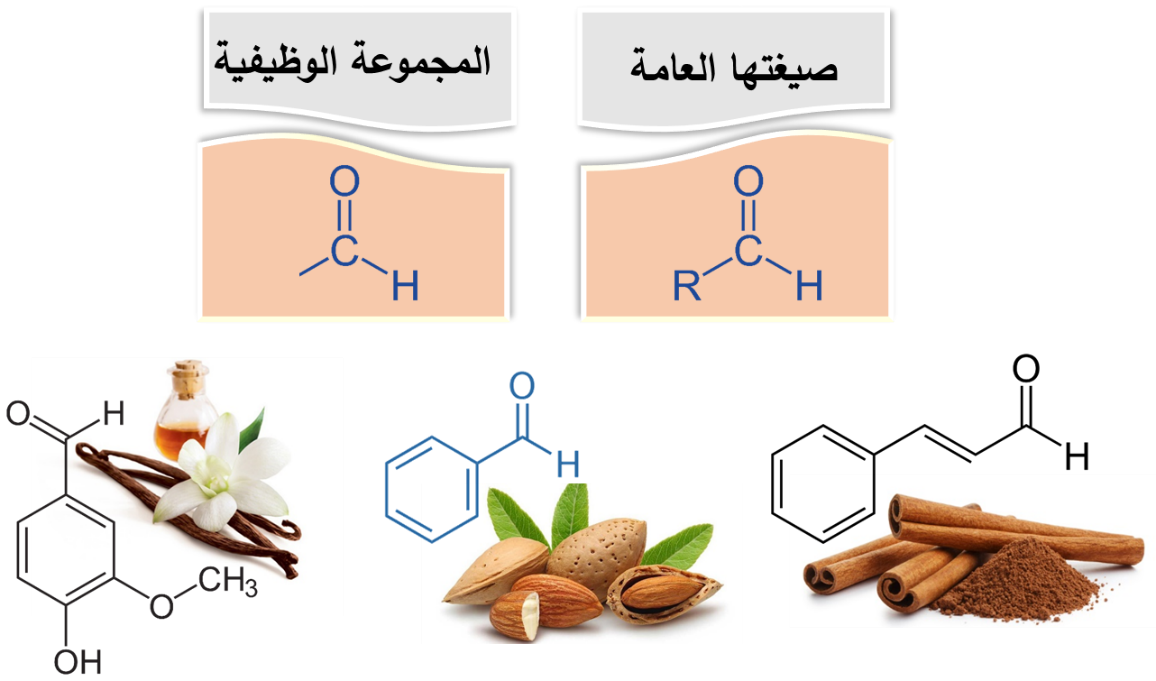
♯ تسمية الألديهايدات:
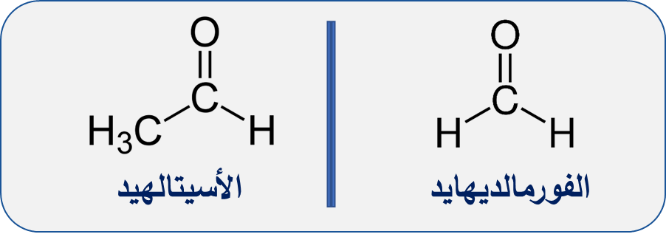
- اشتهرت بعض الألديهايدات بأسماء شائعة ما زالت مستخدمة حتى الآن منها:
- الطريقة المتبعة لتسمية الألديهايدات وفقَ نظام الأيوباك:
إضافة المقطع (ال) إلى اسمِ الألكان المقابل فيصبح (ألكانال)
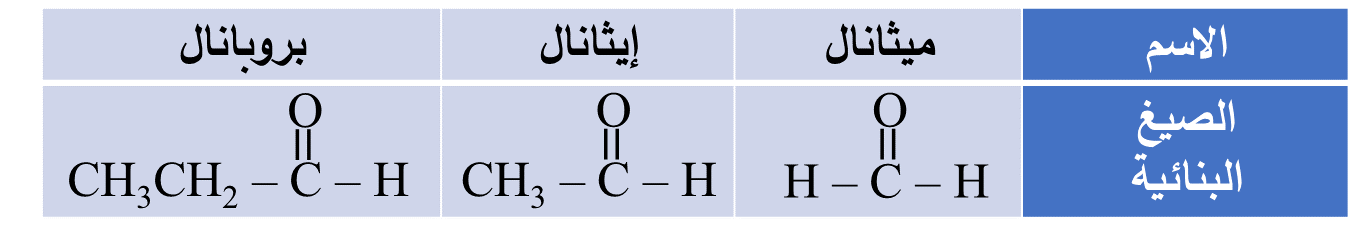
ألاحظُ من الجدول أن ذرة الكربون في مجموعة الكربونيل جزء من سلسلة الكربون، لذلك فإنّ أصغر الألديهايدات مكون من ذرة كربون واحدة مرتبطة بذرتي هيدروجين وهو الميثانال
- تكتب صيغة مجموعة الكربونيل في الالديهايد بصورة مختصرة (CHO-)
وعليه: يمكن كتابة صيغ الألديهايدات السابقة بالصورة الآتية:

مجموعة الكربونيل تأخذ الرقم 1 دائما، لذلك لا يُشار إلى الرقم عند كتابة الاسم
مثال: أُسمّي المُركّبات الآتي وفقَ نظام التسمية العالمي .(IUPAC)
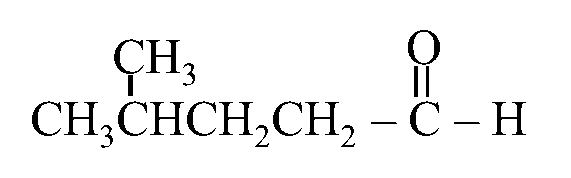
الحل:
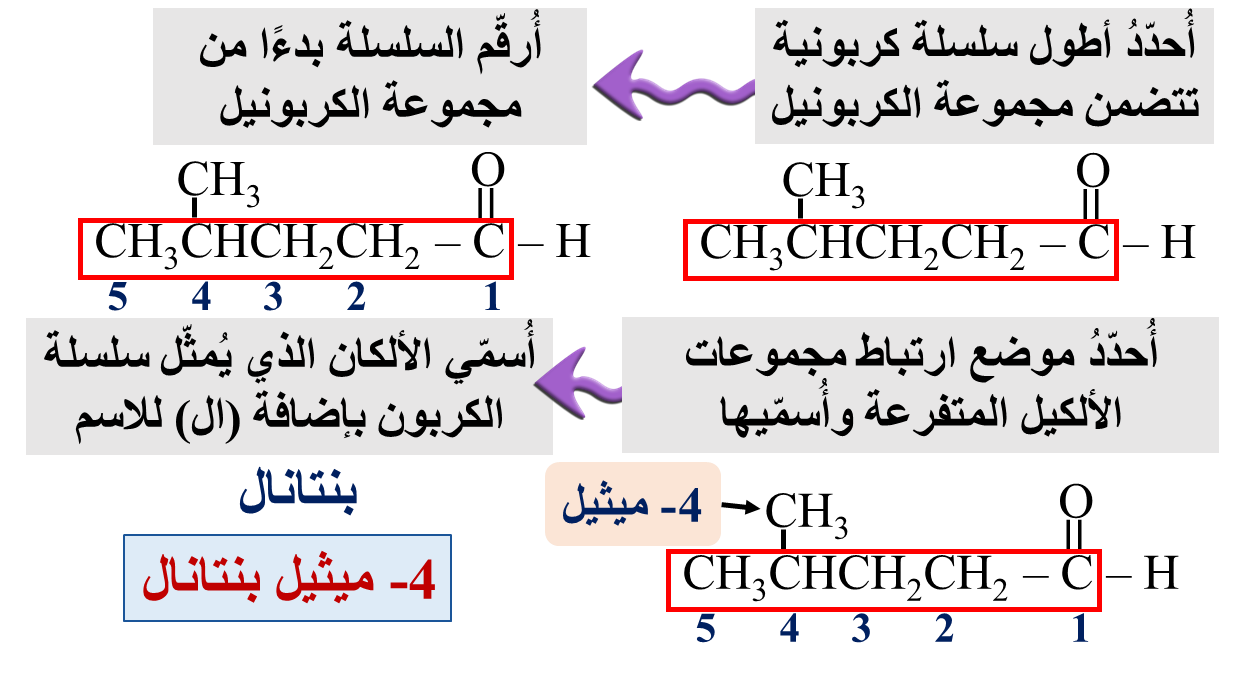
مثال: أكتب الصيغة البنائية للمركب: 3- إيثيل هكسانال
الحل:
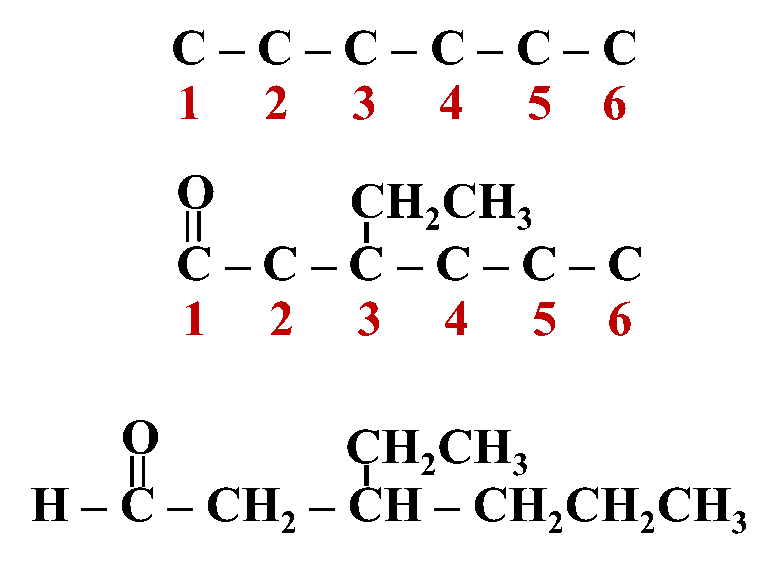
♯ الكيتونات Ketones
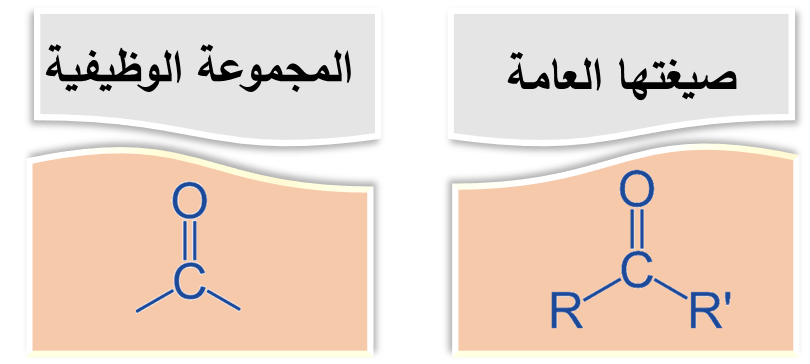
يمكن كتابة صيغة مجموعة الكربونيل بطريقة مختصرة كالآتي: ( -CO- )
ألاحظُ أن مجموعة الكربونيل مُميّزة للالديهايدات والكيتونات، لذلك؛ فإنّها تشترك في الصيغة الجُزيئيّة العامة CnH2nO ولكنها تختلف في الصيغة البنائية.
♯ تسميةُ الكيتونات:
- يتكون أصغر الكيتونات من 3 ذرات كربون، وقد اشتهر باسم الأسيتون وهو نفسه المستخدم لإزالة طلاء الأظافر
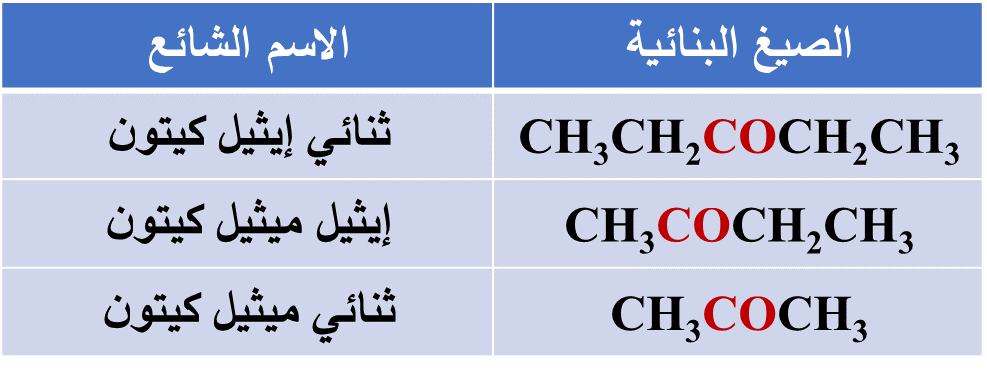
- الطريقة المتبعة لتسمية الكيتونات وفقَ نظام الأيوباك:
إضافة المقطع (ون) إلى اسمِ الألكان المقابل فيصبح (ألكانون)
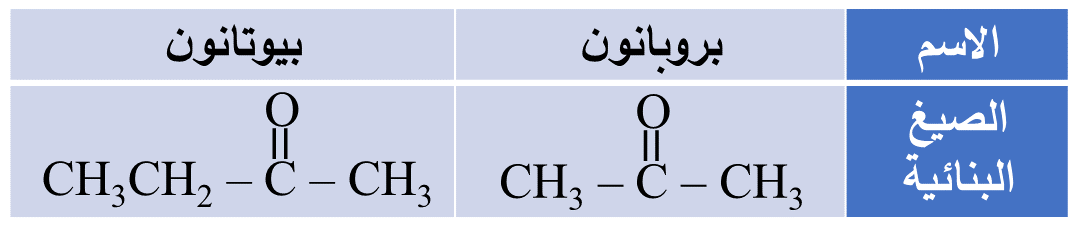
مثال: أُسمّي المُركّبات الآتي وفقَ نظام التسمية العالمي .(IUPAC)
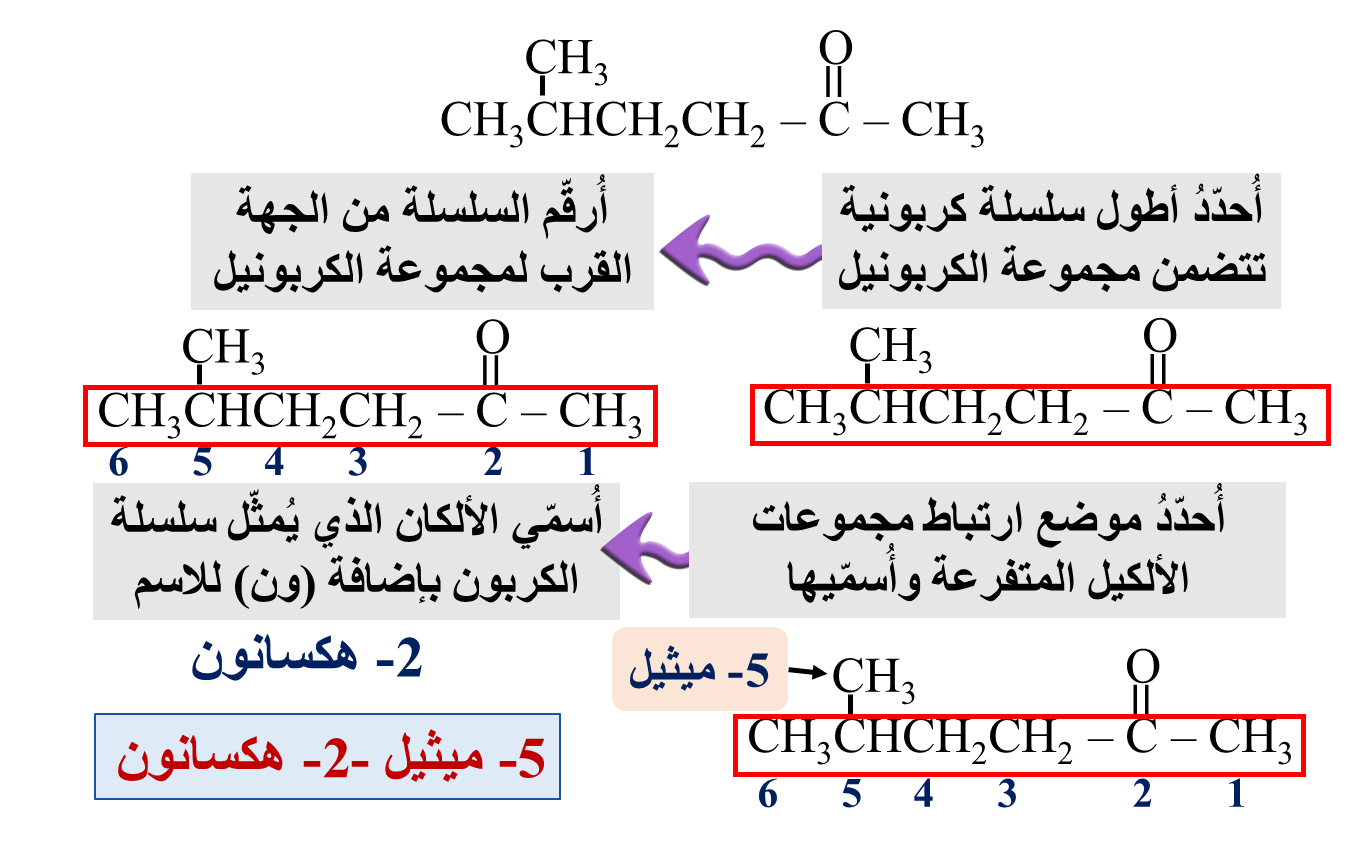
مثال: أكتب الصيغة البنائية للمركب: 4- إيثيل-3- هكسانون
الحل:
الخصائص الفيزيائية للألديهايدات والكيتونات
تعد الألديهايدات والكيتونات مركبات قطبية بسبب احتوائها على مجموعة الكربونيل
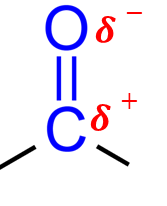
وتترابط جزيئاتها في ما بينها بقوىً ثنائيّةٍ القطب
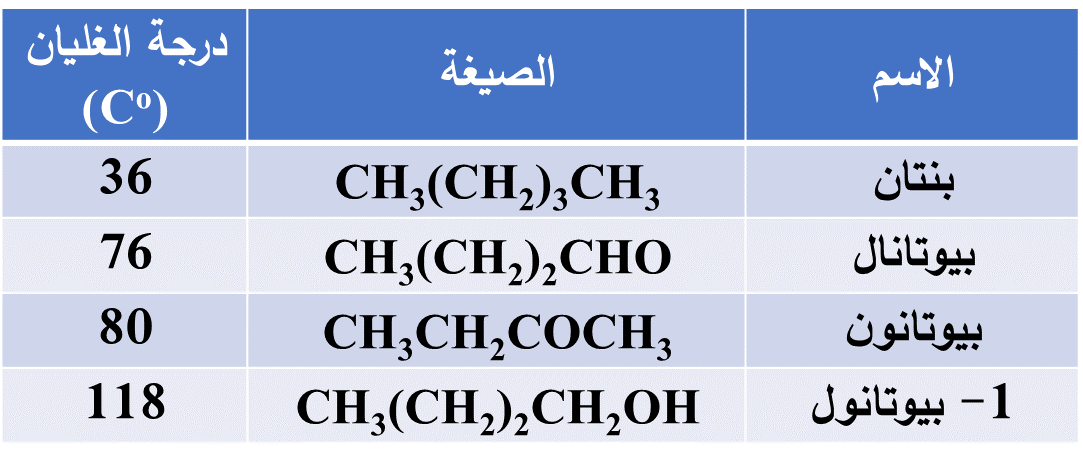
درجة غليان بعض الألديهايدات والكيتونات مقارنة بالألكانات والكحولات المقاربة لها الكتلة المولية
ذائبية الألديهايدات والكيتونات في الماء
تذوبُ الألديهايدات والكيتونات في الماء بسبب الروابط الهيدروجينية التي يُكوّنُها الماء مع جزيئاتها
تقل ذائبيّتُها في الماء بزيادة عدد ذرات الكربون في كلٍّ منها
كما تذوب الألديهايدات والكيتونات في المذيبات العُضوية وتستخدم بصفتها مذيبات عضوية أيضًا
استخدامات الألديهايدات والكيتونات
- ينتج عن تفاعُل الميثانال مع اليوريا نوع من البلاستيك عازل للكهرباء يستخدم في صناعة مقابس الكهرباء.
- يستخدم الميثانال في تحضير نوع من البلاستيك الصلب الذي يستخدم في صناعة أجزاء من السيارة كالمقود والجير.
- يستخدم البروبانون بصفته مذيبًا في صناعة الموادّ اللاصقة.
- استخدم محلول الفورمالديهايد المائي لحفظ عينات بيولوجية.
- يستخدم البروبانون كمادة خام لتصنيع نوع من البلاستيك له استخدامات متنوعة مثل: صناعة أضوية السيارات
الحموض الكربوكسيلية
♯ الحموض الكربوكسيلية Carboxylic Acids
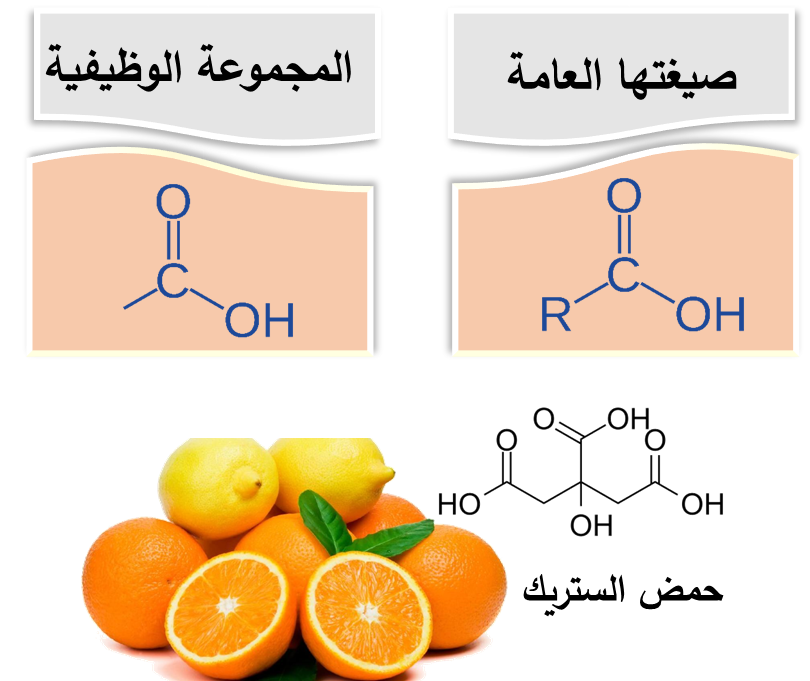
♯ تسمية الحموض الكربوكسيلية:
- الطريقة المتبعة لتسمية الحموض الكربوكسيلية وفقَ نظام الأيوباك:
إضافة المقطع (ويك) إلى اسمِ الألكان المقابل، وكلمة حمض في بداية الاسم فيصبح الاسم العام لها (حمض ألكانويك)
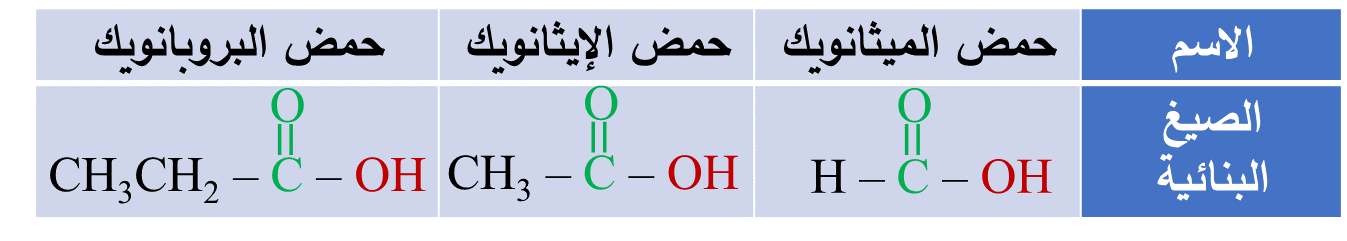
يلاحظُ من الجدول أن أصغر الحموض الكربوكسيلية يتكون من ذرة كربون واحدة فقط هي ذرة كربون مجموعة الكربوكسيل،
ويلاحظُ أيضًا أن مجموعة الكربوكسيل هي مجموعة طرفية،
لذلك؛ يبدأ منها ترقيم السلسلة الكربونية دائمًا في أي حمض كربوكسيلي أي أن رقمها (1)، وبالتالي لا يُشارُ إليه في الاسم.
- تكتب صيغة مجموعة الكربوكسيل بصورة مختصرة (COOH-)
وعليه: يمكن كتابة صيغ الحموض الكربوكسيلية السابقة بالصورة الآتية:

مثال: أُسمّي المُركّبات الآتي وفقَ نظام التسمية العالمي .(IUPAC)
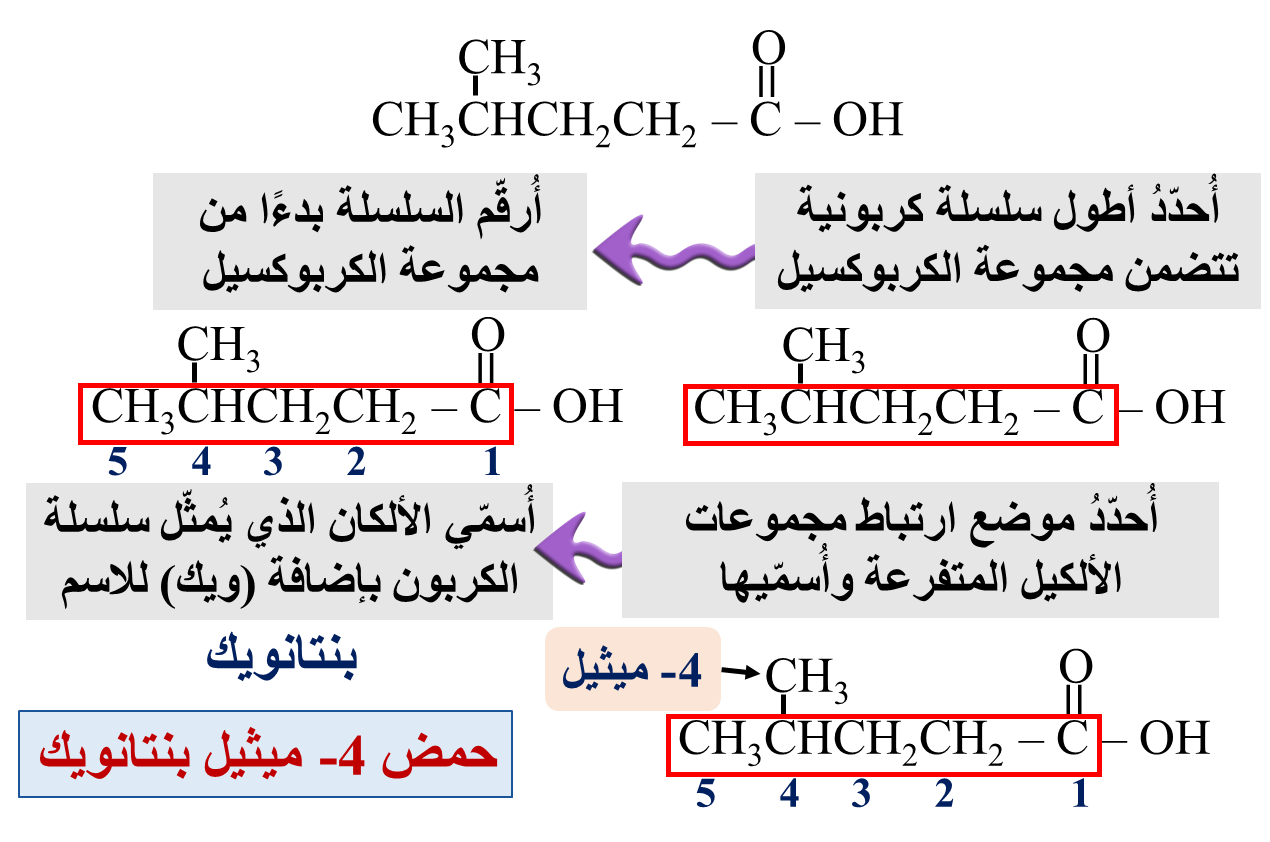
مثال: أكتب الصيغة البنائية للمركب: حمض 3- إيثيل هكسانويك
الحل:
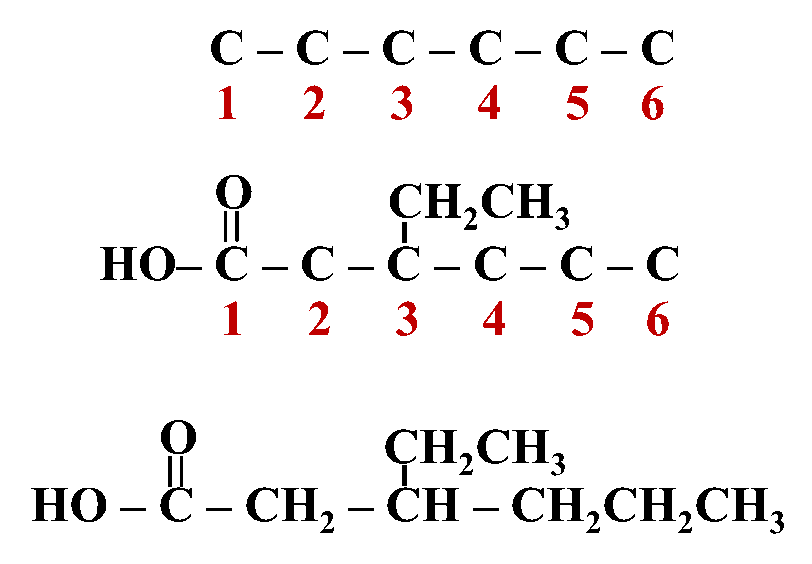
الخصائص الفيزيائية للحموض الكربوكسيلية
تعد الحموض الكربوكسيلية مركبات قطبية
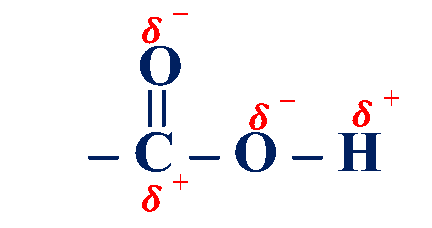
تحتوي مجموعة الكربوكسيل على مجموعة كربونيل قطبية ومجموعة هيدروكسيل قطبية أيضًا
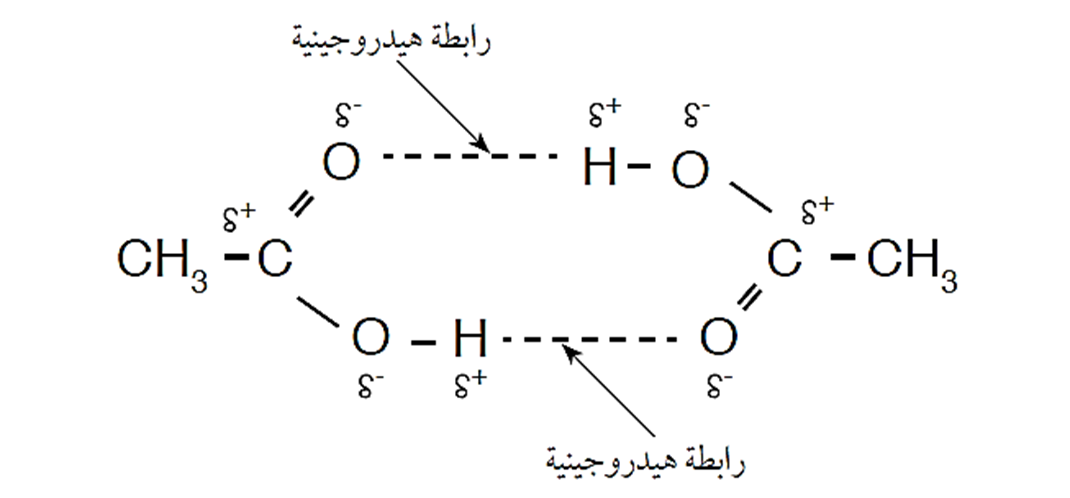
كلّ جزيئين يرتبطان برابطتين هيدروجينيّتين ويُشكّلان ثُنائيًّا(dimer)، تترابط هذه الثنائيات بقوى لندن
درجة غليان بعض الحموض الكربوكسيلية والكحولات

يُلاحظُ ارتفاع درجة غليان حمض البروبانويك مقارنة بكحول 1- بيوتانول مع أن قوى التجاذب بين جزيئات كلّ منهما هي الروابط الهيدروجينية
- السبب في ذلك هو أن عدد الروابط الهيدروجينية التي يكونها الحمض ضعف عددها في الكحول.
ذائبية الحموض الكربوكسيلية في الماء
تذوب الحموض الكربوكسيلية في الماء؛ حيث ترتبط جزيئاتها بروابط هيدروجينية مع جزيئات الماء.
وكلّما زاد عدد ذرات الكربون في مجموعة الألكيل R في الحمض قلّت الذائبية
- تتأيُّن الحموض الكربوكسيلية عند ذوبانها في الماء حسب المعادلة:
RCOOH + H2O ⇋ RCOO- + H3O+
- مثال:
CH3COOH + H2O ⇋ CH3COO- + H3O+
بعض استخدامات الحموض الكربوكسيلية
- تدخل الحموض الكربوكسيلية في صناعة العصائر
- يستخدم حمض الساليسليك في صناعة الأسبرين.
- وتستعمل أملاحُها في مجالات عدّة:
مثل: ملح بنزوات الصوديوم الذي يستعمل كمادة حافظة تُضاف إلى بعض الموادّ الغذائية المُصنّعة.
الإسترات Esters
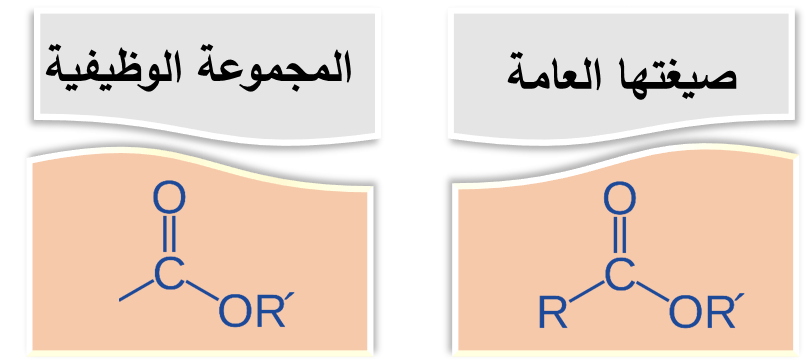
وهي من مُشتقات الحموض الكربوكسيلية
والإسترات هي رائحة الكيمياء الجميلة ونكهتُها، فمعظم روائح الأزهار ونكهات الفواكه وروائحها هي إسترات طبيعية

ويمكن تحضيرُ الإسترات صناعيًّا من تفاعُلِ الحمض الكربوكسيلي مع الكحول
إذ تدخل في صناعة:
العطور والحلويات ومستحضرات التجميل والشموع العطرية وغيرها.
♯ تسمية الإسترات:
- الطريقة المتبعة لتسمية الإسترات وفقَ نظام الأيوباك:
يسمى الإستر حسب نظام الأيوباك اعتمادًا على الحمض الكربوكسيلي والكحول المكونان له حيث يتكون الاسم من كلمتين؛ الأولى مشتقة من اسم الحمض باستبدال المقطع (وات) بدل المقطع (ويك)، والثانية تُمثّل مجموعة الألكيل المأخوذة من الكحول فيكون اسم الإستر العام:
ألكانوات الألكيل
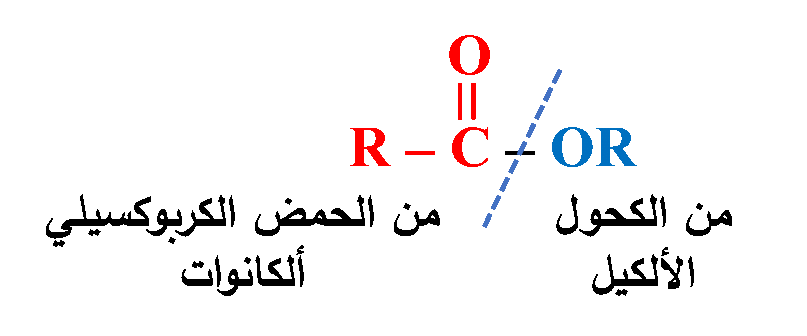
مثال: أُسمّي المُركّبات الآتي وفقَ نظام التسمية العالمي .(IUPAC)
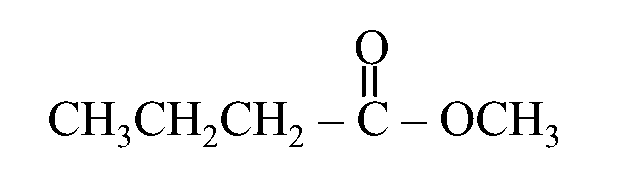
أولًا: أُحدّدُ الشقَّ الذي مصدره الحمض الكربوكسيلي وأسمّيه.
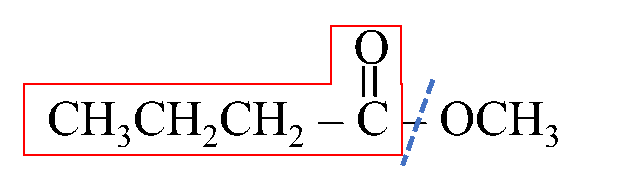
يُلاحظُ أنه مُكوّنٌ من 4 ذرات كربون
أي مشتق من حمض البيوتانويك فأُسمّيه بيوتانوات
ثانيًا: أُحدّدُ الشقَّ الذي مصدره الكحول وأسمّيه
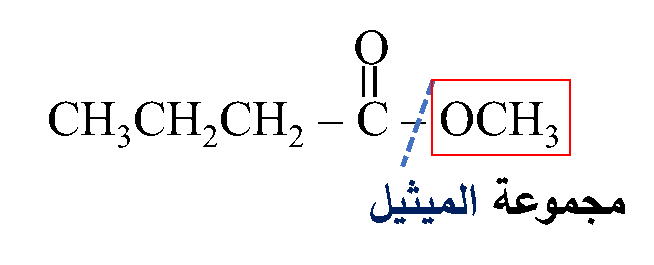
ليصبح الاسم: بيوتانوات الميثيل
مثال: أُسمّي المُركّبات الآتي وفقَ نظام التسمية العالمي .(IUPAC)
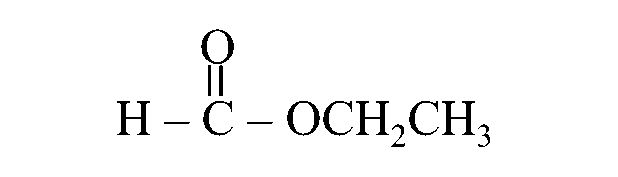
أولًا: أُحدّدُ الشقَّ الذي مصدره الحمض الكربوكسيلي وأسمّيه.
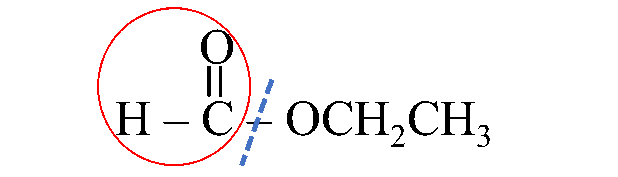
يُلاحظُ أنه مُكوّنٌ من ذرة كربون واحدة
أي مشتق من حمض الميثانويك فأُسمّيه ميثانوات
ثانيًا: أُحدّدُ الشقَّ الذي مصدره الكحول وأسمّيه.
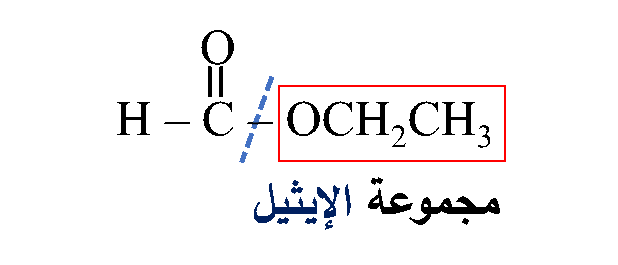
ليصبح الاسم: ميثانوات الإيثيل
الخصائصُ الفيزيائية للإسترات
تعد الإسترات مركبات قطبية
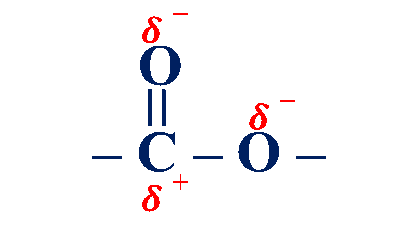
ولكنها لا تمتلك ذرة هيدروجين مرتبطة مباشرة مع ذرة الأكسجين، لذلك فهي غير قادرة على عمل روابط هيدروجينية في ما بينها.
- وهو ما يُفسّر انخفاض درجة غليانها مقارنة مع الحموض الكربوكسيلية المساوية لها في الكتلة المولية، وكذلك انخفاض ذائبيتّها في الماء، فالإسترات التي يزيد عدد ذرات الكربون فيها عن (5) لا تذوب في الماء.
بعض استخدامات الإسترات
- تُعدُّ الإسترات مذيبات جيدة للمُركّبات العضوية، منها ما يستخدم لإذابة الدهانات.
- وتدخل الإسترات أيضا في صناعة الموادّ اللاصقة وتستخدم في تصنيع أكياس النايلون والبلاستيك المستخدم للتغليف.

إجابات التجربة (1) كتاب الأنشطة - اختبار ذوبان بعض المركبات العضوية في الماء
التحليل والاستنتاج:
1. أصنّف المركبات العضوية حسب ذوبانها في الماء.
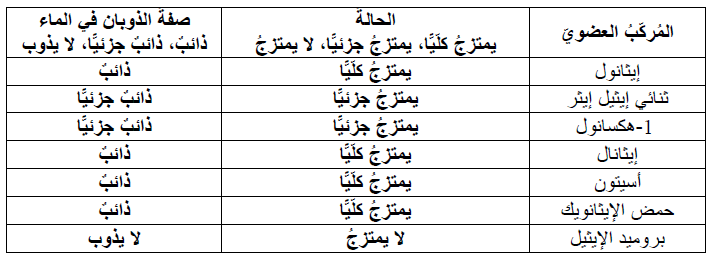
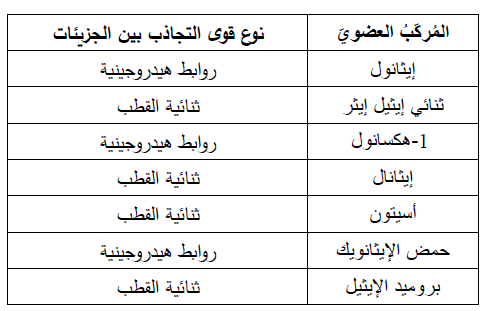
2. أميز نوع قوى التجاذب بين جزيئات كل مركب.
3. أستنتج العلاقة بين نوع قوى التجاذب بين جزيئات السائل وذوبانه في الماء.
المركبات التي تترابط جزيئاتها بروابط هيدروجينية تكون مع الماء روابط هيدروجينية أيضا لذلك تذوب فيه، وتقل ذائبيتها بزيادة عدد ذرات الكربون، حيث يزداد طول السلسلة R وهي جزء غير قطبي لا يذوب في الماء فتقل الذائبية. المركبات التي تترابط بقوى ثنائية القطب وتحتوي المجموعة الوظيفية فيها على ذرة أكسجين يكون الماء روابط هيدروجينية معها لذلك تذوب فيه، وتقل ذائبيتها بزيادة عدد ذرات الكربون. المركبات التي تترابط جزيئاتها بقوى ثنائية القطب ولا تحتوي مجموعتها الوظيفية على ذرة أكسجين أو نيتروجين، لا تكون روابط هيدروجينية مع الماء ولا تذوب فيه بشكل عام.
4 . أستنتج العلاقة بين عدد ذرات الكربون في المركب وذوبانه في الماء.
كلما زاد عدد ذرات الكربون في المركب قلت ذائبيه في الماء.
5. أفسر: يذوب الإيثانول تماما في الماء، في حين لا يذوب 1- هكسانول تماما فيه.
كلا المركبين يحتوي مجموعة هيدروكسيل تترابط مع الماء بروابط هيدروجينية، في الايثانول لأن عدد ذرات الكربون 2 فقط فإن مجموعة الهيدروكسيل تذوب وتذيب المركب في الماء، أما في 1 -هكسانول فإن عدد ذرات الكربون 6 أي أن طول السلسلة الكربونية غير القطبية R التي لا تذوب في الماء كبير مما يقلل من ذائبية المركب في الماء.