- المفاهيم والمصطلحات :
** عزيزي الطالب ستتعرف في هذا الدرس على هذه المفاهيم والمصطلحات العلمية :
|
تركيب لويس |
Lewis Structure |
|
الروابط الكيميائية |
Chemical Bond |
|
الرابطة الأيونية |
Ionic Bond |
|
الرابطة التساهمية |
Covalent Bond |
|
الرابطة الفلزية |
Metallic Bond |
|
بحر الإلكترونات |
Sea of Electrons |
- تركيب لويس (Lewis Structure) :
- إقترح العالم جيلبيرت لويس عام 1902 طريقة لتمثيل أشكال الجزيئات أطلق عليها تركيب لويس
- تعريف تركيب لويس : هي تمثيل نقطي لإلكترونات التكافؤ التي تشارك في تكوين الروابط الكيميائية؛ إذ يرمز لكل إلكترون تكافؤ بنقطة واحدة توضع على العنصر.
- ترتبط الذرات بعضها ببعض من خلال :
" فقد الإلكترونات أو إكتسابها أو المشاركة فيها "
حتى يصبح توزيعها الإلكتروني مكتمل ومشابه للتوزيع الإلكتروني للغاز النبيل.
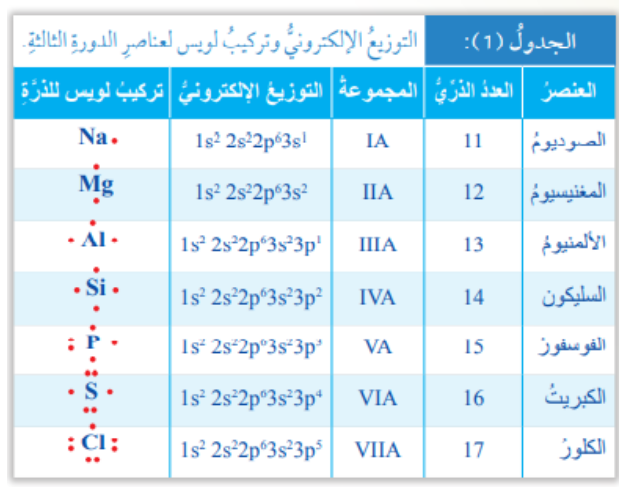
- الجدول الآتي (الجدول (1)) : يبين التوزيع الإلكتروني وتركيب لويس لعناصر الدورة الثالثة من الجدول الدوري :
سؤال (1) :
أكتب توزيع لويس لكل من ذرات العناصر في الجدول الآتي :

الإجابة :
|
العنصر |
Be |
N |
B |
F |
Li |
|
عدد نقاط لويس |
2 |
5 |
3 |
7 |
1 |
- الروابط الكيميائية (Chemical Bond)
- يتكون العالم حولنا من ذرات مثل :
( الماء و الهواء الذي يحيط بنا وأجسامنا حيث تتكون من ذرات متناهية في الصغر )
- لا توجد هذه الذرات بشكل منفرد غالبًا لكن ترتبط مع بعضها بقوى تجاذب مختلفة تسمى بــالروابط الكيميائية
- تعريف الروابط الكيميائية : هي قوى تجاذب تنشأ بين ذرتين أو أكثر عن طريق فقد الذرة للإلكترونات أو إكتسابها أو المشاركة بها مع ذرة أخرى.
- من ألأمثلة على الروابط الكيميائية :
أ) الروابط الأيونية ب) الروابط التساهمية
- الرابطة الأيونية (Ionic Bond):
- تفقد ذرات بعض العناصر الإلكترونات وتكون أيونات موجبة
- تكتسب ذرات بعض العناصر الإلكترونات وتكون أيونات سالبة
- تعريف الرابطة الأيونية : هي القوة التي تجذب الأيونات ذات الشحنات المختلفة في المركبات وهي رابطة تنشأ بين ذرات فلز ولا فلز .
مثال (1) :
الرابطة الأيونية في مركب كلوريد الصوديوم NaCl حيث يحدث :
" تجاذب بين أيون الصوديوم الموجب وأيون الكلوريد السالب "
* يمكن تمثيل عملية الترابط بينهما عن طريق تركيب لويس كما يآتي :
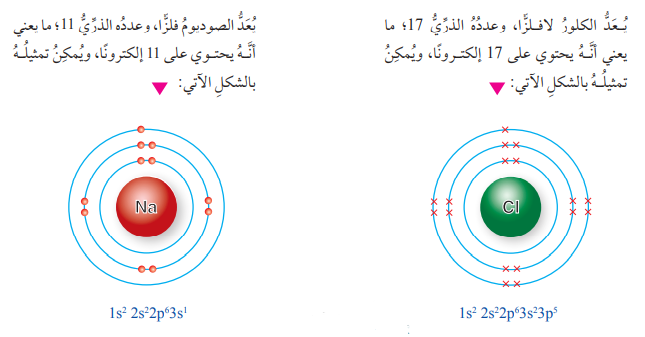
- ينشأ أيون أحادي موجب (Na+) لأن عدد البروتونات الموجبة أكثر من عدد الإلكترونات السالبة، وينشأ أيون أحادي سالب (Cl-) لأن عدد البروتونات الموجبة أقل من عدد الإلكترونات السالبة كما في الشكل الآتي :
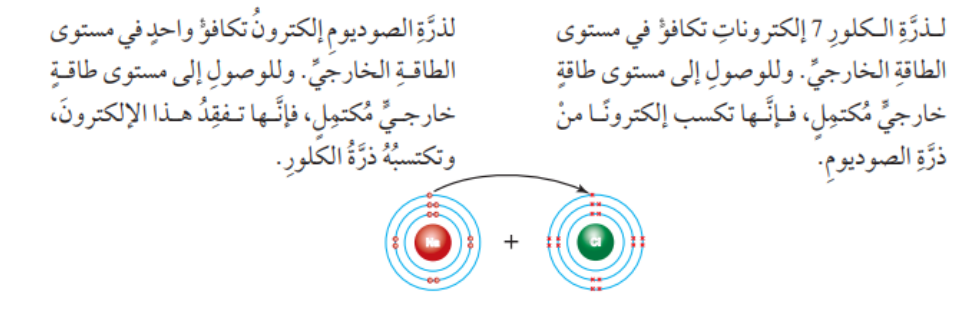
- الشكل الآتي يبين الترابط بين ذرتي الصوديوم والكلور :
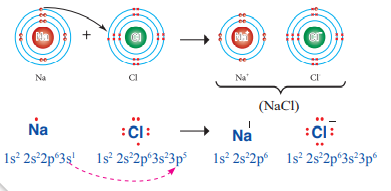
مثال (2) :
الرابطة الأيونية في مركب أكسيد المغنيسيوم MgO إذ؛ ينتقل إلكتروني التكافؤ من مستوى الطاقة الخارجي لذرة المغنيسيوم التي يكون توزيعها الإلكتروني 1s22s22p63s2 )) إلى ذرة الأكسجين التي يكون توزيعها الإلكتروني ((1s22s22p4 فيتكون أيون مغنيسيوم ثنائي موجب Mg2+ وأيون أكسيد ثنائي سالب O2- كما في الشكل الآتي :
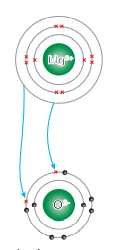
سؤال (2) :
ما المقصود بالرابطة الأيونية :
الإجابة :
"هي القوة التي تجذب الأيونات ذات الشحنات المختلفة في المركبات وهي رابطة تنشأ بين ذرات فلز ولا فلز ."
سؤال (3) :
أفسر : أثر طاقة تأين ذرة Na وذرة Cl في تكوين الأيون الموجب والأيون السالب :
الإجابة:
Na: [Ne] 3s1 11
طاقة تأين ذرة Na منخفضة، لذا يسهل أن تفقد إلكترونًا واحدًا، فينتج الأيون الموجب Na+
Cl: [Ne] 3s23p5 17
طاقة تأين ذرة Cl مرتفعة، لذا لا تميل إلى فقد الإلكترونات بل تميل لإكتسابها ولذلك فهي تكتسب إلكترونًا واحدة فينتج الأيون السالب Cl –
سؤال (4) : أُفكر:
يرتبط الألمنيوم (Al) بالكبريت (S)؛ لتكوين مركب (Al2S3)، فكيف يحدث ذلك :
الإجابة :
Al: [Ne] 3s23p1 13 : [Ne] 3s23p4S16
ذرة Al تفقد ثلاثة إلكترونات من المستوى الخارجي فينتج Al3+ ، ذرة S تكتسب إلكترونين من المستوى الخارجي فينتج S2- بما أن عدد الإلكترونات المفقودة يساوي عدد الإلكترونات المكتسبة فإنه يلزم وجود ثلاث أيونات S2- لتكتسب ستة إلكترونات من أيونين Al3+، لذا يرتتبط أيونان من Al3+ بثلاث أيونات S2-
- الرابطة التساهمية (Covalent Bond):
- تميل ذرات العناصر اللافلزية إلى المشاركة بإلكترونات التكافؤ أو إكتسابها للوصول إلى توزيع إلكتروني يشبه التوزيع الإلكتروني للغاز النبيل .
- تعريف الرابطة التساهمية : هي الرابطة الكيميائية الناتجة من تشارك زوج أو أكثر من الإلكترونات بين ذرتين أو أكثر من العناصر اللافلزية .
- تسمى المركبات الناتجة من الرابطة التساهمية بــ( المركبات التساهمية الجزيئية)
- أنواع الروابط النساهمية :
أ) الرابطة التساهمية الأحادية
ب) الرابطة التساهمية الثنائية
جـ) الرابطة التساهمية الثلاثية
أ) الرابطة التساهمية الأحادية :
تعريفها : هي رابطة تنشأ عن تشارك ذرتين بزوج واحد من الإلكترونات .
مثل: جزيء الهيدروجين (H2) ، جزيء الماء (H2O)، جزيء الميثان (CH4)، .......
مثال (3) :
جزيء الهيدروجين (H2) يحتوي على رابطة تساهمية أحادية حيث:
- ترتبط ذرة هيدروجين (توزيعها الإلكتروني 1s1) بذرة هيدروجين أخرى بمشاركة كلٍ منها بإلكترون تكافؤ واحد، لأن كل منها تحتاج إلى الإلكترون ليكتمل مستوى الطاقة الخارجي لها؛ لذلك : ينجذب زوج إلكترونات الرابطة إلى نواتي الذرتين .
- يمكن تمثيل الرابطة التساهمية بين ذرتي الهيدروجين كما في الشكل الآتي :
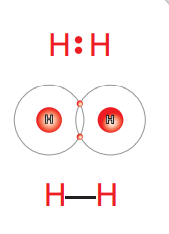
مثال (4) :
يعد جزيء الماء (H2O) مثالًا على الرابطة التساهمية؛ حيث:
- تمتلك ذرة الأكسجين ستة إلكترونات نكافؤ، لذا تحتاج إلى إلكترونين حتى يكتمل مستوى الطاقة الخارجي لها فترتبط برابطة تساهمية أحادية (سيجما) مع كل ذرة من ذرتي الهيدروجين.
- الشكل الآتي يبين الرابطة التساهمية (سيجما) بين ذرة الأكسجين وذرتي الهيدروجين :
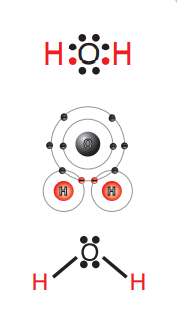
مثال (5) :
يعد جزيء الميثان (CH4) مثالًا أيضًا على الرابطة التساهمية حيث :
- في جزيء الميثان (CH4) فإن ذرة الكربون (C) تمتلك أربعة إلكترونات تكافؤ تتشارك فيها مع أربعة ذرات هيدروجين فتنشأ أربعة روابط تساهمية أحادية (سيجما).
- الشكل الآتي يمثل الرابطة التساهمية في جزيء الميثان (CH4)
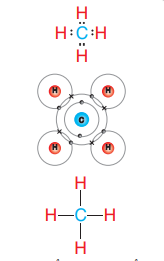
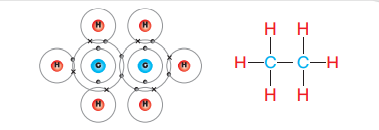
- قد يكون الجزيء الذي يحتوي على روابط تساهمية أكثر تعقيدًا كما هو الحال في جزيء الإيثان (C2H6)
- الشكل الأتي يبين الروابط التساهمية في جزيء الإيثان (C2H6) :
ب) الرابطة التساهمية الثنائية:
تعريفها : هي رابطة تنشأ عن تشارك ذرتين بزوجين من الإلكترونات .
مثل : جزيء ثاني أكسيد الكربون (CO2)، جزيء الإيثين (C2H4)
مثال (6) :
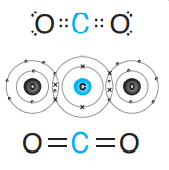
جزيء ثاني أكسيد الكربون(CO2) يعد مثالًا على الرابطة التساهمية الثنائية حيث :
- تحتاج ذرة الكربون (C) إلى أربعة إلكترونات حتى يكتمل مستوى طاقتها الخارجي؛ في حين تحتاج ذرة الأكسجين (O) إلى إلكترونين، وبذلك تتشارك ذرة الكربون مع ذرتي أكسجين فتنشأ رابطة تساهمية ثنائية ( إحداهما سيجما σ، والأخرى باي π( بين ذرة الكربون وكل من ذرتي الأكسجين.
- الشكل الآتي يبين الرابطة التساهمية الثنائية في جزيء ثاني أكسيد الكربون (CO2)
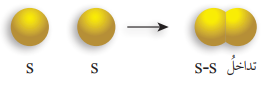
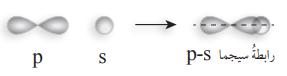
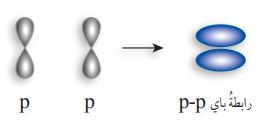
- الرابطة سيجما σ والرابطة باي π :
- الرابطة سيجما σ : تنشأ هذه الرابطة من التداخل الرأسي بين فلكي (S – S)، أو فلكي (P – P)، أو فلكي ( S – P) : كما في الشكل الآتي :

- الرابطة باي π: تنشأ هذه الرابطة من التداخل الجانبي بين فلكي (P – P ) ؛ إذ تمثل منطقة تداخل الفلكين أكبر إحتمال لوجود زوج الإلكترونات فيها، كما يظهر في الشكل الآتي :
مثال (7) :
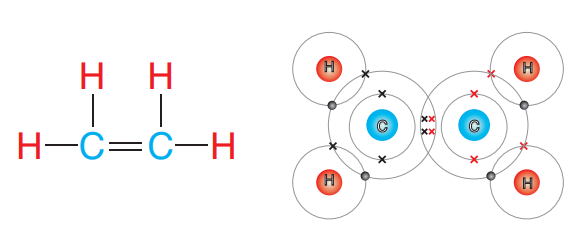
جزيء الإيثين يعد مثالًا على الرابطة التساهمية الثنائية :
حيث ترتبط ذرتا كربون بزوجين من إلكترونات فيما بينها، كما في الشكل الآتي :
جـ) الرابطة التساهمية الثنائية:
تعريفها : هي رابطة تنشأ عن تشارك ذرتين بثلاث أزواج من الإلكترونات .
مثل : جزيء النيتروجين (N2)
مثال (8) :
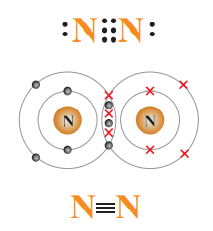
جزيء النيتروجين يعد مثالًا على الرابطة التساهمية الثلاثية:
إذ تحتوي ذرة النيتروجين على خمسة إلكترونات تكافؤ وتكون بذلك بحاجة إلى ثلاثةِ إلكترونات حتى يكتمل مستوى طاقتها الخارجي، فتتشارك الذرتان في ثلاثةِ إلكترونات من كلٍ منهما؛ لتنشأ رابطة تساهمية ثلاثية تحتوي على ( رابطة سيجما σ، و رابطتا باي π)
- الشكل الآتي يبين الرابطة التساهمية الثلاثية في جزيء النيتروجين (N2):
سؤال (5):
أذكر عدد أزواج الإلكترونات غير الرابطة على ذرة N الواحدة :
الإجابة :
كل ذرة نيتروجين (N) تمتلك زوج واحد من الإلكترونات غير الرابطة
سؤال (6): أفكر :
أُوضح كيف تتكون الروابط في جزيء HCN:
الإجابة :
ذرة الهيدروجين (H) لديها إلكترون تكافؤ واحد وذرة الكربون (C) لديها أربعة إلكترونات تكافؤ، وذرة النيتروجين (N) لديها ثلاثة إلكترونات تكافؤ؛ لذا تشارك ذرة الهيدروجين (H) بإلكترونها مع إلكترون من ذرة الكربون (C)، أي تتشارك الذرتان بزوج من الإلكترونات، ويبقى لدى ذرة الكربون (C) ثلاثة إلكترونات تتشارك بها مع ثلاثة إلكترونات من ذرة النيتروجين (N)، وبذلك تتشارك ذرتا الكربون (C) والنيتروجين (N) بثلاثة أزواج من الإلكترونات ويمكن تمثيل روابط الجزيء على النحو الآتي :
سؤال (7):
ما المقصود بكل من الروابط التساهمية الأحادية ، الروابط التساهمية الثنائية، والروابط التساهمية الثلاثية :
الإجابة :
الرابطة التساهمية الأحادية : هي رابطة تنشأ عن تشارك ذرتين بزوج واحد من الإلكترونات.
الرابطة التساهمية الثنائية : هي رابطة تنشأ عن تشارك ذرتين بزوجين من الإلكترونات.
الرابطة التساهمية الثلاثية : هي رابطة تنشأ عن تشارك ذرتين بثلاثةِ أزواج من الإلكترونات.
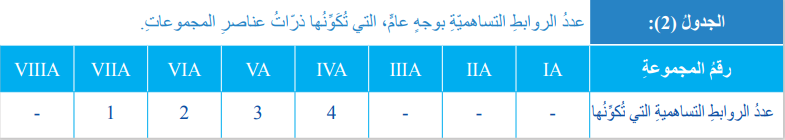
- بوجه عام يمكن تلخيص عدد الروابط التساهمية التي تكونها ذرات العناصر في كل مجموعة من الجدول الدوري كما في الجدول (2) الآتي :
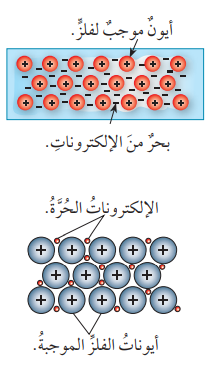
- الرابطة الفلزية (Metallic Bond):
- ترتبط ذرات عنصر الفلز الواحد ببعضها برابطة تسمى بـ الرابطة الفلزية
- تعريف الرابطة الفلزية : هي قوة التجاذب بين الأيونات الموجبة للفلزات والإلكترونات حرة الحركة في الشبكة البلورية
- تنشأ الرابطة الفلزية نتيجة فقد ذرات الفلز لإلكترونات التكافؤ، فتتحول هذه الذرات إلى أيونات موجبة تحيط بها الإلكترونات من جميع النواحي على شكل بحر من الإلكترونات .
الشكل الآتي يبين نموذج الرابطة الفلزية :
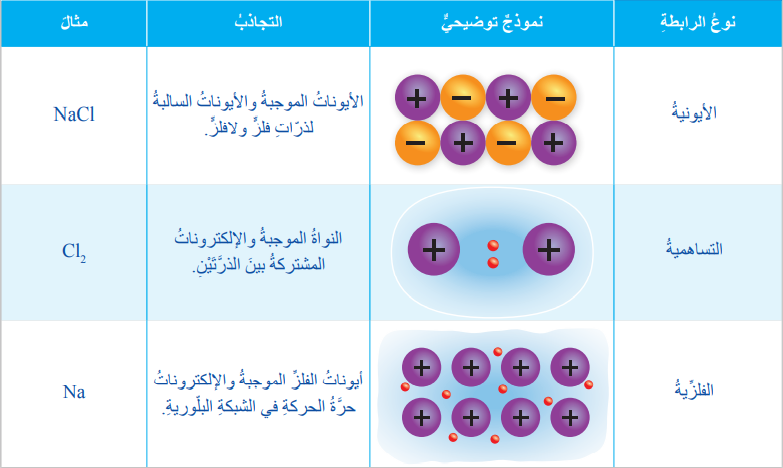
- الجدول الآتي يبين المقارنة بين الرابطة الأيونية والرابطة التساهمية والرابطة الفلزية من حيث التجاذب الحاصل في كلٍ منها :
سؤال (8):
ما المقصود بالرابطة الفلزية :
الإجابة :
الرابطة الفلزية : هي قوة التجاذب بين الأيونات الموجبة للفلزات والإلكترونات حرة الحركة في الشبكة البلورية