الروابط الكيميائية (Chemical Bond)
تعريف الروابط الكيميائية : هي قوى تجاذب تنشأ بين ذرتين أو أكثر عن طريق فقد الذرة للإلكترونات أو إكتسابها أو المشاركة بها مع ذرة أخرى.
- أمثلة الروابط الكيميائية :
أ) الروابط الأيونية ب) الروابط التساهمية ج) الرابطة الفلزية
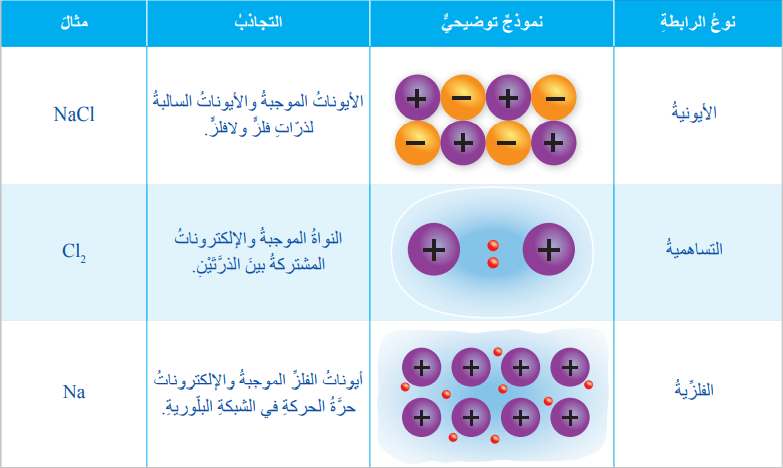
تعريف الرابطة الأيونية : هي القوة التي تجذب الأيونات ذات الشحنات المختلفة في المركبات وهي رابطة تنشأ بين ذرات فلز ولا فلز .
تعريف الرابطة التساهمية : هي الرابطة الكيميائية الناتجة من تشارك زوج أو أكثر من الإلكترونات بين ذرتين أو أكثر من العناصر اللافلزية .
تعريف الرابطة الفلزية : هي قوة التجاذب بين الأيونات الموجبة للفلزات والإلكترونات حرة الحركة في الشبكة البلورية
- تسمى المركبات الناتجة من الرابطة التساهمية بــ( المركبات التساهمية الجزيئية)
- أنواع الروابط النساهمية :
أ) الرابطة التساهمية الأحادية
ب) الرابطة التساهمية الثنائية
جـ) الرابطة التساهمية الثلاثية
تعريف الرابطة التساهمية الأحادية : هي رابطة تنشأ عن تشارك ذرتين بزوج واحد من الإلكترونات مثل: جزيء الهيدروجين (H2)
تعريف الرابطة التساهمية الثنائية : هي رابطة تنشأ عن تشارك ذرتين بزوجين من الإلكترونات . مثل : جزيء ثاني أكسيد الكربون (CO2)،
تعريف الرابطة التساهمية الثلاثية: هي رابطة تنشأ عن تشارك ذرتين بثلاث أزواج من الإلكترونات . مثل : جزيء النيتروجين (N2)
- الرابطة سيجما σ والرابطة باي π :
- الرابطة سيجما σ : تنشأ هذه الرابطة من التداخل الرأسي بين فلكي (S – S)، أو فلكي (P – P)، أو فلكي ( S – P) :
- الرابطة باي π: تنشأ هذه الرابطة من التداخل الجانبي بين فلكي (P – P ) ؛ إذ تمثل منطقة تداخل الفلكين أكبر إحتمال لوجود زوج الإلكترونات فيها
- الجدول الآتي يبين المقارنة بين الرابطة الأيونية والرابطة التساهمية والرابطة الفلزية من حيث التجاذب الحاصل في كلٍ منها :