- المفاهيم والمصطلحات :
عزيزي الطالب ستتعرف في هذا الدرس على هذه المفاهيم والمصطلحات العلمية :
|
الطيفُ الكهرومغناطيسي |
Electromagnatic Spectrum |
|
الطيفُ المتصل |
Continuous Spectrum |
|
الطيفُ المرئي |
Visible Spectrum |
|
الطيفُ غير المرئي |
Invisible Spectrum |
|
طولُ الموجةِ |
Wavelength |
|
التردد |
Frequency |
|
الذرةُ المثارة |
Exited Atom |
|
الكم |
Quantum |
|
الفوتون |
Photon |
|
الطيف الخطي |
Line Spectrum |
|
طيفُ الإنبعاث الخطي |
Line Emission Spectrum |
|
الطيفُ الذري |
Atomic Spectrum |
|
مستوى الطاقةِ |
Energy Level |
الدرس الأول : نظرية بور لذرة الهيدروجين (The Bohr Theory of the Hydrogen Atom) :
- الضوء مصدر معلومات عن الذرة :
- يعد الضوء المصدر الرئيس للمعلومات التي استندت اليها النظريات الحديثة في تفسير بنية الذرة وتركيبها
- لاحظ العلماء في اواخر القرن التاسع عشر انبعاث الضوء من بعض العناصر عند تسخينها وهذا الذي دفعهم إلى دراسة الضوء وتحليله، وقد توصلوا إلى : ارتباط سلوك العنصر بالتوزيع الإلكتروني .
- استند نيلز بور إلى نتائج هذه الدراسات في بناء نموذجه الكمي لذرة الهيدروجين
- الطيف الكهرومغناطيسي :
- تعريفه : هو جميع الأطوال الموجية والترددات التي يتكون منها الضوء
- ينتشر الضوء في الفراغ بسرعة ثابتة على شكل أمواج يمكن وصفها عن طريق أطوالها الموجية وترددها حيث تتقاوت هذه الأطوال الموجية تفاوتًا كبيرًا؛ حيث :
أ) بعضها يتناهى بالصغر مثل أشعة غاما، ويقاس بالأجزاء من المتر (النانومتر)
ب) بعضٌ أخر أطواله كبيرة، وهو يقاس بالأمتار أو مئات الأمتار مثل أمواج الراديو والتلفاز
- الشكل الآتي يبين الأطوال الموجية والترددات المختلفة للطيف الكهرومغناطيسي:
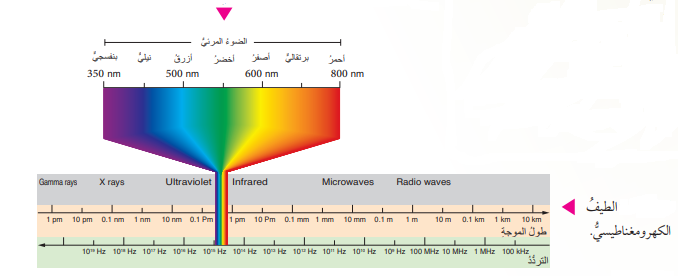
- ينقسم الطيف الكهرومغناطيسي إلى قسمين :
أ) الطيف المرئي :
- يمثل هذا الطيف الضوء العادي (ضوء الشمس) الذي نشاهده في الفضاء ويمكن للعين تمييزه،
- وهو مدى ضيق من الأطوال موجية في الطيف الكهرومغناطيسي ، يتراوح بين (350 - 800 ) نانومتر
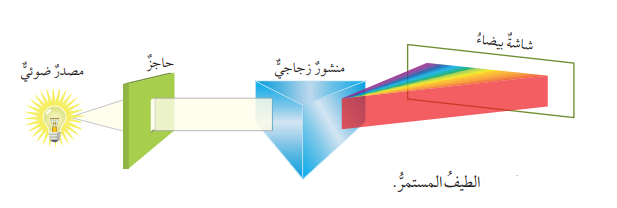
- يظهر عند تحليل الضوء العادي أو ضوء الشمس خلال منشور زجاجي على شكل حزمة من الأشعة الملونة المتتابعة (الأطوال الموجية، الترددات ) من دون ظهور حدود فاصلة واضحة بينها وقد أطلق على هذه الحزمة إسم (الطيف المتصل ) أو ( الطيف المستمر )
- تعريف الطيف المستمر (الطيف المتصل ) : هو مجموعة الأطوال الموجية التي تظهر في صورة مجموعة من الألوان المتتابعة المتداخلة التي يتكون منها الضوء العادي
- أمثلة على الطيف المتصل أو (المستمر ) :
قوس المطر الذي يظهر في السماء نتيجة تشتيت حباب المطر لضوء الشمس كما في الشكل الآتي :

- الشكل الآتي يمثل الطيف المستمر (الطيف المتصل ) :
سؤال(1):
أُفسر سبب تحلل الضوء بعد خروجه من المنشور :
الإجابة :
عندما ينتقل الضوء بين وسطين مختلفين في الكثافة مثل (الماء، الهواء) ، فإن الأطوال الموجية المختلفة تنكسر(تنحرف) عن مسارها بزوايا مختلفة، بناءً على تردد الإشعاع الضوئي وطوله؛ لذا يتشتت الضوء بعد خروجه من المنشور.
ب) الطيف غير المرئي:
- يشمل هذا الطيف جميع الأطوال الموجية التي يزيد طولها عن 800 نانومتر وتقع تحت الضوء الأحمر مثل:
1) أمواج الراديو والتلفاز 2) أمواج الميكروويف التي تستخدم في تسخين الطعام وطهيه
- يشمل أيضًا : تلك الأطوال التي يقل طولها الموجي عن 350 نانومتر والتي تقع فوق الضوء البنفسجي : مثل :
- الأشعة السينية المستخدمة في تصوير أجزاء الجسم مثل العظام و بعض أجزتئه الداخلية (التصوير الملون )
- أجرى العالمان ماكس بلانك و البرت أينشتاين تجارب عديدة لدراسة الضوء وتعرُف طبيعته
- أسفرت هذه التجارب عن معرفة :
أ) الطبيعة المزدوجة (موجية – مادية ) للضوء
ب) إنبعاث الضوء من الذرات بترددات محددة تسمى الكم أو الفوتونات التي يحمل كل منها مفدارًا محددًا من الطاقة يتناسب طرديًا مع تردده، وهي تمثل الوحدات الأساسية المكونة للضوء
ملاحظة : الفوتونات أو الكم : هي التي تمثل الوحدات الأساسية المكونة للضوء.
سؤال(2):
ما الفرق بين الكم والفوتون :
الإجابة :
الكم : هو مقدار محدد من الطاقة ينبعث من الذرة المثارة نتيجة إنتقال الإلكترون فيها من مستوى طاقة أعلى إلى مستوى طاقة أقل، على نحو يوافق فرق الطاقة بين المستويين .
الفوتون : هو جسيمات مادية متناهية في الصغر تمثل الوحدات الأساسية المكونة للضوء ويحمل كل منها مقدارًا محددًا من الطاقة.
* عبر بلانك عما سبق بالعلاقة الآتية :

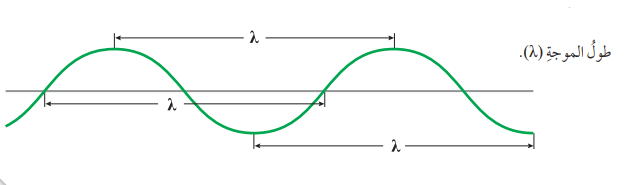
- طول الموجة (λ) (Wavelength): المسافة الفاصلة بين قمتين متتاليتين أو قاعين متتالين ، وهي تقاس بالمتر، أو النانو متر
- الشكل الأتي يبين طول الموجة :
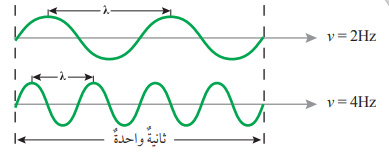
- التردد (v)(Frequency) : هو عدد الموجات التي تمر بنقطة في ثانية، وهو يقاس بالهيرتز (Hz)، ويتناسب عكسيًا مع طول الموجة
- الشكل الآتي يبين العلاقة بين التردد وطول الموجة :
سؤال(3):
في الشكل الآتي:
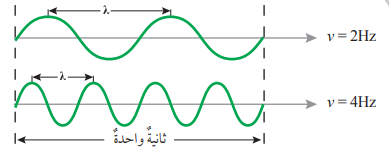
أي الترددين يكون به الطول الموجي الأكبر :
الإجابة :
التردد الأول : لأن العلاقة بين التردد والطول الموجي هي علاقة عكسية أي أنه كلما قل التردد إزداد الطول الموجي والعكس صحيح.
- الطيف الذري (Atomic Spectrum):
- تعريفه : هو مجموعة من الأمواج الضوئية التي تصدر عن ذرات العناصر، ويقع بعضها في منطقة الضوء المرئي، وبعضها الأخرفي منطقة الضوء غير المرئي.
- ملاحظات العلماء:
- أن ذرات العنصر تكتسب طاقة عند تسخينها فتصبح في حالة عدم إستقرار وتسمى بــ الذرات المثارة
- وأن الذرة لا تعود إلى حالة الإستقرار إلا بعد فقدها الطاقة على شكل أمواج ضوئية .
- توقعات العلماء :
- أن يكون الضوء الصادر عن هذه الذرات متصلًا
- النتيجة الفعلية التي وجدها العلماء :
- عند تحليل الضوء الصادر عن الذرات المثارة مثل ضوء مصباح الصوديوم أو ضوء مصباح الهيدروجين تبين أن الضوء يظهر على شكل عدد من الخطوط الملونة المتباعدة والتي يتميز كل منها بطول موجة وتردد خاصين به بما يعرف بإسم الطيف المنفصل، أو الطيف الخطي والذي يعرف بــ (طيف الإنبعاث الخطي)
- تعريف طيف الإنبعاث الخطي : هو مجموعة من الأطوال الموجية للضوء الصادر عن ذرات العنصر المثارة عند عودة الإلكترون إلى حالة الإستقرار
- تعريف الطيف الخطي (المنفصل) : هو مجموعة من الأطوال الموجية التي تظهر في صورة مجموعة من الألوان المتباعدة التي تظهر في منطقة الطيف المرئي
- الشكل الآتي يبين الطيف الخطي لذرة الهيدروجين :
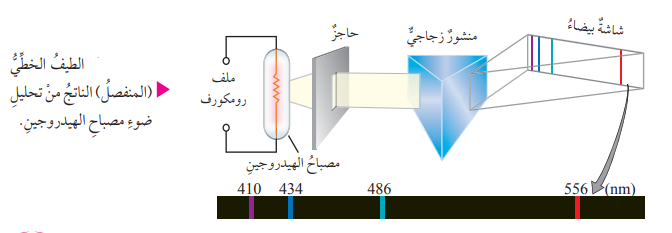
- عند تحول ذرات العنصر إلى ذرات مثارة، فإنها تكتسب طاقة على شكل إشعاعات ذات تردد وأطوال موجية محددة تسمى بـ طيف الإمتصاص الخطي
- يمكن تعرف طيف الإمتصاص الخطي من خلال :
- إمرار طيف مستمر مثل (طيف الشمس) خلال بخار أحد العناصر، فتمتص ذرات العنصر الخطوط الطيفية الخاصة بها
- يظهر طيف الإمتصاص في المطياف على شكل خطوط معتمة سوداء (مناطق الإمتصاص)
- عند مقارنتها بطيف الإنبعاث للعنصر نفسه يمكن التنبؤ بها، فهي تشبه طيف الإنبعاث من حيث الترددات، والأطوال الموجية لكنها تكون على شكل خطوط معتمة، في حين تكون خطوط طيف الإنبعاث على شكل خطوط مضيئة ملونة.
ملاحظة (1) :
يعد طيف الإنبعاث الخطي مميزًا للعنصر (مثل بصمة الإصبع للإنسان ) حيث أثبتت دراسات التحليل الكيميائي (اختبار اللهب) أن لكل عنصر طيفًا خطيًا خاصًا به يميزه من الطيف الخطي لأي عنصر أخر .
مثال :
لون الطيف لذرات الصوديوم : أصفر
لون الطيف لذرات البوتاسيوم : بنفسجي
لون الطيف لذرات الباريوم : أخضر مصف
- الشكل الآتي يبين المقارنة بين طيف االإمتصاص الخطي وطيف الإنبعاث الخطي لذرات عنصر الليثيوم :
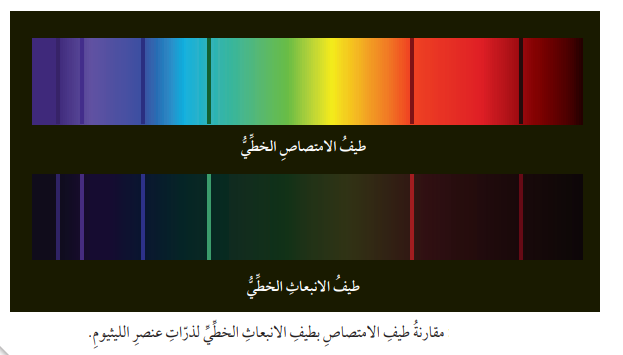
ملاحظة (2) :
- يذكر أن الطيف الذري يستخدم على نطاق واسع في التحاليل الكيميائية للتعرُف على العناصر المكونة للمُركبات والمواد المختلفة
- يستخدم أيضًا في مجال التحاليل الطبية، والصناعية، والزراعية، وغيرها .
- يعد الطيف الذري هو الأساس الذي قامت عليه نظرية بور لذرة الهيدروجين.
سؤال(4):
لماذا يختلف الطيف الذري من عنصر لأخر :
الإجابة :
بسبب إختلاف تركيب الذرة وبنيتها من عنصر إلى أخر، وإختلاف عدد البروتونات، ومستويات الطاقة، وكيفية توزيع الإلكترونات فيها .
سؤال(5):
أُقارن بين الضوء الذي يظهر في الطيف المتصل والضوء الذي يظهر في الطيف المنفصل :
الإجابة :
الطيف المتصل ينتج من تحليل الضوء العادي أو ضوء الشمس خلال منشور زجاجي على شكل حزمة من الأشعة الملونة المتتابعة من دون ظهور حدود فاصلة واضحة بينها، أما الطيف المنفصل فينتج من تحليل الضوء الصادر عن الذرات المثارة مثل ضوء مصباح الصوديوم، أو ضوء مصباح الهيدروجين ويظهر على شكل عدد من الخطوط الملونة المتباعدة، التي يمتاز كل منها بطول موجة وتردد خاص به .
- التجربة (1) : إختلاف طيف الإنبعاث للفلزات المختلفة :
- الهدف من التجربة :
تمييز الأطياف الذرية لبعض العناصر
- المواد والأدوات المستخدمة :
- كلوريد الصوديوم
- كلوريد الليثيوم
- كلوريد البوتاسيوم
- كلوريد الكالسيوم
- كلوريد النحاس (I)
- سلك بلاتين
- محلول حمض الهيدروكلوريك المخفف
- موقد بنسن
- ماء مقطر
- زجاجات ساعة عددها 5
- كأس زجاجية
- خطوات العمل :
- أضع في كل زجاجة ساعة كمية قليلة من أحد الأملاح
- أشعل موقد بنسن، ثم أتركه قريبًا من مكان تنفيذ الإجراءات
- أجرب، أطبق : أغمس سلك البلاتين في محلول حمض الهيدروكلوريك لتنظيفه من أي عوالق، ثم أضعه على اللهب بضع ثوان
- أجرب ،أطبق: أغمس سلك البلاتين في الماء المقطر، ام أغمسه في كلوريد الصوديوم ليلتقط بعض الملح
- الاحظ: أضع سلك البلاتين على اللهب لحرق الملح ما لون الطيفالذي أشاهده، أدون إجابتي في جدول
- أُطبق الخطوات السابقة على جميع الأملاح الأخرى التي ورد ذكرها أنفًا، مدونًا في الجدول لون الطيف في كل مرة
- التحليل والإستنتاج :
1) هل يختلف لون الطيف من فلز إلى أخر في المركبات السابقة ؟
2) اعتمادًا على ألوان الطيف المرئي، ما العلاقة بين لون الفلز وطاقته؟
3) ما سبب إختلاف طاقة طيف الإنبعاث الصادر عن ذرات الفلزات المختلفة؟
- الملاحظات على التجربة :
|
صيغة الملح |
NaCl |
LiCl |
KCl |
CaCl2 |
CuCl |
|
إسم الملح |
كلوريد الصوديوم |
كلوريد الليثيوم |
كلوريد البوتاسيوم |
كلوريد الكالسيوم |
كلوريد النحاس(I) |
|
الفلز |
Na |
Li |
K |
Ca |
Cu |
|
لون الطيف |
أصفر |
أحمر وردي |
بنفسجي باهت |
برتقالي |
أزرق |
1) نعم يختلف
2) كلما أصبح لون الطيف مائلًا للأزرق كلما كانت طاقته أعلى
3) إختلاف تركيب الذرات، أختلاف أعدادها الذرية، إختلاف عدد إلكتروناتها ، إختلاف طاقة المستويات ، أو مستويات الطاقة فيها.
- فرضيات نظرية بور ( Bhor’s Postulates Theory) :
- تمكن العالم رذرفورد من وضع نموذج لتفسير بنية الذرة حيث أشار فيه إلى:
- أن الذرة تتكون من نواة موجبة الشحنة، تتركز فيها معظم كتلة الذرة
- تدور حول النواة الإلكترونات السالبة في مسارات دائرية مما يجعل الذرة متعادلة الشحنة الكهربائية
- أسهمت القوانين والنظريات الفيزيائية في إضهار قصور نموذج رذرفورد حيث أفادت:
- بوجوب فقد الإلكترون للطاقة بإستمرار في أثناء دورانه حول مركز مشحون؛ مما يعني أنه يدور في مسار يقلُ نصف القطر تدريجيًا إلى أن يسقط في المركز، يُفترض أن تسقط الإلكترونات في النواة، وتتهدم الذرة، لكن ذلك لا يحدث حقيقةً، فالذرات باقية لا تتهدم .
- اعتمد العالم نيلز بور على النتائج التي توصل إليها العالمان بلانك وآينشتاين، ودرس ذرة الهيدروجين، وتوصل إلى نظرية تفسر حركة الإلكترونات حول النواة من دون سقوطها في المركز وقد تضمنت نظريته إفتراضين، وهما :
1) إمتلاك الإلكترون مقدارًا محددًا من الطاقة يساوي طاقة المستوى الموجود فيه؛ ما يشير إلى وجود مستويات عدة للطاقة (Energy Levels) توجد فيها الإلكترونات، وتعرف بإسم المستويات الرئيسية للطاقة ويرمز إليها بالرمز (n) وتستخدم فيها الأعداد(∞,…,1,2,3,4)
- الشكل الآتي يبين مستويات الطاقة في ذرة الهيدروجين:
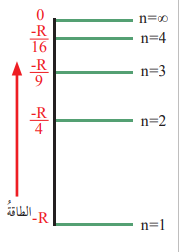
ملاحظة على الشكل :
- إن طاقة وضع الإلكترون في المستوى اللانهائي تساوي صفرًا
- وعندما يقترب من النواة يفقد الطاقة ويزداد إنجذابه نحوها وتصبح طاقة وضعه أقل من الصفر (سالبة )
- يمكن إيجاد طاقة المستوى الذي يوجد فيه الإلكترون بإستخدام العلاقة الآتية :
حيث أن :
.
سؤال(6):
ما العلاقة بين رقم المستوى الرئيس في ذرة الهيدروجين وفرق الطاقة بين المستويات
الإجابة :
كلما زاد رقم المستوى الرئيس (n) زادت طاقته، وأصبحت المستويات أكثر قربًا من بعضها، وقل فرق الطاقة بينها
2) تغير طاقة الإلكترون في الذرة عند إنتقاله من مستوى طاقة إلى أخر على النحو الأتي :
أ) اكتساب إلكترون ذرة الهيدروجين الموجود في المستوى الأول مقدارًا محددًا من الطاقة؛ ما يسمح له بالإنتقال من المستوى الذي يوجد فيه إلى مستوى طاقة أعلى .
ب) إنبعاث الضوء من الذرة في صورة وحدات من الطاقة (الكم) تسمى الفوتونات، وذلك عند إنتقال الإلكترون من مستوى طاقة أعلى إلى مستوى طاقة أقل، ما يؤدي إلى نشوء طيف الإنبعاث الخطي .
* بهذا تمكن بور من تفسير الطيف الخطي لذرة الهيدروجين :
- يكون الإلكترون في حالة الإستقرار (في مستوى الطاقة الأدنى n = 1)، ثم يقفز إلى مستوى طاقة أعلى عند إكتسابه مقدارًا محددً من الطاقة، فتصبح الذرة في حالة عدم إستقرار وتوصف بأنها ذرة مثارة، ولكن سرعان ما يعود الإلكترون إلى حالة الإستقرار من جديد، من خلال فقد مقادير محددة من الطاقة (الفوتونات ) على شكل إشعاعات ضوئية لكل منها طول موجي خاص به
- يمكن حساب فرق الطاقة بين المستويين اللذين إنتقل بينهما الإلكترون بإستخدام المعادلة الآتية :

- الشكل الآتي يبين خطوط الطيف المنبعثة من ذرة الهيدروجين:
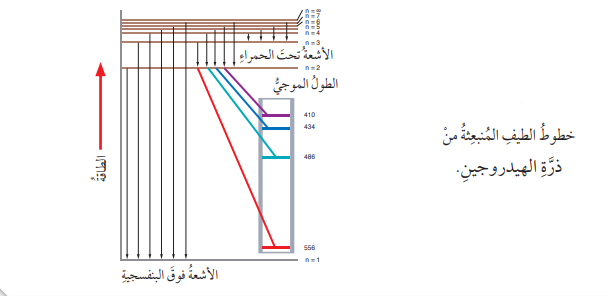
الشكل السابق يبين خطوط الطيف الناتجة عن عودة الإلكترون من المستوى السادس إلى المستوى الأول في ذرة الهيدروجين ويلاحظ أن بعض هذه الخطوط تقع ضمن الطيف المرئي، وأن بعضها الأخر يقع في منطقة الطيف غير المرئي، تبعًا لطاقته، ولطوله الموجي .
مثال (1) :
أحسب طاقة المستوى الرابع في ذرة الهدروجين :
الإجابة :
مثال (2) :
أحسب طاقة الإشعاع المنبعثة من ذرة الهيدروجين المثارة عند عودة الإلكترون من المستوى الرابع إلى المستوى الأول
الإجابة :
سؤال(7):
في الشكل الآتي :

أحسب طاقة كل من المستوى الأول، والثاني، واللانهائي في ذرة الهيدروجين :
الإجابة :
سؤال(8): سؤال تحفيز :
ما تردد الضوء المنبعث من ذرة هيدروجين مثارة في المستوى الرابع عند عودتها إلى حالة الإستقرار :
الإجابة:
تحليل السؤال :
حالة الإستقرار تعني المستوى الأول، ولحساب تردد فوتون الضوء المنبعث من ذرة في هذه الحالة، يجب إيجاد فرق الطاقة بين المستويين الرابع والاول، ثم حساب التردد بإستخدام علاقة بلانك : E = h. v