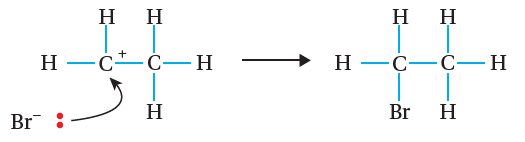تفاعلات الإضافة Addition Reactions
ما المقصود بتفاعلات الإضافة؟
وما المركبات العضوية التي تحدث فيها هذه التفاعلات؟
درست سابقًا؛ أن المركب العضوي يحتوي على ذرة أو مجموعة ذرات في صيغته الكيميائية؛
وتكون مسؤولة عن خصائصه ونشاطه الكيميائي، وتسمى المجموعة الوظيفية.
وتختلف المركبات العضوية في مجموعاتها الوظيفية؛ وتختلف تفاعلاتها تبعًا لذلك.
ورغم أن هذه التفاعلات كثيرة جدًا؛ إلا أنها صنّفت إلى تفاعلات الإضافة، والحذف،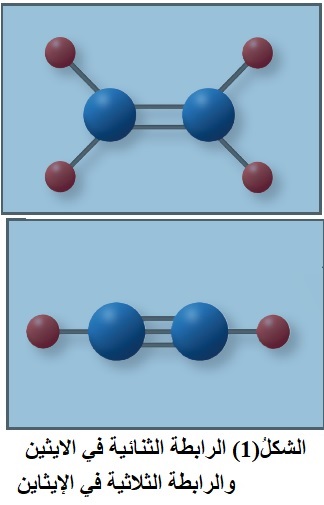
والاستبدال، والتأكسد، والاختزال؛ وذلك لتسهيل دراستها.
عرفت سابقًا؛ أن المركبات العضوية غير المشبعة تحتوي رابطة ثنائية
أو ثلاثية، وأن الرابطة التساهمية الثنائية أو الثلاثية تتكون من نوعين من
الروابط هما سيجما σ القوية، وباي π الضعيفة. ولذلك تعدّ هذه المركبات نشطة كيميائيًا، ومن أشهر تفاعلاتها الإضافة.
وفي هذا الدرس سوف ندرس تفاعلات الإضافة في كل من الألكينات والألكاينات ومركبات الكربونيل:
تعتمد تفاعلات الإضافة في المركبات العضوية على طبيعة الروابط المكونة لها، فمثلاً؛ يحتوي الألكين على رابطة تساهمية ثنائية بين ذرتي كربون C=C ، في حين يحتوي الألكاين على رابطة تساهمية ثلاثية C≡C أنظر الشكل(1). أمّا مركب الكربونيل (الألديهايد أو الكيتون)؛ فيحتوي على رابطة تساهمية ثنائية بين ذرة الكربون وذرة الأكسجين C=O. فما المقصود بتفاعل الإضافة؟
يُعرَف تفاعل الإضافة Addition Reaction ؛ بأنه تفاعل بين جزيئين يحتوي أحد الجزيئين المتفاعلين على الرابطة الثنائية أو الثلاثية لتكوين جزيء واحد جديد.
وعند حدوث التفاعل يتحول المركب العضوي غير المشبع إلى مركب عضوي مشبع.
تفاعلات الإضافة في الألكينات Addition Reactions in Alkenes
كيف تحدث تفاعلات الإضافة في الألكينات؟
يتفاعل الألكين بإضافة جزيء إلى ذرتي كربون الرابطة الثنائية الموجودة فيه؛ فتنكسر رابطة π الضعيفة، وتتكون -بدلاً منها- رابطتان من النوع σ الأقوى؛
كما هو موضّح في المعادلة العامة الآتية:
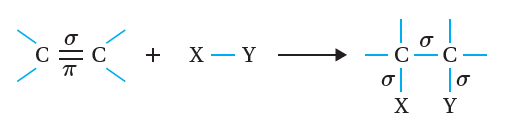
ويمكن تفسير التفاعل؛ بأن الرابطة الثنائية منطقة ذات كثافة إلكترونية عالية سالبة الشحنة،
تقوم بجذب الطرف الموجب للجزيء المضاف مكوّنةً معه رابطة تساهمية،
ويطلق على الرابطة الثنائية والأيونات السالبة مثل-OH-, Br اسم نيوكليوفيلات Nucleophiles ،
كما يطلق على الأطراف الموجبة للجزيئات، مثل +H اسم إلكتروفيلات Electrophiles ، وهي أطراف محبّة للإلكترونات، تنجذب إلى منطقة الكثافة الإلكترونية السالبة؛ وذلك لحاجتها إلى زوج إلكترونات.
ومن الأمثلة على هذه التفاعلات إضافة جزيء كلّ من الهيدروجين،أو الهالوجين، أو هاليد الهيدروجين، أو الماء، إلى الرابطة الثنائية في الألكين.
الألكين المتماثل والألكين غير المتماثل
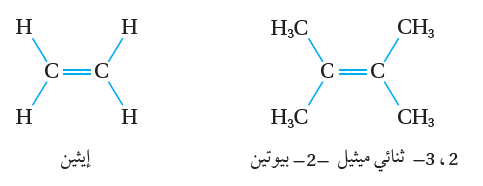
يعدّ الألكين متماثلاً عندما ترتبط كل ذرة كربون من ذرتي كربون الرابطة الثنائية بذرات أو مجموعات متماثلة أنظر الشكل(2)؛ 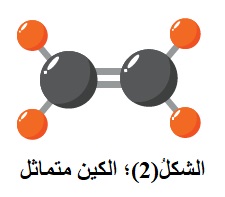
فمثلاً؛ ترتبط كل ذرة كربون في جزيء الإيثين بذرتي هيدروجين،
وكذلك في المركب 2، 3-ثنائي ميثيل -2-بيوتين؛ترتبط كل ذرة كربون من ذرتي كربون الرابطة الثنائية بمجموعتي ميثيل، كما يأتي:
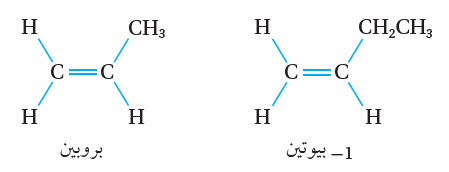
أما في الألكين غير المتماثل أنظر الشكل(3) فتكون الذرات أو المجموعات المرتبطة 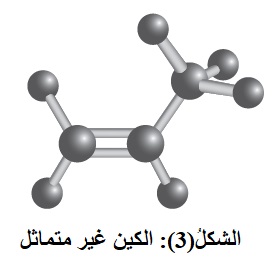 بذرتي كربون الرابطة الثنائية غير متماثلة.
بذرتي كربون الرابطة الثنائية غير متماثلة.
فمثلاً؛ في البروبين ترتبط إحدى ذرتي كربون الرابطة الثنائية بذرتي هيدروجين، وترتبط ذرة الكربون الأخرى بذرة هيدروجين ومجموعة ميثيل.
وفي المركب 1- بيوتين؛ ترتبط إحدى ذرتي كربون الرابطة الثنائية بذرتي هيدروجين،وترتبط الأخرى بذرة هيدروجين ومجموعة إيثيل كما يأتي:
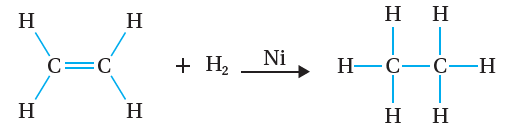
إضافة الهيدروجين (H2)الهدرجة :
يتفاعل جزيء الإيثين CH2 = CH2 مع غاز الهيدروجين H2 ، بوجود عامل مساعد من النيكل Ni 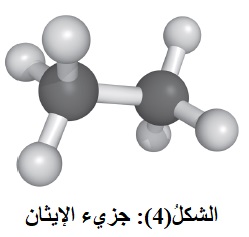
أو البلاتين Pt، وتحت درجة حرارة مناسبة، فينتج الإيثان CH3CH3، أنظر الشكل(4) ، ويعبّر عن التفاعل بالمعادلة الآتية:
وكذلك يتفاعل جزيء البروبين CH3CH=CH2 مع غاز الهيدروجين مكوّنًا جزيء البروبان CH3CH2CH3 كما يأتي:
CH3CH=CH2 + H2 CH3CH2CH3
إضافة هاليد الهيدروجين (HCl , HBr, HI):
يتفاعل بروميد الهيدروجين HBr مع الألكين المتماثل مثل الإيثين CH2=CH2؛وفق المعادلة الآتية: CH2=CH2 + HBr → CH3CH2Br
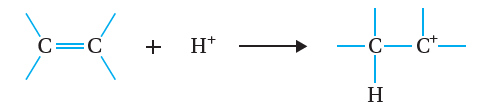
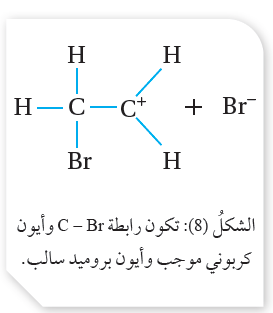
يتضح من المعادلة أن ذرة البروم ترتبط مع إحدى ذرتي كربون الرابطة الثنائية؛ مكوّنةً ناتجًا واحدًا هو 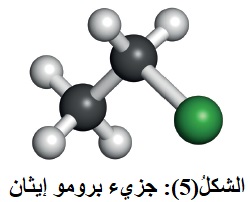 بروموإيثان CH3CH2Br أنظر الشكل(5)، ويمكن تفسير التفاعل بأن ينجذب الإلكتروفيل+H من جزيءHBr نحو الرابطة الثنائية؛مما يؤدي إلى كسر رابطةπ، ويرتبط +H بإحدى ذرتي الكربون مكوّنًا الرابطة C-H، وتنشأ على ذرة الكربون الأخرى شحنة موجبة، فيتكون أيون كربوني موجب؛ كما هو موضّح في المعادلة الآتية:
بروموإيثان CH3CH2Br أنظر الشكل(5)، ويمكن تفسير التفاعل بأن ينجذب الإلكتروفيل+H من جزيءHBr نحو الرابطة الثنائية؛مما يؤدي إلى كسر رابطةπ، ويرتبط +H بإحدى ذرتي الكربون مكوّنًا الرابطة C-H، وتنشأ على ذرة الكربون الأخرى شحنة موجبة، فيتكون أيون كربوني موجب؛ كما هو موضّح في المعادلة الآتية:
يتبع ذلك ارتباط النيوكليوفيل-Br بالأيون الكربوني الموجب؛ فتتكون رابطة C-Br كما يأتي:
والأيون الكربوني قد يكون أوّليًا أو ثانويًا أو ثالِثيًّا. أنظر الجدول رقم (1)،
| الجدول رقم ( 1) | |
| نوع الأيون الكربوني | الصيغة البنائية |
| الأيون الكربوني الأولي | 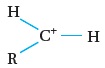 |
| الأيون الكربوني الثانوي | 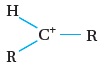 |
| الأيون الكربوني الثالثي | 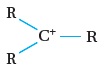 |
حيث يوضح شكلاً مبسّطًا لأنواع الأيون الكربوني،
حيث R مجموعة ألكيل.
ويكون الأيون الكربوني الثالثي أكثر استقرارًا وثباتًا من الأيون الكربوني الثانوي، وأقلها ثباتًا؛ الأيون الكربوني الأولي.
ويُسمّى التفاعل السابق؛ إضافة إلكتروفيلية ؛Electrophilic Addition لأن الإلكتروفيل+H هو الذي يبدأ التفاعل مع الرابطة الثنائية في الألكين.
ونذكر مثالاً آخر على هذه الإضافة؛إضافة بروميد الهيدروجين HBr إلى ألكين غير متماثل، مثل البروبين CH3CH=CH2 ؛ فإنه يحتمل تكون ناتجين، كما هو موضحّ في المعادلتين الآتيتين:
|
إجابة سؤال أفكر: كيف أميّز بين أنواع الأيونات الكربونية الثلاثة؟ يمكن ذلك بالاعتماد على عدد مجموعات الألكيل R المرتبطة بالأيون الكربوني الموجب. الأولي: ترتبط ذرة الكربون التي عليها الشحنة الموجبة بمجموعة الكيلR وذرتي هيدروجين الثانوي: ترتبط ذرة الكربون التي عليها الشحنة الموجبة ترتبط بمجموعتي الكيلR وذرة هيدروجين واحدة الثالثي: ترتبط ذرة الكربون التي عليها الشحنة الموجبة بثلاث مجموعات الكيلR فقط |
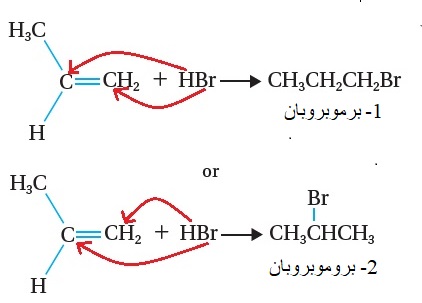
يتضح من المعادلتين؛ أن ذرة البروم يمكن أن ترتبط مع إحدى ذرتي كربون الرابطة الثنائية، وبناء على ذلك؛ يحتمل أن يتكون المركب 1-برموبروبان
أو المركب 2- بروموبروبان،
وقد وجد عمليًا أن الناتج الرئيس الذي تكوَن هو 2- بروموبروبان، أنظر الشكل ( 6).
ويمكن تفسير ذلك عن طريق قاعدة ماركوفينيكوف Markovnikov’s Rule ، حيث تنصّ أن: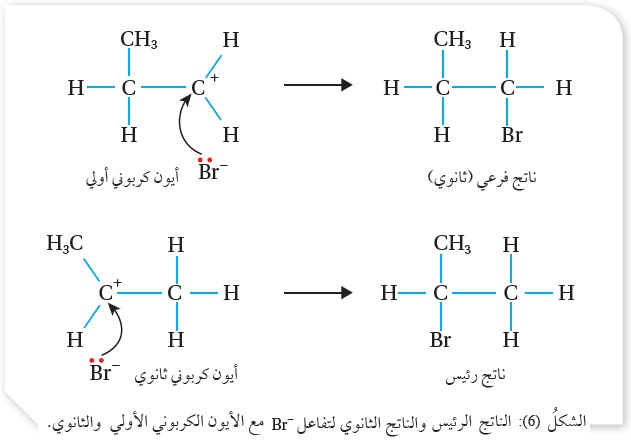
إضافة هاليد الهيدروجين HX إلى ألكين غير متماثل؛ فإن ذرة الهيدروجين ترتبط بذرة كربون الرابطة الثنائية المرتبطة بالعدد الأكبر من ذرات الهيدروجين.
وبهذا؛ فإن تفاعل أيون البروميد -Br مع الأيون الكربوني الثانوي الأكثر استقرارًا وثباتًا، يؤدي إلى تكوين الناتج الرئيس (2- بروموبروبان)، مقارنةً بتفاعل أيون البروميد -Br مع الأيون الكربوني الأوّلي الأقل استقرارًا وثباتًا، الذي يؤدي إلى تكوين الناتج الفرعي، كما هو موضّح في الشكل(6).
إجابة سؤال أفكر:
أفسر عدم تكون أيون كربوني ثالِثيّ في التفاعل بروميدالهيدروجين مع البروبين؟
لأن ذرتي كربون الرابطة الثنائية في البروبين ترتبط إحداهما بمجموعة الكيل واحدة أو مجموعتي الكيل، وبذلك فإن ذرة الكربون التي تحمل الشحنة الموجبة في المركب الناتج ترتبط بمجموعة الكيل واحدة وذرتي هيدروجين أو ترتبط بمجموعتي الكيل وذرة هيدروجين واحدة ،
وبالتالي لا يمكن تكوين أيون كربون ثالثي.
إضافة الماء H2O:
يتفاعل بخار الماء مع الإيثين مثلاً؛ بوجود عامل مساعد، مثل حمض الفسفوريك H3PO4 ، أو حمض الكبريتيك H2SO4 ، وتحت ضغط جوي ودرجة حرارة مناسبين؛ وذلك لإنتاج الإيثانول CH3CH2OH ، ويعبّر عن التفاعل بالمعادلة الآتية:
CH2=CH2 + H2O CH3CH2OH
وكذلك يتفاعل البروبين CH3CH=CH2 مع الماء في وسط حمضي؛ تبعًا لقاعدة ماركوفنيكوف
مكوّنًا المركب 2- بروبانول (وهو كحول ثانوي) كما في المعادلة الآتية:
|
الربط بالحياة:تستخدم معقّمات اليدين بشكل شائع في مختلف مثل الأماكن، المستشفيات، والمطاعم، والمدارس، وفي الاستعمال الشخصي؛وذلك لقتل الميكروبات والحدّ من انتقال العدوى. ورغم استخدام مكونات مختلفة في تصنيع المعقمات؛ إلا أن المكوّن الفعال هو الإيثانول أو 2- بروبانول. |
إضافة الهالوجين (Cl2 ,Br2):
تتفاعل الألكينات مع الهالوجينات، مثل الكلور أو البروم عند درجة حرارة الغرفة،
فمثلاً؛ يتفاعل الإيثين مع غاز الكلور مكوّنًا المركب 1، 2-ثنائي كلورو إيثان CH2ClCH2Cl ؛ كما هو موضّح في المعادلة الآتية:
CH2=CH2 + Cl2 → CH2ClCH2Cl
ويتفاعل الإيثين مع البروم Br2 المذاب في ثنائي كلوروميثان CH2Cl2 مكوّنًا المركب
1، 2-ثنائي بروموإيثان CH2BrCH2Br ، كما هو موضح في المعادلة الآتية:
CH2=CH2 + Br2 CH2BrCH2Br
وتفسير ذلك؛ أن الرابطة الثنائية ذات كثافة إلكترونية عالية سالبة الشحنة تسبب استقطاب جزي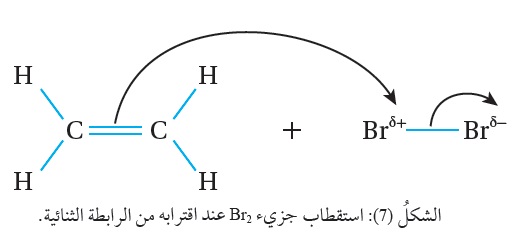 ء الهالوجين القريب منها، فتظهر على إحدى ذرتي الجزيء شحنة جزئية موجبة، وتظهر على الذرة الأخرى شحنة جزئية سالبة، كما هو موضّح في الشكل ( 7) الذي يبين استقطاب جزيء Br2 عند اقترابه من الرابطة الثنائية.
ء الهالوجين القريب منها، فتظهر على إحدى ذرتي الجزيء شحنة جزئية موجبة، وتظهر على الذرة الأخرى شحنة جزئية سالبة، كما هو موضّح في الشكل ( 7) الذي يبين استقطاب جزيء Br2 عند اقترابه من الرابطة الثنائية.
ثم يحدث تجاذب بين الشحنة السالبة للرابطة C=C من الألكين وذرة البروم
ذات الشحنة الجزئية الموجبة؛ فتنكسر الرابطة π في الألكين، وتتكون الرابطة
C – Br ، وينتج أيون كربوني موجب، وأيون بروميد سالب. أنظر الشكل ( 8).
بعد ذلك؛ ينجذب أيون البروميد السالب إلى ذرة الكربون الموجبة
في الأيون الكربوني، فتتكوّن رابطة جديدة C – Br ؛ وبذلك يتكون المركب
1، 2 -ثنائي بروموإيثان، كما هو موضح في المعادلة الآتية:
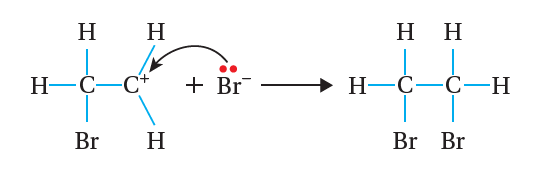
يستعمل محلول البروم المائي (ماء البروم) ذو اللون البرتقالي المصفرّ في الكشف عن وجود الرابطة الثنا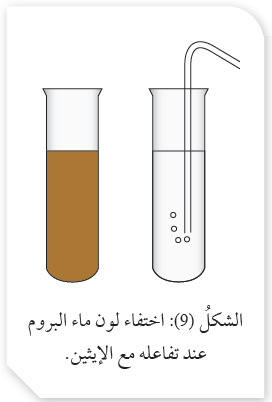
الهيدروكربون غير المشبع،
فمثلاً؛ عند ضخ فقاعات غاز الإيثين عبر محلول البروم يختفي لون محلول البروم، كما هو موضح في الشكل (9). أما عند إضافة محلول البروم إلى الإيثان فإنه لا يتغير لون المحلول، مما يشير إلى عدم حدوث تفاعل.
إجابة سؤال أتحقَّق:
1 - أكمل المعادلات الآتية:
CH3CH=CHCH3 + H2 CH3CH2CH2CH3
CH2=CH2 + Cl2 CH2Cl-CH2Cl
CH3 CH2CH=CH2 + HCl CH3 CH2CHClCH3
CH3CH2CH=CH2 + H2O CH3 CH2CHOHCH3
2- أكتب معادلة كيميائية توضح إضافة بروميد الهيدروجين إلى المركب 1- هكسين CH3CH2CH2CH2CH=CH2
CH3CH2CH2CH2CH=CH2 + HBr
تفاعلات الإضافة في الألكاينات Addition Reactions in Alkynes
هل تختلف تفاعلات الإضافة إلى الألكاينات عنها في الألكينات؟
ما وجه الاختلاف في الحالتين؟
تتفاعل الألكاينات بتفاعلات الإضافة كما في الألكينات؛ إذ يمكن إضافة جزيئين من الهيدروجين، أو الهالوجين، أو هاليد الهيدروجين إلى الألكاين؛ فتنكسر رابطتي π، ويتكون بدلً منها أربع روابط من النوع σ، والأمثلة الآتية توضّح هذه الإضافة:
إضافة الهيدروجين:
يتفاعل الألكاين مع كمية وافرة من الهيدروجين بوجود عامل مساعد، مثل النيكل Ni أو البلاتين Pt مكوّنًا الألكان،
فمثلاً؛ يتفاعل جزيء الإيثاين HC≡CH مع الهيدروجين مكوّنًا جزيءالإيثان CH3CH3 ،
ويمكن التعبير عن معادلة التفاعل كما يأتي:
H-C≡C-H + 2H2 CH3CH3
وكذلك يتفاعل الجزيء 1- بيوتاين CH3CH2C ≡ CH ، مع كمية وافرة من الهيدروجين،
مكوّنًا جزيء البيوتان CH3CH2CH2CH3 ، كما يأتي:
CH3 CH2 C≡CH + 2H2 CH3 CH2 CH2 CH3
إضافة الهالوجين:
يتفاعل الألكاين مع كمية وافرة من الهالوجين؛ بوجود عامل مساعد مناسب مكوّناً هاليد الألكيل، فمثلاً؛
يتفاعل جزيء الإيثاين CH≡CH مع جزيئين من البروم 2Br2 المذابين في ثنائي كلوروميثان CH2Cl2 مكوّنًا الجزيء 2،2،1،1 - رباعي برومو إيثان CHBr2CHBr2 ، كما هو موضح في المعادلة الآتية:
H-C≡C-H + 2Br2 CHBr2CHBr2
وكذلك يتفاعل جزيء البروباين CH3C≡CH مع جزيئين من الكلور Cl2 مكوّنًا 2،2،1،1 -رباعي كلورو بروبان CH3CCl2CHCl2 ؛ كما يأتي:
CH3C≡CH + 2Cl2 CH3CCl2CHCl2
إضافة هاليد الهيدروجين:
يضاف جزيئان من هاليد الهيدروجين إلى الألكاين وفق قاعدة ماركوفينكوف؛ إذ ترتبط ذرتا هيدروجين من هاليد الهيروجين مع ذرة كربون الرابطة الثلاثية المرتبطة بالعدد الأكبر من ذرات الهيدروجين في الألكاين، فمثلاً؛
يضاف جزيئان من بروميد الهيدروجين HBr ، إلى جزيء البروباين CH3C≡CH ؛فينتج
جزيء 2،2 -ثنائي بروموبروبان CH3CBr2CH3 ؛ كما يأتي:
CH3C≡CH + 2HBr CH3CBr2CH3
كما يضاف جزيئين من كلوريد الهيدروجين HCl ، إلى جزيء الإيثاين CH≡CH مكوّنًا الجزيء 1،1-ثنائي كلورو إيثان CH3CHCl2 كما يأتي:
CH≡CH + 2HCl CH3CHCl2
إجابة سؤال أتحقَّق:
1 - أكمل المعادلتين الآتيتين:
• CH3CH2C≡CH + 2HCl CH3CH2CCl2CH3
• CH3C≡CH + 2Cl2 CH3CCl2-CHCl2
2- أكتب معادلة تفاعل 2-بيوتاين CH3C≡CCH3 مع كمية وافرة من الهيدروجين.
CH3C≡CCH3 + 2H2 CH3CH2CH2CH3
تفاعلات الإضافة في الألديهايدات والكيتونات Addition Reactions in Aldehydes and Ketones
لماذا تتفاعل الألديهايدات والكيتونات بالاضافة؟
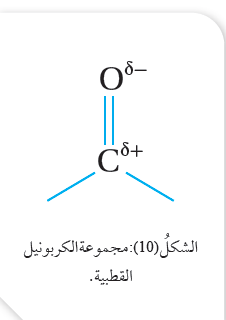
تتشابه الألديهايدات والكيتونات في كثير من تفاعلاتهما الكيميائية؛ وذلك
لاحتواء كلّ منها على مجموعة الكربونيل القطبية التي تحتوي على
رابطة ثنائية بين ذرة الكربون وذرة الأكسجين، أنظر الشكل ( 10).
مما يجعل الألديهايدات والكيتونات تتفاعل بالإضافة، ومن الأمثلة على
هذه التفاعلات، تفاعلاتها مع مركبات غرينارد، ومع الهيدروجين كما يأتي:
فما هو مركب غرينارد؟ وكيف تتم إضافته إلى مجموعة الكربونيل؟ وماذا ينتج عن هذه الإضافة؟
إضافة مركب غرينارد R - MgX
ينتج مركب غرينارد RMgX من تفاعل هاليد الألكيل R-X مع فلزّ المغنيسيوم Mg، بوجود الإيثر (Et) الجاف، كما هو موضّح في المعادلة:
R-X + Mg RMgX
فمثلا؛ ينتج مركب ميثيل كلوريد المغنيسيوم CH3MgCl من تفاعل كلوريد الميثيل(كلوروميثان) CH3Cl
مع فلزّ المغنيسيوم، بوجود الإيثر (Et) الجاف؛ كما يأتي:
CH3Cl + Mg CH3MgCl
وكذلك ينتج مركب إيثيل بروميد المغنيسيوم CH3CH2MgBr من تفاعل بروميد الإيثيل(بروموايثان) CH3CH2Br مع فلزّ المغنيسيوم بوجود الإيثر (Et) الجاف كما يأتي:
CH3CH2Br + Mg CH3CH2MgBr
وحيث أن ذرة المغنيسيوم أقل سالبية كهربائية من ذرة كربون مجموعة الألكيل R المرتبطة بها،لذلك يظهر على ذرة المغنيسيوم شحنة جزئية موجبة، ويظهر على ذرة الكربون المرتبطة بذرة المغنيسيوم من مجموعة الألكيل R شحنة جزئية سالبة ،
وبهذا فإن ذرة الكربون تعدّ نيوكليوفيلا يبدأ التفاعل مع مجموعة الكربونيل، حيث ينجذب النيوكليوفيل نحو ذرة الكربون الموجبة الشحنة في مجموعة الكربونيل في الألديهايد أو الكيتون،
ولذلك يطلق على هذا النوع من الإضافة؛ الإضافة النيوكليوفيلية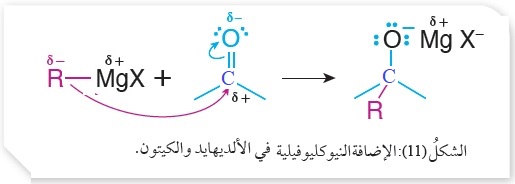
كما هو موضح في الشكل (11) الذي يبين هذه الإضافة.
يتضح من الشكل أن النيوكليوفيل R يرتبط مع ذرة الكربون ذات الشحنة الجزئية الموجبة في مجموعة الكربونيل، ثم يرتبط الالكتروفيل MgX مع ذرة الأكسجين ذات الشحنة الجزئية السالبة؛ وبذلك يتكون ناتج وسطي يتفاعل مع حمض الهيدروكلوريك HCl ، أو حمض الهيدروبروميك HBr ؛ فتحلّ ذرة هيدروجين من الحمض محل (MgX) في المركب الوسطي، وينتج الكحول، ويكون عدد ذرات الكربون في الكحول الناتج مساويًا لمجموع عدد ذرات كربون المادتين المتفاعلتين من مركب الكربونيل ومركب غرينارد،
فمثلً؛ يتفاعل الميثانال HCHO مع ميثيل كلوريد المغنيسيوم CH3MgCl بوجود حمض HCl
فينتج كحول الإيثانول CH3CH2OH ؛ كما هو موضح في المعادلة الآتية:
يتضح من معادلة التفاعل أن عدد ذرات الكربون في الإيثانول CH3CH2OH يساوي اثنتين،
وهذا يساوي مجموع عدد ذرات الكربون في المادتين المتفاعلتين؛
الميثانال HCHO ، وميثيل كلوريد المغنيسيوم CH3MgCl.
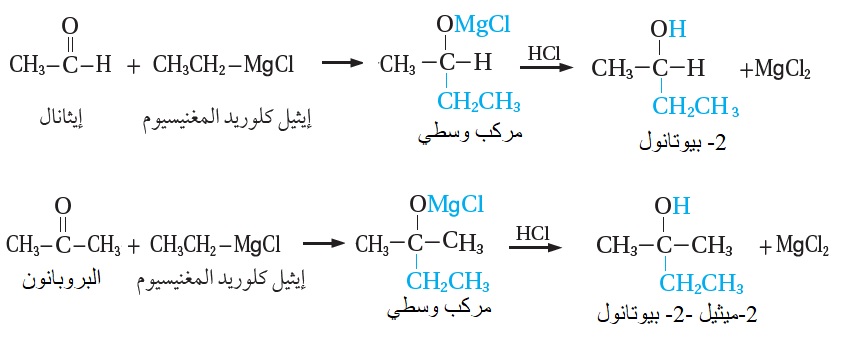
ومن الأمثلة أيضًا؛ تفاعل إيثيل كلوريد المغنيسيوم CH3CH2MgCl مع الإيثانالCH3CHO ،
وكذلك تفاعله مع البروبانون CH3COCH3 ؛ كما هو موضّح في المعادلتين الآتيتين:
إجابة سؤال أفكر: أكتب الصيغة البنائية المحتملة لمركبي غرينارد والألديهايد اللازمين لتكوين مركب 3- بنتانول .
|
الربط بالحياة:استخدمت إحدى الشركات العالمية في تصنيع العطور خليطًا من |
إضافة الهيدروجين:
تتفاعل الألديهايدات والكيتونات مع غاز الهيدروجين بوجود عامل مساعد، مثل النيكل Ni أو البلاتين Pt مكوّنةً الكحولات. فمثلًا؛ يتفاعل الإيثانال CH3CHO مع غاز الهيدروجين H2 مكوّنًا (الإيثانول CH3CH2OH )؛ وفق المعادلة الآتية:
وكذلك يتفاعل البروبانون CH3COCH3 مع غاز الهيدروجين H2 مكوّنًا 2-بروبانول CH3CHOHCH3 ؛ وفق المعادلة الآتية:
إجابة سؤال أتحقَّق:
1 - أكمل المعادلتين الآتيتين:
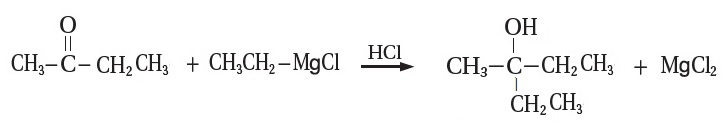
2- أكتب معادلة تفاعل البيوتانون CH3CH2COCH3 مع إيثيل كلوريد المغنيسيوم CH3CH2MgCl ،
متبوعًا بإضافة حمض HCl.
|
الربط بالحياة : خلق الله -عزّ وجلّ- النباتات ولكل منها رائحة مميزة، فاللوز مثلً؛ يحتوي على مركب ألديهايد يعطيه رائحة مميزة. وقد جرى استخلاص هذا المركب ويستخدم في صناعة منكهات المواد الغذائية وفي المستحضرات الطبية. |
تفاعلات الحذف Elimination Reactions
ما المقصود بتفاعل الحذف؟ وما المركبات العضوية التي تحدث فيها تفاعلات حذف؟
درست سابقًا؛ تفاعلات الإضافة في الألكينات، حيث جرى كسر الرابطة π من الرابطة الثنائية في الألكين عند إضافة جزيء هاليد الهيدروجين HX إليه مكوّنًا هاليد الألكيل R-X ، وكذلك إضافة جزيء الماء H2O مكوّنًا الكحول R-OH .
أما تفاعل الحذف ؛ فهو تفاعل يحدث فيه نزع جزيء هاليد الهيدروجين HX من هاليد الألكيل من ذرتي كربون متجاورتين، أو نزع جزيء الماء H2O من الكحول مكوّنًا الألكين.
وتوضح المعادلة العامة الآتية تفاعل الحذف:

الحذف من هاليد الألكيل:
تُصنّف هاليدات الألكيل المحتوية على ذرة هالوجين واحدة إلى أولية °1، وثانوية °2، وثالثية °3،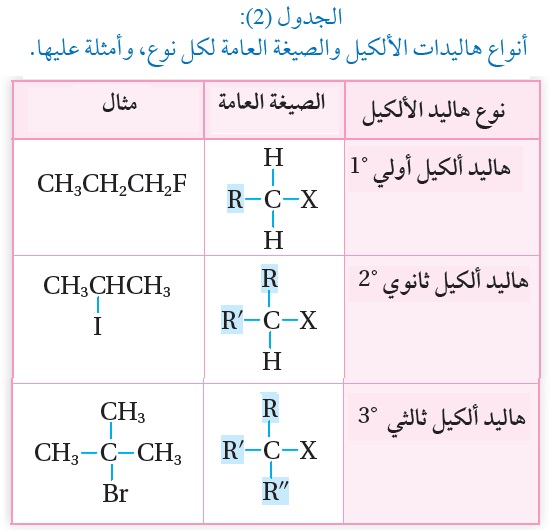
وذلك حسب عدد مجموعات الألكيل المرتبطة بذرة الكربون المتصلة بذرة الهالوجين،كما يوضح الجدول(2). فكيف تتم عملية الحذف؟
يُنتزع جزيء HX من هاليد الألكيل الثانوي أو الثالثي بشكل رئيس؛ وذلك بالتسخين مع محلول مركز من قاعدة قوية، مثل هيدروكسيد البوتاسيوم
KOH أو هيدروكسيد الصوديوم NaOH المذاب في الإيثانول فينتج الألكين.
فمثلً؛ عند تسخين 2- بروموبروبان CH3CHBrCH3 مع محلول هيدروكسيد الصوديوم الكحولي؛ فإنه يتكون المركب العضوي بروبين CH3CH=CH2 ، كما هو موضح في المعادلة الآتية: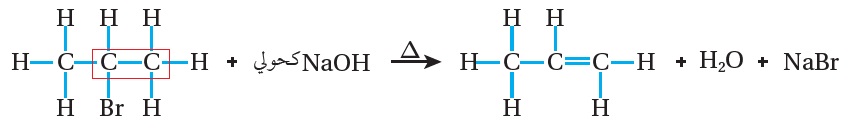
ويمكن كتابة معادلة التفاعل على النحو الآتي:
CH3CHBrCH3 + KOH كحولي CH3CH=CH2 + KBr + H2O
يتضح من المعادلة أنه تم نزع ذرة البرومBr عن ذرة الكربون المرتبطة بها،ونزع ذرة هيدروجينH عن ذرة الكربون المجاورة لها؛ فتكونت رابطة ثنائية بين ذرتي الكربون المتجاورتين ونتج البروبين.
وعند زيادة عدد ذرات الكربون في هاليد الألكيل عن 3 ذرات كربون فيجري نزع ذرة الهيدروجين H من ذرة الكربون المجاورة لذرة الكربون المرتبطة بالهالوجين التي ترتبط بعدد أكبر من مجموعات الألكيل.
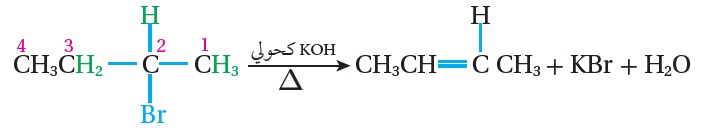
فمثلا ؛ عند تسخين2-بروموبيوتان مع هيدروكسيد البوتاسيومKOH الكحولي تنتزع ذرة البرومBr عن ذرة الكربون المرتبطة بها،ويمكن نزع ذرة الهيدروجين عن ذرة الكربون رقم (3) المرتبطة بمجموعتي الكيل، وقد وجد أن نزع ذرة الهيدروجين عن ذرة الكربون رقم(3)، يؤدي إلى تكوين الرابطة الثنائية الأكثر ثباتًا بين ذرتي كربون 2 و 3 ويكون الناتج 2-بيوتين هو الناتج الرئيس.
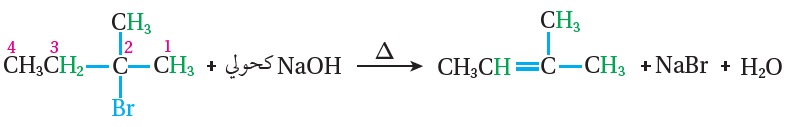
وكذلك عند تسخين(2-ميثيل-2-بروموبيوتان) مع هيدروكسيد الصوديوم NaOH الكحولي؛
فإن ذرة البروم تنتزع عن ذرة الكربون المرتبطة بها، وتنتزع ذرة الهيدروجين عن ذرة الكربون رقم (3) المرتبطة بعدد أكبر من مجموعات الألكيل؛ فيكون الناتج الرئيس(2-ميثيل-2-بيوتين) ،
كما توضح المعادلة الآتية:
إجابة سؤال أتحقَّق: أكتب معادلة تفاعل تسخين 2-كلورو بنتانCH3CHClCH2CH2CH3 مع هيدروكسيد البوتاسيوم KOH الكحولي.
الحذف من الكحول:
عند تسخين الكحول مع حمض الكبريتيك H2SO4 المركز أو حمض الفسفوريكH3PO4 المركز؛ يجري نزع جزيء H2O من ذرتي كربون متجاورتين، حيث تنكسر الرابطة C-OH ؛ مما يؤدي إلى نزع مجموعة OH عن ذرة الكربون المرتبطة بها، ونزع ذرة الهيدروجين H عن ذرة الكربون المجاورة، فتتكون رابطة ثنائية بين ذرتي الكربون المتجاورتين وينتج الألكين، ومثال ذلك:
نزع جزيء الماء من الإيثانول CH3CH2OH ؛ فينتج الإيثين CH2=CH2 ، كما هو موضح في المعادلة الآتية:
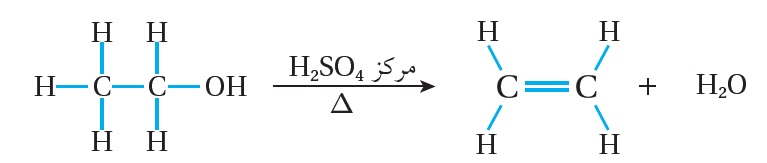
أما عند تسخين 2- بيوتانول مع حمض الفسفوريك المركز H3PO4 ؛
فيجري نزع مجموعة الهيدروكسيل OH عن ذرة الكربون المرتبطة بها، ونزع ذرة الهيدروجين H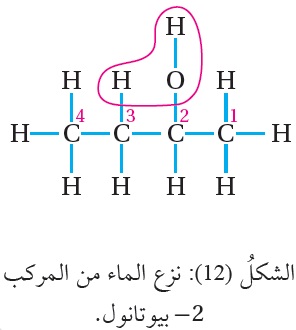
عن ذرة الكربون رقم (3) التي ترتبط بعدد أكبر من مجموعات الألكيل،
كما يوضح الشكل (12) ويتكون 2- بيوتين CH3CH=CHCH3 ،
كما هو موضح في المعادلة الآتية:
CH3CH=CHCH3 + H2O
إجابة سؤال أتحقَّق:
أكتب معادلة تفاعل تسخين المركب 2- هكسانول
مع حمض H2SO4 المركز.
CH3CH2CH2CH=CHCH3 + H2O