تفاعلات الاستبدال Substitution Reactions
ما المقصود بتفاعلات الاستبدال؟ وما المركبات التي تحدث فيها هذه التفاعلات؟
يعدّ تفاعل الاستبدال أحد تفاعلات المركبات العضوية المهمة التي تستخدم في تحضير كثير منها، ويعرّف تفاعل الاستبدال ؛Substitution Reaction بأنه تفاعل تحلّ فيه ذرة أو مجموعة ذرات محل ذرة أو مجموعة ذرات أخرى في المركّب العضوي.
ومن المركبات العضوية التي تتفاعل بالاستبدال؛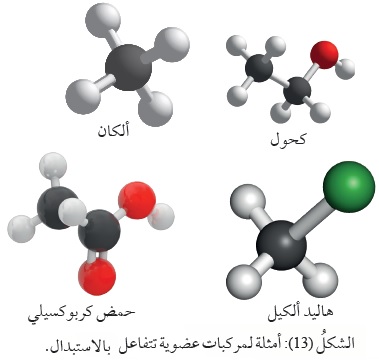
الألكانات، وهاليدات الألكيل، والكحولات، والحموض الكربوكسيلية. أنظر الشكل (13)
الذي يمثل نماذج لأمثلة من المركبات العضوية التي تتفاعل بالاستبدال.
تفاعلات الاستبدال في الألكانات (هلجنة الألكانات):
يُعرَف تفاعل هلجنة الألكانات بأنه؛ تفاعل استبدال تحلّ فيه ذرة هالوجين أو أكثر محل ذرة هيدروجين أو أكثر في الألكان مكوّنًا هاليد الألكيل، ويحدث التفاعل؛ بوجود الضوء، أو بالتسخين الذي يعمل على كسر الرابطة بين ذرتي الهالوجين مكوّنًا ما يسمى جذرًا حرًا Free Radical ؛ ويُعَرَّف بأنه ذرة أو مجموعة ذرات تمتلك إلكترونًا منفردًا؛ مما يجعله شديد النشاط؛ فيتفاعل مع الألكان لتكوين هاليد الألكيل حسب المعادلة:
R-X + H-X R-H + X2
وتترتب الهالوجينات حسب شدة تفاعلها مع الألكان كما يأتي: F2 > Cl2 > Br2 > I2 ،
ويكون تفاعل الفلور نشطًا جدًا، ويحتاج إلى ظروف خاصة لضبطه، أمّا اليود فلا يتفاعل في نفس الظروف؛ لذلك سيُكتفى بدراسة التفاعل مع الكلور والبروم.
فمثلاً؛ يتفاعل الميثان CH4 مع الكلور Cl2 ؛ بوجود الضوء منتجا كلوروميثان حسب المعادلة:
CH4 + Cl2 CH3Cl + HCl
ألاحظ أن ذرة كلور واحدة حلت محل ذرة هيدروجين في استبدال أحادي؛ ويمكن للتفاعل أن يستمر، بحيث تحلّ أكثر من ذرة كلور محل ذرات الهيدروجين،
وسيُكتفى فقط بدراسة الاستبدال الأحادي في الميثان والإيثان CH3CH3.
إجابة سؤال أتحقَّق: أكمل المعادلات الآتية:
CH3CH3 + Br2 CH3CH2Br + HBr
تفاعلات الاستبدال في هاليدات الألكيل:
يحدث تفاعل الاستبدال في هاليدات الألكيل؛ عندما تحلّ ذرة أو مجموعة ذرات محل ذرة الهالوجين فيها.
تتفاعل هاليدات الألكيل الأولية بشكل رئيس بالاستبدال؛ وذلك عند تفاعلها مع قاعدة قوية، مثل هيدروكسيد الصوديوم NaOH ، أو هيدروكسيد البوتاسيوم KOH المذابة في مزيج من الماء والإيثانول بنسبة 1:1 مكوّنةً كحول ROH ،
كما تتفاعل مع أيون ألكوكسيد -RO وتنتج الإيثر ' ROR ، والمعادلة الآتية تمثل المعادلة العامة للتفاعل:
-R-X + Nu:- R-Nu + X
حيث Nu : تشير إلى نيوكليوفيل يمتلك زوجًا من الإلكترونات غير الرابطة، ويمكن أن يكوّن أيونًا سالبًا، مثل -RO أو -OH .
يحدث تفاعل الاستبدال في هاليدات الألكيل الأولية عند تفاعل نيوكليوفيل، مثل أيون الهيدروكسيد (-OH)، مع ذرة الكربون المرتبطة بذرة الهالوجين التي تحمل شحنة جزئية موجبة، حيث يرتبط الأيون السالب -OH مع ذرة الكربون باستخدام زوج الإلكترونات غير الرابط الذي يمتلكه ويخرج الهالوجين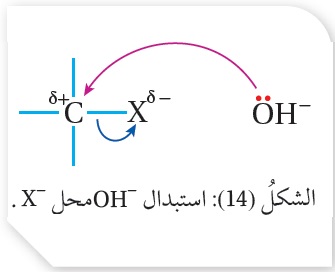 مع زوج إلكترونات الرابطة C-Xعلى شكل-X ويسمى هذا التفاعل الاستبدال النيوكليوفيلي أنظر الشكل (14).
مع زوج إلكترونات الرابطة C-Xعلى شكل-X ويسمى هذا التفاعل الاستبدال النيوكليوفيلي أنظر الشكل (14).
توضح المعادلة الآتية تفاعل برومو إيثان مع محلول NaOH ، ويمكن التعبير عن المحلول NaOH بأيون -OH كما في المعادلة الآتية:
-CH3CH2Br + OH- CH3CH2OH + Br
ويتفاعل 1- كلوروبيوتان CH3CH2CH2CH2Cl مع محلول KOH ، كما في المعادلة الآتية:
CCH3CH2CH2CH2Cl + KOH CH3CH2CH2CH2OH + KCl
كما يتفاعل هاليد الألكيل الأولي مع أيون ألكوكسيد -RO حسب المعادلة العامة الآتية: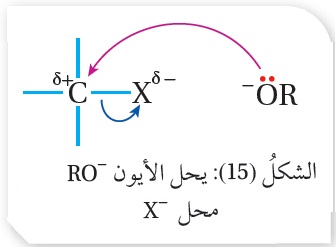
-RX + RO- ROR + X
حيث يحل الأيون -RO محل -X؛ كما يوضح الشكل (15). والمعادلة الآتية
توضح تفاعل أيون الميثوكسيد -CH3O مع كلورو إيثان CH3CH2Cl ؛ لتكوين إيثيل ميثيل إيثر حسب المعادلة:
-CH3CH2Cl + CH3O- CH3CH2OCH3 + Cl
يجري الحصول على أيون-CH3O ؛ من تفاعل كحول الميثانول CH3OH مع فلزّ نشط، مثل الصوديوم؛ إذ ينتج المركب الأيوني ميثوكسيد الصوديوم +CH3O-Na الذي يتفكك في الماء منتجًا أيون -CH3O اللازم للتفاعل، وسنتطرق إلى دراسة تفاعل الكحولات مع الفلزات النشطة لاحقًا.
إجابة سؤال أتحقَّق: أكمل المعادلات الآتية:
• CH3CH2CH2Cl + OH- CH3CH2CH2OH + Cl-
• CH3CH2CH2Br + CH3CH2O- CH3CH2CH2OCH2CH3 + Br-
تفاعلات الاستبدال في الكحولات:
تعدّ الكحولات من المركبات المهمة التي تستخدم لتحضير العديد من المركبات العضوية، وتتفاعل بطرائق مختلفة منها الاستبدال.
يحدث تفاعل الاستبدال في الكحولات R-OH ؛ عندما تحل ذرة أو مجموعة ذرات محل مجموعة الهيدروكسيل OH فيها.
وتُصنّف الكحولات المحتوية على مجموعة هيدروكسيل واحدة إلى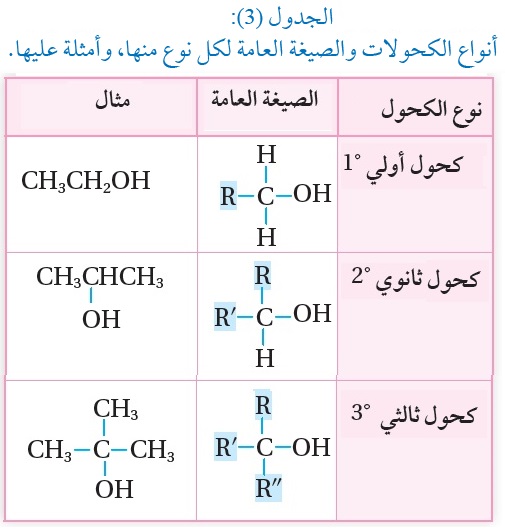
أولية °1، وثانوية °2، وثالِثيّة°3 ،وذلك حسب عدد مجموعات الألكيل المرتبطة بذرة الكربون المتصلة بمجموعة الهيدروكسيل،كما يوضح الجدول(3)،ولهذا التصنيف أهمية عند دراسة تفاعلات الكحولات.
يتفاعل الكحول سواء كان أوليًا، أو ثانويًا، أو ثالثيًا، مع حمضHX المُركّز، وعند درجة حرارة الغرفة بالاستبدال،
حيث تحل ذرة الهالوجينX من الحمض محل مجموعة الهيدروكسيلOH في الكحول حسب المعادلة العامة الآتية:
R-OH + HX (مركز) R-X + HOH
حيث HX هي: HCl ،HBr ،HI
ويعدّ التفاعل من الطرائق الشائعة لتحضير هاليدات الأكيل، كما توضح المعادلات الآتية:
تفاعل الكحولات مع الفلزّات النشطة:
تتفاعل الكحولاتROH مع الفلزّات النشطة، مثل الصوديوم ؛ إذ يحل الصوديوم محل ذرة الهيدروجين في مجموعة الهيدروكسيل OH مكوّنًا ألكوكسيد الصوديوم +RO-Na ، ويتصاعد غاز الهيدروجين حسب المعادلة:
R-OH + Na → R-O-Na+ + ½H2
فمثلا، يتفاعل الإيثانول CH3CH2OHمع الصوديوم مكونا إيثوكسيد الصوديومCH3CH2O-Na+ حسب المعادلة:
CH3CH2OH + Na → CH3CH2O-Na+ + ½H2
أهمية هذا التفاعل أنه يستخدم لتحضير أيون ألكوكسيد -RO ، الذي يتفاعل مع هاليد الألكيل الأولي لتكوين الإيثر كما ورد سابقًا، وكذلك يستخدم للكشف عن الكحولات مخبريّا،إذ يجري تمييز الكحول عن غالبية المركبات العضوية الأخرى بمفاعلتها جميعًا مع فلزّ الصوديوم، وسيلاحظ تصاعد غاز الهيدروجين في أثناء التفاعل مع الكحولات فقط،ويتكون ألكوكسيد الصوديوم +R-O-Na ، وتشترك الحموض الكربوكسيلية مع الكحولات في هذا التفاعل، وإن كان تفاعلها
أكثر نشاطًا من تفاعل الكحولات عند الظروف نفسها.
إجابة سؤال أفكر: أكتب الصيغة البنائية للمركب A
إجابة سؤال أتحقَّق: أكمل المعادلات الآتية:
تفاعل الاستبدال في الحموض الكربوكسيلية:
تتفاعل الحموض الكربوكسيلية مع الكحولات بوجود عامل مساعد، مثل حمض الكبريتيك المركّز H2SO4 لتكوين الإسترات، ويمكن زيادة سرعة التفاعل بالتسخين أيضًا، ويسمى هذا التفاعل الأستَرة Esterification ، تمثّل المعادلة العامة الآتية تفاعل تكوين الإستر:
ألاحظ من المعادلة أن OR من الكحول حلت محل OH من مجموعة الكربوكسيل في الحمض الكربوكسيلي لتكوين الإستر RCOOR لذلك؛ يعد تفاعل الأسترة من تفاعلات الاستبدال في الحموض الكربوكسيلية، وهو تفاعل منعكس يمكن إزاحته باتجاه تكوين الإستر بإزالة الماء من وسط التفاعل.فمثلا :
يتفاعل حمض الميثانويك مع 1-بروبانول لتكوين الماء وميثانوات البروبيل حسب المعادلة:
ويتفكك الإستر بالماء في وسط حمضي مكونًا الحمض الكربوكسيلي والكحول من جديد، فمثلا يمكن لإستر ميثانوات البروبيل في التفاعل العكسي في المعادلة السابقة أن يتفكك عند إضافة الماء بوجود حمضHCl المخفف كعامل مساعد؛ إذ يزاح الاتزان باتجاه اليسار نحو تكوين حمض الميثانويك وكحول 1- بروبانول.
وتمثل المعادلة الآتية تفكك إستر بروبانوات الميثيل CH3CH2COOCH3 بوجود حمض الهيدركلوريك المخفف؛ لإنتاج حمض البروبانويك والميثانول.
ويتفكك الإستر عند تسخينه مع محلول قاعدة قوية أيضا، مثل هيدروكسيدالصوديوم NaOH وينتج الكحول وملح الحمض الكربوكسيلي في تفاعل يسمى التصبّن؛ حيث يشبه التفاعل المستخدم في صناعة الصابون.
وتمثل المعادلة الآتية تفكك إستر إيثانوات البروبيل عند تسخينه في الوسط القاعدي مكونا إيثانوات الصوديوم و 1- بروبانول:
وللحموض الكربوكسيلية تفاعلات استبدال أخرى منها:
تفاعل الحموض الكربوكسيلية مع الفلزّات النشطة مثل فلزّ الصوديوم؛ إذ ينتج عن التفاعل ملح الحمض الكربوكسيلي، ويتصاعد غاز الهيدروجين؛ كما توضّح المعادلة الآتية:
CH3COOH + Na CH3COO-Na+ + ½H2
تتفاعل الحموض الكربوكسيلية مع بعض الأملاح القاعدية، مثل كربونات الصوديوم Na2CO3 أو كربونات الصوديوم الهيدروجينية NaHCO3 ، ويتصاعد غاز CO2 ، ويستخدم هذا التفاعل للكشف عن الحموض الكربوكسيلية؛ إذ يميزها عن غيرها من المركبات العضوية،
والمعادلة الآتية مثال على ذلك:
2CH3CH2COOH + Na2CO3 2CH3CH2COO-Na+ + CO2 + H2O
الربط بالصناعة استخلص الإنسان منذ القدم  مسكنًا للألم من لُحاء شجر الصفصاف، إلى أن صُنع الأسبرين مسكنًا للألم من لُحاء شجر الصفصاف، إلى أن صُنع الأسبرينفأصبح يستخدم في أنحاء العالم كافة بوصفه مسكنًا للألم بوجه عام، حيث يحضر من خلال تفاعل الأسترة. |
إجابة سؤال أفكر: أصف كيف أميز مخبريّا بين كحول الإيثانولCH3CH2OH ، وحمض الإيثانويك ،CH3COOH وأكتب معادلة كيميائية للتفاعل الحاصل.
استخدم كربونات الصوديوم Na2CO3 أو كربونات الصوديوم الهيدروجينية NaHCO3 ، لتمييز الحمض الكربوكسيلي عن الكحول، إذ يتفاعل الحمض الكربوكسيلي مع هذه المركبات ويتصاعد غاز CO2، في حين أن الكحول لا يتفاعل ولا يتصاعد غاز CO2، والمعادلات الآتية توضح ذلك:
2CH3COOH + Na2CO3 2CH3COO-Na+ + CO2 + H2O
أو
CH3COOH + NaHCO3 CH3COO-Na+ + CO2 + H2O
2CH3CH2OH + Na2CO3
CH3CH2OH + NaHCO3
إجابة سؤال أتحقَّق: أكمل المعادلات الآتية:
1- أحدد الكحول والحمض الكربوكسيلي الذي تكَون منهما الإستر الآتي:
الحمض الكربوكسيلي: والكحول:
2- أكمل المعادلات الآتية:
1) CH3CH2CH2COOH + CH3OH
2) CH3COOCH2CH2CH2CH3 + NaOH
3) HCOOH + NaHCO3
1) CH3CH2CH2COOCH3 + H2O
2) CH3COONa + CH3CH2CH2CH2OH
3)HCOONa + CO2 + H2O
تفاعلات التأكسد والاختزال في المركبات العضوية Oxidation Reduction Reactions for Organic Compounds
كيف نميز تفاعل التأكسد وتفاعل الاختزال في المركبات العضوية؟
يصاحب تفاعل تأكسد المركبات العضوية زيادة في عدد ذرات الأكسجين، أو نقص في عدد ذرات الهيدروجين،
أما تفاعل الاختزال؛فيصاحبه نقص في عدد ذرات الأكسجين، أو زيادة في عدد ذرات الهيدروجين.
وستجري دراسة تفاعلات التأكسد أو الاختزال لكل من المركبات العضوية الآتية:
الكحولات، والألديهايدات، والكيتونات، والحموض الكربوكسيلية.
تأكسد الكحولات Oxidation of Alkohols
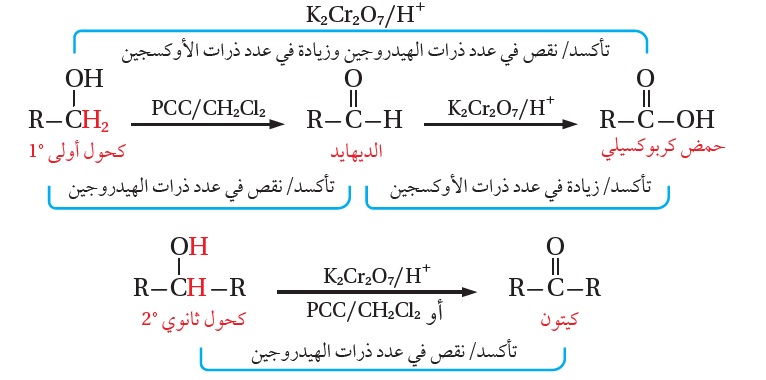
تعتمد نواتج تأكسد الكحولات على نوع الكحول الذي يتأكسد، حيث يتأكسد الكحول الأوليّ بوجود عامل مؤكسد مكوّنًا ألديهايدًا، يستمر تأكسده إلى حمض كربوكسيلي، ويعتمد ذلك على العامل المؤكسد المستخدم وظروف التفاعل.
فمثلً؛ يتأكسد 1-بروبانول CH3CH2CH2OH وباستخدام دايكرومات البوتاسيوم K2Cr2O7 عاملً مؤكسدًا قويًا في وسط حمضي إلى البروبانال CH3CH2CHO الذي يتأكسد مباشرة إلى حمض البروبانويك ؛CH3CH2COOH
وفق المعادلة الآتية التي تبين الناتج النهائي لتأكسد 1- بروبانول:
ألاحظ أن تأكسد الكحول الأولي 1-بروبانول وتحوله إلى الحمض الكربوكسيلي البروبانويك؛ 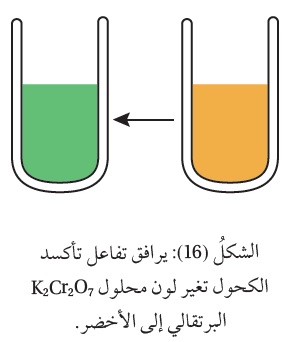
يصاحبه نقص في عدد ذرات الهيدروجين وزيادة في عدد ذرات الأكسجين .
ويرافق التفاعل تغير لون محلول دايكرومات البوتاسيوم البرتقالي إلى أخضر وهو لون أيونات ، أنظر الشكل ( 16 ).
ويستخدم العامل المؤكسد كلورو كرومات البيريدينيوم المذاب في ثنائي كلوروميثان PCC/CH2Cl2 وهو عامل مؤكسد ضعيف؛ للحصول على الألديهايد، فمثلا؛يتأكسد 1-بروبانول إلى البروبانال حسب المعادلة الآتية (ولا يتأكسد البروبانال):
ألاحظ أن تأكسد 1- بروبانول وتحوله إلى البروبانال صاحبه نقص في عدد ذرات الهيدروجين H؛
إذ حُذفت ذرة هيدروجين مجموعة الهيدروكسيل OH وذرة هيدروجين من ذرة الكربون المرتبطة بها، وتكونت رابطة ثنائية بين ذرتي الأكسجين والكربون.
ويتفاعل 3-ميثيل-1-بيوتانول مع العامل المؤكسد دايكرومات الصوديوم Na2Cr2O7 في وسط حمضي مكوّنًا حمض 3-ميثيل بيوتانويك(حمض كربوكسيلي) حسب المعادلة:
ولكن عند استخدام العامل المؤكسد PCC/CH2Cl2 ؛ فإن 3-ميثيل-1-بيوتانول يتأكسد مكوّنًا 3-ميثيل بيوتانال (الديهايد) حسب المعادلة:
يتأكسد الكحول الثانوي سواء باستخدام العامل المؤكسد دايكرومات البوتاسيوم +K2Cr2O7/H ، أو كلوروكرومات البيريدينيوم PCC/CH2Cl2 ، وينتج عن أكسدته الكيتون،
حيث يجري نزع ذرة هيدروجين مجموعة الهيدروكسيل OH ، وذرة هيدروجين من ذرة الكربون المرتبطة بها، وترتبط ذرتا الكربون والأكسجين برابطة ثنائية مكوّنةً مجموعة الكربونيل المميزة للكيتونات؛ كما هو موضح في الأمثلة الآتية:
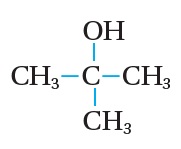
أما في الكحولات الثالثية؛ فإن ذرة الكربون المرتبطة بمجموعة الهيدروكسيل OH ، لا ترتبط بأي ذرة هيدروجين H، فلا يمكن نزع ذرتيّ H من المركب، لذلك؛ فإن الكحولات الثالثية لا تتأكسد عند الظروف نفسها.
فمثلاً؛ في الكحول الثالثي ميثيل-2-بروبانول؛ ألاحظ أن ذرة الكربون المرتبطة بمجموعة الهيدروكسيل لا ترتبط بأي ذرة هيدروجين، وبذلك لا يتأكسد.
ويمكن تلخيص أكسدة الكحولات بالمخطط الآتي:
إجابة سؤال أفكر:
A: C4H10O: CH3CH2CH2CH2OH
B: C4H8O2: CH3CH2CH2COOH
إجابة سؤال أتحقَّق: أكمل المعادلات الآتية:
أ)
1: CH3CH2CH2CHO 2: CH3COCH3
3: CH3(CH2)4COOH
ب)وذلك لأن ذرة الكربون المرتبطة بمجموعة الهيدروكسيلOH في الكحولات الثالثية لا ترتبط بأي ذرة هيدروجين H ،فلا يمكن نزع ذرتي H من المركب، لذلك؛ فإن الكحولات الثالثية لا تتأكسد باستخدام K2Cr2O7 في وسط حمضي.
تأكسد الألديهايدات Oxidation of Aldehydes
كيف تتأكسد الألديهايدات؟ وماذا ينتج عن تأكسدها؟
تتأكسد الألديهايدات باستخدام عامل مؤكسد مناسب مكوّنةً حموضًا كربوكسيلية،
فمثلاً؛ عند استخدام عامل مؤكسد قوي، مثل دايكرومات البوتاسيوم في وسط حمضي +K2Cr2O7/H ؛ فإن الإيثانال CH3CHO يتأكسد منتجًا حمض الإيثانويك CH3COOH ؛ حسب المعادلة الآتية:
CH3CHO CH3COOH
ويمكن كتابتها بصورة أخرى:
ألاحظ من المعادلة الكيميائية السابقة أن
تأكسد الألديهايد إلى حمض كربوكسيلي يرافقه زيادة في عدد ذرات الأكسجين.
أما الكيتونات؛ فإنها لا تتأكسد عند الظروف نفسها، وبناء على ذلك يستخدم تفاعل أكسدة الألديهايد للتمييز بين الألديهايدات والكيتونات.
ومن أمثلة ذلك؛ يستخدَم محلول تولينز، وهو عامل مؤكسد ضعيف في وسط قاعدي ، في التمييز بين الألديهايد والكيتون، 
حيث يتأكسد الألديهايد وتُختزَل أيونات الفضة +Ag من محلول تولينز، وتترسب على السطح الداخلي لوعاء التفاعل مكوّنةً مرآة فضيّة كما يوضح الشكل (17)، أما الكيتون فإنه لا يتأكسد.
وتمثل المعادلة الآتية تأكسد الإيثانال باستخدام محلول تولينز في وسط قاعدي:
CH3CHO CH3COO- + Ag (راسب على شكل مرآة فضية)
أما الكيتونات فلا تتأكسد باستخدام محلول تولينز.
R -CO-R"
ويستخدام محلول فهلنج؛ وهو عامل مؤكسد ضعيف -أيضا- للتمييز بين الألديهايد والكيتون،
يتكون محلول فهلنج من محلول قاعدي يحتوي أيونات النحاس +Cu2 .
يسخُن الألديهايد مع محلول فهلنج؛ فيتأكسد في الوسط القاعدي إلى أيون
الحمض الكربوكسيلي - RCOO، وتختزل أيونات النحاس +Cu2 ، إلى +Cu ، وتترسب على شكل راسب بُنيّ محمرّ من أكسيد النحاس(Cu2O (I ، مثلاً؛ يتأكسد الإيثانال حسب المعادلة:
CH3CHO CH3COO- + Cu2O (راسب بني محمر)
أما الكيتونات فلا تتأكسد باستخدام محلول فهلنج.
إجابة سؤال أتحقَّق: أكمل المعادلات الآتية:
1- أكتب معادلة تأكسد البيوتانال CH3CH2CH2CHOباستخدام محلول دايكرومات البوتاسيوم الحمضي+K2Cr2O7/H .
2- أصف كيف أميز مخبريًا بين البروبانال CH3CH2CHO والبروبانون CH3COCH3 وأكتب معادلات كيميائية توضح ذلك.
يتأكسد البروبانال باستخدام محلول تولنز ، وتُختزَل أيونات الفضة +Ag من محلول تولينز، وتترسب على السطح الداخلي لوعاء التفاعل مكوّنةً مرآة فضيّة ، أما البروبانون فإنه لا يتأكسد. والمعادلة الآتية توضح ذلك:
ويمكن استخدام محلول فهلنج؛ فيتأكسد البروبانال، وتختزل أيونات النحاس +Cu2 ، إلى +Cu ، وتترسب على شكل راسب بُنيّ محمرّ من أكسيد النحاس(Cu2O (I، أما البروبانون فلا يتأكسد
اختزال الألكينات والألكاينات Reduction of Alkenes and Alkynes
يعدّ تفاعل إضافة الهيدروجين إلى الرابطة الثنائية في الألكينات والرابطة الثلاثية في الألكاينات بوجود البلاتين Pt أو النيكل Ni -عاملً مساعدًا- اختزالاً؛ إذ يصاحبه زيادة في عدد ذرات الهيدروجين في كل منهما، كما توضح المعادلات الآتية:
CH2=CH2 + H2 CH3-CH3
CH3-C≡CH + 2H2 CH3CH2CH3
إجابة سؤال أتحقَّق: أكمل المعادلات الآتية:
CH3CH=CHCH3 CH3CH2CH2CH3
اختزال الألديهايدات والكيتونات Reduction of Aldehydes and Ketones
تعلّمتُ أن تأكسد الكحول الأوليّ ينتج ألديهايدًا، وأن تأكسد الكحول الثانوي يكوّن كيتونًا.
ويمكن اختزال كل من الألديهايد والكيتون لتكوين كحول أولي وكحول ثانوي على الترتيب بطريقتين هما:
إضافة الهيدروجين في وجود عامل مساعد، مثل النيكل Ni أو البلاتين Pt ؛
إذ يعمل العامل المساعد على إضعاف الرابطة بين ذرتي الهيدروجين؛ فيسهل إضافتهما إلى الرابطة الثنائية في مجموعة الكربونيل، كما توضح المعادلة الآتية:
ألاحظ أن إضافة الهيدروجين إلى الإيثانال CH3CHO صاحبتهُ زيادة في عدد ذرات الهيدروجين، أي اختزال الإيثانال؛ إذ كسرت الرابطة π بين ذرتي الكربون والأكسجين في مجموعة الكربونيل، وأضيفت ذرتا هيدروجين H إلى كلّ من ذرة الكربون وذرة الأكسجين، ونتج كحول الإيثانول CH3CH2OH ، وهو كحول أوليّ.
وتختزل الألديهايدات والكيتونات -أيضًا- باستخدام عوامل مختزلة، مثل هيدريد الليثيوم والألمنيوم LiAlH4 ، المذاب في الإيثر الجاف (Et)، أو بوروهيدريد الصوديوم NaBH4 ، المذاب في الإيثانول. ويعدّ العاملان المختزلان كلاهما مصدرًا لأيونات الهيدريد -H؛ إذ يرتبط أيون -H بذرة كربون مجموعة الكربونيل التي تحمل شحنةً جزئيّةً موجبةً، ثم يضاف
إلى التفاعل محلول مخفف من حمض مثل H2SO4 ؛ فينتج الكحول، والمعادلات الآتية توضح ناتج التفاعل:
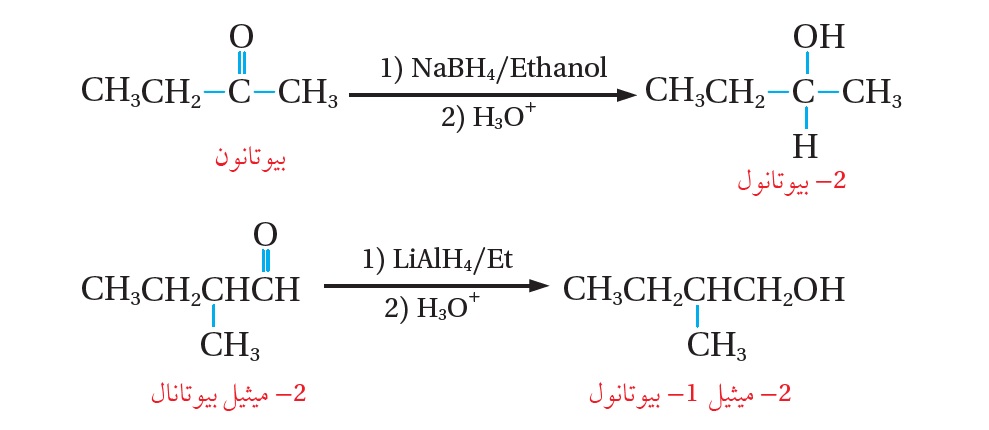
ألاحظ أن اختزال البيوتانون (كيتون) أدى إلى تكوّن 2-بيوتانول؛ وهو كحول ثانوي،
وكذلك اختُزِل 2- ميثيل بيوتانال(ألديهايد) أدى إلى تكوّن 2-ميثيل -1-بيوتانول؛ وهو كحول أولي،
وصاحب ذلك زيادة في محتوى المركب من الهيدروجين في المركبين الناتجين.
عمليا يتم التعامل بحذر شديد جدًا مع العامل المختزل LiAlH4 ؛ إذ أنه شديد التفاعل مع الماء لذلك يذاب في الإيثر الجاف، ولا يضاف+H3O إلى التفاعل إلا بعد انتهاء تفاعله مع الألديهايد أو الكيتون، أو الحمض الكربوكسيلي، كما سيرد لاحقًا.
|
الربط بالحياة: يكوّن الإيثانال مبلمرات بسيطة منها؛ مبلمر مكون من ثلاثة مونومرات CH3CHO)3)، ويستخدم |
إجابة سؤال أفكر:أفسر: تُختَزل الكيتونات إلى كحولات ثانوية وليست أولية.
لأن مجموعة الكربونيل في الكيتون ترتبط بمجموعتي الكيل R-CO-R وليست طرفية
إجابة سؤال أتحقَّق: أكمل المعادلات الآتية:
اختزال الحموض الكربوكسيلية Reduction of Carboxylic Acids
تحتوي مجموعة الكربوكسيل المميزة للحموض الكربوكسيلية على مجموعة كربونيل قابلة للاختزال كما في الألدهيدات والكيتونات لذلك يُختزل الحمض الكربوكسيلي باستخدام عامل مختزل قوي؛ هو هيدريد الليثيوم والألمنيوم LiAlH4 المذاب في الايثر الجاف، ولا يختزل باستخدام العامل NaBH4 لأنه أقل قوةويَنتج ألديهايد يٌختزَل فَوْرَ تكونه إلى كحول أولي، وتكتب المعادلة العامة كالآتي:
ألاحظ أن اختزال الحمض الكربوكسيلي يرافقه زيادة في عدد ذرات الهيدروجين ونقص في عدد ذرات الأكسجين.
فمثلا يختزل حمض الإيثانويك مكونا الإيثانول وفق المعادلة الآتية:
ويختزل حمض ميثيل بروبانويك إلى كحول ميثيل-1-بروبانول؛ كما توضح المعادلة الآتية:
إجابة سؤال أتحقَّق: أكمل المعادلة الآتية:
|
حمض الأستيك أو حمض الإيثانويك CH3COOH ؛ هو المكون للخلّ، ويُستخدم ما يقارب ثلث إجمالي حمض الأستيك المنتج صناعيًّا في جميع أنحاء العالم في إنتاج أسيتات الفينيل CH3COOCH=CH2،وهو مركب يستخدم مونومرًا لإنتاج مبلمر بولي فينيل أسيتات PVA المكون لأصماغ الخشب. ويستخدم حمض الأسيتيك -أيضًا- في إنتاج إسترات مختلفة منها؛ أسيتات السليلوز، حيث تستخدم لصناعة الأفلام الفوتوغرافية، ويمكن استخدامه -أيضًا-في تحضير بعض الأدوية مثل الأسبرين في المنزل غالبًا ما يستخدم حمض الأستيك منظفًا منزليًّا، إذ يدخل في تكوين مزيلات التكلُّس. وقد ثبت -أيضًا- أن حمض الأستيك له خصائص مضادة للبكتيريا والفطريات حتى عند تخفيفه، لذلك استخدم لتطهير الجروح ومنظّفًا للأسطح في المطابخ.حمض الأستيك أو حمض الإيثانوك CH3COOH ؛ هو المكون للخلّ، ينتج حمض الأستيك صناعيًا من |
 دواءً مُنوّمًا. أيضًا مبلمر مكون من أربعة مونومرات4(CH3CHO)حيث يستخدم وقودًا صُلبًا لمواقد التخييم.
دواءً مُنوّمًا. أيضًا مبلمر مكون من أربعة مونومرات4(CH3CHO)حيث يستخدم وقودًا صُلبًا لمواقد التخييم.