- المفاهيم والمصطلحات :
عزيزي الطالب ستتعرف في هذا الدرس على هذه المفاهيم والمصطلحات العلمية :
|
الطاقة |
Energy |
|
المحتوى الحراري |
Enthalpy |
|
تفاعلات طاردة للحرارة |
Exothermic Reactions |
|
تفاعلات ماصة للحرارة |
Endothermic Reactions |
|
الإنصهار |
Fusion |
|
التبخر |
Evaporation |
|
التجمد |
Freezing |
|
التكاثف |
Condensation |
|
التسامي |
Sublimation |
|
طاقة الإنصهار المولية |
Molar Fusion Energy |
|
طاقة التبخر المولية |
Evaporation Molar Energy |
الطاقة المرافقة للتفاعل (Energy Accompaniment the Chemical Reaction) :
- يرافق حدوث الكثير من التفاعلات الكيميائية إنبعاث كميات من الطاقة الناتجة مثل:
- الطاقة الناتجة من إحتراق الوقود ( غاز الطبخ ، إحتراق الفحم وغيرها )
- في بعض الأحيان تحتاج بعض التفاعلات إلى إمتصاص الطاقة حتى تحدث مثل:
- طهو الطعام وتفاعلات البناء الضوئي وغيرها
- لذلك يهتم الكيميائيون بدراسة التغيرات في الطاقة التي ترافق هذه العمليات والتفاعلات.
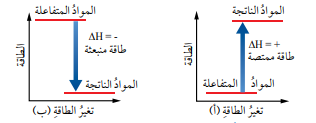
- التغير في المحتوى الحراري (الإنثالبي) ( Change in Enthalpy)
- المحتوى الحراري (Enthalpy)
- تعريفه : هو كمية الطاقة المخزونة في مول من المادة ويرمز له بالرمز H
- يطلق على كمية الطاقة الممتصة أو المنبعثة خلال التفاعل بـ (التغير في المحتوى الحراري )
- تكون إشارة HΔ (-) سالبة إذا كانت الطاقة منبعثة
- تكون إشارة HΔ (+) موجبة إذا كانت الطاقة ممتصة
- الشكل الأتي يمثل مخطط تغير المحتوى الحراري للتفاعل :
- ملاحظة :
يعتمد التغير في المحتوى الحراري (HΔ) على الحالة النهائية والحالة البدائية للتفاعل ولا يعتمد التغير في المحتوى الحراري (HΔ) على الطريقة التي يحدث بها التفاعل .
- الشكل الأتي يبين مخطط التغير في المحتوى الحراري (HΔ) لتفاعل طارد وأخر ماص للطاقة :
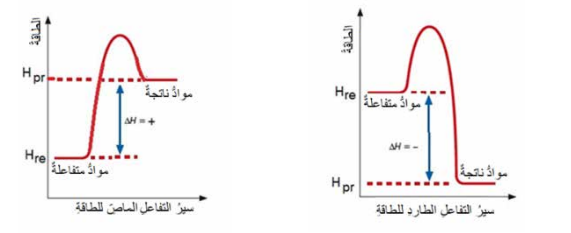
- التغير في المحتوى الحراري يمثل الفرق بين المحتوى الحراري للمواد الناتجة (HPr) والمحتوى الحراري للمواد المتفاعلة (Hre).
- يمكن حساب التغير في المحتوى الحراري بإستخدام العلاقة الأتية :
التغير في المحتوى الحراري = المحتوى الحراري للمواد الناتجة – التغير في المحتوى الحراري للمواد المتفاعلة
بالرموز :
- يقاس التغير في المحتوى الحراري بوحدة ( الكيلو جول / مول ) (K J /mol)
- تفاعلات طاردة للحرارة ( Exothermic Reaction)
- يكون التغير في المحتوى الحراري للتفاعل (HΔ) (-) سالب
- حيث يكون : المحتوى الحراري للمواد الناتجة (HPr) أقل من المحتوى الحراري للمواد المتفاعلة (Hre)
- أمثلة على هذا النوع من التفاعلات :
- تنتقل الطاقة في الكثير من التفاعلات من المواد المتفاعلة إلى الوسط المحيط مثل :
أ) تفاعلات إحتراق الوقود ( إحتراق الوقود في المدفأة ) : حيث تنبعث عنه طاقة حرارية تؤدي إلى رفع درجة حرارة الوسط المحيط بحيث يشعر الأشخاص المحيطون بالمدفأة بالدفءِ
ب) تفاعلات التعادل التي تحصل بين الحمض والقاعدة
جـ) إحتراق سكر الجلوكوز في الخلايا ليزودها بالطاقة اللازمة لأداء العمليات الحيوية
د) تفاعل شريط المغنيسيوم (Mg) مع حمض الهيدروكلوريك (HCl) مما يؤدي لرفع درجة حرارة المحلول وهذا يعني أن التفاعل طارد للحرارة بحيث تنطلق الطاقة الحرارية من التفاعل وتتسبب في رفع درجة حرارة المحلول وهذه الطاقة تمثل التغير في المحتوى الحراري (ΔH) والشكل الأتي يمثل التفاعل الحاصل :
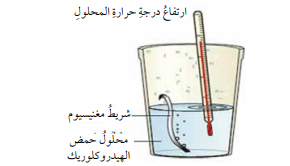
- يمكن التعبير عن التفاعل الحاصل بالمعادلة الحرارية الأتية :
ملاحظة :
- يستفاد من الحرارة (Heat) المنبعثة من التفاعلات الطاردة للطاقة في مختلف مناحي الحياة مثل :
أ) عمليات طهو الطعام ب) التسخين جـ) تشغيل المركبات والآلات الصناعية
سؤال (1) :
كيف يتم إنتقال الحرارة من المدفأة إلى الأشخاص المحيطين بها ؟
الإجابة:
تنتقل الحرارة من المدفأة إلى الأشخاص المحيطين بها عن طريق الحمل والإشعاع .
سؤال (2) :
علل:
يعد تفاعل الثيرمايت الذي يستخدم في لحام قضبان السكك الحديدية، طاردًا للحرارة بالرغم من أنه يتطلب تزويده بكميات كبيرة من الحرارة لبدء التفاعل:
الإجابة :
لأن كمية الحرارة الناتجة من التفاعل أكبر بكثير من كمية الحرارة الممتصة اللازمة لبدء التفاعل
- تفاعلات ماصة للحرارة ( Endothermic Reaction)
- يكون التغير في المحتوى الحراري للتفاعل (HΔ) (+) موجب
- حيث يكون : المحتوى الحراري للمواد الناتجة (HPr) أكبر من المحتوى الحراري للمواد المتفاعلة (Hre)
- تحتاج بعض التفاعلات إلى كمية من الطاقة للتغلب على الروابط بين ذرات المواد المتفاعلة، فتمتص هذه المواد الطاقة من الوسط المحيط مما يسبب إنخفاضًا في درجة حرارة الوسط .
- أمثلة على هذا النوع من التفاعلات :
أ) تفاعلات التحلل الحراري مثل ( تحلل كربونات الكالسيوم (CaCO3) من خلال إمتصاص كمية من الطاقة لكسر الروابط بين الذرات وتحلل المادة
ب) تفاعل البناء الضوئي الذي يحصل في النبات حيث يمتص الطاقة اللازمة لحدوثه من ضوء الشمس
جـ) عند إضافة كربونات الصوديوم الهيدروجينية (NaHCO3) إلى محلول حمض الهيدروكلوريك (HCl) سنلاحظ إنخفاض في درجة حرارة المحلول؛ الأمر الذي يعني أن التفاعل إمتص الطاقة من المحلول وتسبب في إنخفاض درجة حرارة المحلول وهذه الطاقة تمثل التغير في المحتوى الحراري(HΔ) والشكل الأتي يمثل التفاعل الحاصل :
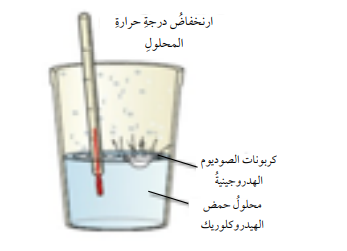
- يمكن التعبير عن التفاعل الحاصل بالمعادلة الحرارية الأتية :
سؤال :
1) أي التفاعلات الأتية يعد ماصًا للطاقة و أيهما يعد طاردًا لها :
الإجابة:
أ) يعد تفاعلًا طاردًا للطاقة ب) يعد تفاعلًا ماصًا للطاقة
2) ماذا تمثل الطاقة في كل من التفاعلين السابقين؟ وما إشارتها ؟
الإجابة:
تمثل الطاقة التغير في المحتوى الحراري (HΔ) وتكون إشارته في التفاعل (أ) هي سالبة وفي التفاعل (ب) هي الموجبة
- التجربة (1) : التفاعل الطارد والتفاعل الماص للطاقة
- المواد والأدوات المستخدمة :
- ثلاث كؤوس زجاجية
- ميزان حرارة
- ملعقة
- ميزان حساس
- قضيب زجاجي
- مخبار مدرج
- محلول حمض الهيدروكلوريك (HCl) تركيزه (0.5mol/L)
- هيدروكسيد الصوديوم (NaOH) تركيزه (0.5mol/L)
- بلورات كلوريد الأمونيوم (NH4Cl)
- شريط من المغنيسيوم (2cm)
- ماء مقطر
- خطوات العمل :
- أضع في الكأس الزجاجية الأولى (20 ml) من محلول حمض الهيدروكلوريك بإستخدام المخبار المدرج، وأقيس درجة حرارة المحلول في الكأس، وأسجلها.
- أضيف شريط المغنيسيوم طوله (2cm) وأحرك المحلول ببطءِ، وأقيس درجة حرارته وأسجلها.
- نلاحظ التغير في درجة الحرارة المحلول بعد إضافة شريط المغنيسيوم.
- أضع في الكأس الزجاجية الثانية (20 ml) من الماء المقطر بإستخدام المخبار المدرج، وأقيس درجة حرارة الماء في الكأس، وأسجلها.
- أزن بإستخدام الميزان الحساس (5g) من كلوريد الأمونيوم، وأضيفها إلى الكأس الثاني وأحرك المحلول ببطء وأقيس درجة حرارة المحلول، وأسجلها.
- نلاحظ التغير في درجة الحرارة الماء بعد إضافة كلوريد الأمونيوم .
- أضع في الكأس الزجاجية الثالثة (20 ml) من محلول حمض الهيدروكلوريك بإستخدام المخبار المدرج، وأقيس درجة حرارته، وأسجلها.
- أُضيف إلى الكأس الثالثة (20 ml) من محلول هيدروكسيد الصوديوم، وأحرك المحلول ببطء وأقيس درجة حرارته، وأسجلها.
- نلاحظ التغير في درجة الحرارة المحلول بعد إضافة هيدروكسيد الصوديوم .
- أنظف مكان عملي وأغسل يديّ جيدًا بعد الإنتهاء من العمل
- الهدف من التجربة :
تمييز التفاعلات الطاردة والماصة للطاقة
- التحليل والإستنتاج:
1. أصف التغير الذي يحدث لدرجة حرارة محلول حمض الهيدروكلوريك بعد تفاعله مع شريط المغنيسيوم، ماذا أستنتج؟
2. أصف التغير لدررجة حرارة الماء بعد تفاعله مع كلوريد الأمونيوم، ماذا أستنتج؟
3.أصف التغير الذي يحدث لدرجة حرارة محلول حمض الهيدروكلوريك بعد إضافة هيدروكسيد الصوديوم ، ماذا أستنتج؟
- الملاحظات على التجربة :
1) تؤدي إضافة شريط المغنيسيوم إلى محلول حمض الهيدروكلوريك :
- إرتفاع درجة حرارة المحلول ، أستنتج من ذلك أن التفاعل طارد للطاقة
2) تؤدي إضافة كلوريد الأمونيوم إلى الماء :
- إنخفاض درجة حرارة المحلول ، أستنتج من ذلك أن التفاعل ماص للطاقة
3) تؤدي إضافة هيدروكسيد الصوديوم إلى محلول حمض الهيدروكلوريك :
- إرتفاع درجة حرارة المحلول ، أستنتج من ذلك أن التفاعل طارد للطاقة وهذا هو السبب الذي أدى لرفع درجة حرارة المحلول الناتج
4) في الحالتين الأولى والثالثة : تنتقل الحرارة من الوسط إلى المحيط، مما يسبب إرتفاعًا في درجة حرارة المحلول الناتج في الحالتين .
في الحالة الثانية ( في حالة إضافة كلوريد الأمونيوم إلى الماء ) فإن الإنخفاض في درجة المحلول يعود إلى أن التفاعل يحصل على الطاقة اللازمة لحدوثه من الماء؛ مما سبب في إنخفاض درجة حرارته مما يعني أن الحرارة إنتقلت من الوسط المحيط إلى التفاعل.
- الطاقة والحالة الفيزيائية للمادة : ( Energy and Physical State of Matter)
- توجد المادة في حالات فيزيائية ثلاث وهي :
أ) الحالة الصلبة ب) الحالة السائلة جـ) الحالة الغازية
- كل حالة من الحالات الفيزيائية للمادة لها خصائص معينة تعتمد على طبيعة المادة والروابط بين جسيماتها.
- من الممكن أن تتحول المادة من الحالة الفيزيائية إلى حالة أخرى مثلاً:
أ) من الممكن أن تتحول الغازات إلى سوائل بالضغط والتبريد
ب) من الممكن تحويل المادة الصلبة إلى سائلة بالتسخين
- يشير هذا إلى أنه يرافق تحول المادة من الحالة فيزيائية إلى أخرى تغيرات في الطاقة وقد يكون هذا التحول ماصًا للطاقة أو طاردًا لها، والشكل الأتي يمثل تغيرات الطاقة المصاحبة للتحولات الفيزيائية للمادة :
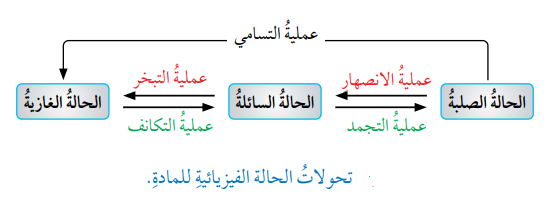
- الإنصهار : (Fusion)
- تعريفه : هو عملية تحول المادة من الحالة الصلبة إلى الحالة السائلة .
- متطلباته : تزويد المادة بكمية كافية من الطاقة الحرارية، للتغلب على الترابط بين جزيئات المادة أو ذراتها.
- نوع العملية : الإنصهار هو عملية ماصة للطاقة.
- مثال :
- يمتص الجليد طاقة حرارية من الوسط المحيط ليتحول إلى ماء سائل، وهو ما يفسر الشعور ببرودة الجو نتيجة إنخفاض درجة حرارته، بسبب إنصهار الثلج في أيام الشتاء وتعتمد كمية الطاقة اللازمة للإنصهار على كمية الجليد.
- تسمى الطاقة اللازمة لتحويل مول من الجليد عند درجة حرارة ثابتة إلى الحالة السائلة بـ : (طاقة الإنصهار المولية )(Molar Fusion Energy) .
- لكل مادة طاقة إنصهار خاصة بها، مثلاً: طاقة الإنصهار المولية للجليد تساوي (6.01 KJ) ويمكن التعبير عنها بالمعادلة الكيميائية الأتية :
- التبخر : (Evaporation)
- تعريفه : هو عملية تحول المادة من الحالة السائلة إلى الحالة الغازية، حيث تصبح جزيئات المادة أو ذراتها أكثر قدرة على الحركة
- متطلباته : تزويد المادة بكمية من الطاقة الحرارية التي تعمل على تحرير الجزيئات أو الذرات من قوى الترابط بينها في الحالة السائلة.
- نوع العملية : التبخر هو عملية ماصة للطاقة؛ حيث تستمد المادة الطاقة اللازمة من الوسط المحيط بها
- مثال :
- الشعور بالبرد أو القشعريرة بعد الإستحمام، حيث يتبخر الماء عن سطح الجسم الجسم مستمدًا الطاقة الحرارية اللازمة من الجلد
- تسمى الطاقة اللازمة لتبخير مول من المادة عند درجة حرارة معينة بـ :(طاقة التبخر المولية )(Molar Evaporation Energy ) .
لكل مادة طاقة تبخر خاصة بها، مثلاً: طاقة التبخر المولية للماء تساوي( 40.7K J ) ويمكن التعبير عنها بالمعادلة الكيميائية الأتية :
- التجمد : (Freezing)
- تعريفه : هو عملية تحول المادة من الحالة السائلة إلى الحالة الصلبة؛ مما يقلل من حرية حركة الجزيئات أو الذرات، ويزيد من تجاذبها وتماسكها، وهذا يتم من خلال تبريد المادة بواسطة خفض درجة حرارتها.
- متطلباته : فقدان المادة إلى كمية من الطاقة
- نوع العملية : التجمد هو عملية طاردة للطاقة
- ملاحظة : كمية الطاقة الناتجة من تجمد مول من المادة عند درجة حرارة معينة تساوي الطاقة اللازمة لصهرها عند درجة الحرارة نفسها .
- مثال :
- يتجمد الماء ويتحول إلى جليد عند درجة صفر سيليسيوس وفي الوقت نفسه ينصهر الجليد ويتحول إلى الماء السائل عند درجة الحرارة نفسها
- تسمى الطاقة اللازمة لتجميد مول من الماء وتحويله إلى جليد تنطلق نتيجة لذلك طاقة تسمى بـ :(طاقة التجمد المولية )(Molar Freezing Energy )
- مثلاً: طاقة التجمد المولية للماء تساوي (6.01 KJ)
- التكاثف : (Condensation)
- تعريفه : هو عملية تحول المادة من الحالة الغازية إلى الحالة السائلة؛ عند زيادة الضغط المؤثر عليه وخفض درجة حرارته، مما يتيح تقارب جزيئات الغاز من بعضها بالقدر الذي يسمح بتجاذبها وتحولها لسائل
- متطلباته : فقدان المادة إلى كمية من الطاقة
- نوع العملية : التكاثف هو عملية طاردة للطاقة.
- تسمى كمية الطاقة المنبعثة عند تكاثف مول من الغاز عند درجة الغليان بــ : ( طاقة التكاثف المولية ) (Molar Condensation Energy )
- ملاحظة : إن طاقة التكاثف المولية تساوي طاقة التبخر المولية
- التسامي : (Sublimation)
- تعريفه : هو عملية تحول المادة من الحالة الصلبة إلى الحالة الغازية دون المرور بالحالة السائلة .
- متطلباته : تزويد المادة بالطاقة اللازمة لتكسير الروابط بين جزيئاتها أو ذراتها، ويصبح التجاذب بينها ضعيفًا جدًا فتتحول للحالة الغازية.
- نوع العملية : التكاثف هو عملية ماصة للطاقة.
مثال:
إن تسامي مول من الجليد يتطلب تزويده بمقدار من الطاقة يساوي (46.71 KJ) وكمية هذه الطاقة تساوي مجموع كمية الطاقة اللازمة في ما لو جرى تحويله إلى الحالة السائلة ثم إلى الحالة الغازية والشكل الأتي يمثل تغيرات الطاقة المصاحبة لتحولات الماء في الحالات الثلاث:
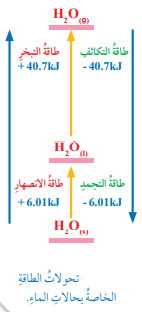
سؤال :
أي التحولات الفيزيائية الأتية يرافقه إنبعاث للحرارة ؟ وأيها يرافقه إمتصاص لها :
1) جفاف الملابس بعد غسلها ونشرها وتعريضها لأشعة الشمس.
2) إنصهار الكتل الجليدية أيام الربيع في المناطق الشمالية من الكرة الأرضية.
3) تكوّن الصقيع (الجليد) في ليالي الشتاء الباردةِ.
الحل :
1) تمتص جزيئات الماء المتشربة داخل الملابس الطاقة الشمسية (الحرارية )؛ مما يسبب تبخرها ومغادرتها للملابس ومن ثم جفافها .
2) عند سقوط أشعة الشمس على الكتل الجليدية فإنها تمتص الطاقة الشمسية (الحرارية)، مما يسبب إنصهارها.
3) في ليالي الشتاء الباردة عند إنخفاض درجات الحرارة إلى ما دون الصفر السيليزي، تبرد اليابسة بسرعة أكبر من الماء الموجود عليها وتنخفض درجة حرارتها، بينما يفقد الماء الحرارة بسرعة أقل وتبقى درجة حرارته أعلى من اليابسة، مما يسبب إنتقال الحرارة من الماء إلى اليابسة وتنخفض درجة حرارته إلى حد كافِ للتجمد وتكون الصقيع
- الربط مع الحياةِ : الكمادات الباردة والساخنة
- أستُفيد من التفاعلات الماصة والطاردة للحرارة في صناعة ما يسمى بـ الكمادات الفورية
- تستخدم الكمادات الفورية في تخفيف من الآلام الناتجة من هذه الإصابات
- مكونات الكمادات الفورية :
* كيس بلاستيكي يحتوي على مادة كيميائية بالإضافة إلى كيس صغير من الماء
** عند الضغط على الكمادة ينفجر كيس الماء بداخلها ويختلط بالمادة الكيميائية ويعمل على إذابتها
*** يرافق ذلك إنبعاث طاقة حرارية ترفع درجة حرارة المحلول وتتكون الكمادة الساخنة
ملاحظة :
- يستخدم عادةً كلوريد الكالسيوم أو كبريتات المغنيسيوم في هذه الكمادات.
- قد يستخدم في الكمادة مادة نترات الأمونيوم التي تؤدي إذابتها في الماء إلى إمتصاص طاقة طاقة حرارية من الوسط، ويؤدي إلى إنخفاض درجة حرارة المحلول وتتكون الكمادة الباردة،
- وبذلك : يمكن إستخدام النوع المناسب من الكمادات ضمن عمليات الإسعاف الأولية التي يقدمها الإختصاصيون المرافقون للفريق أثناء المباريات .