طرائق تحضير المركبات العضوية Methods of Preparing Organic Compounds
ما الطرق المتبعة في تحضير المركبات العضوية؟ وما ظروف تحضير بعض منها؟
تنتج ملايين المركبات العضوية سنويًا، ولكل منها استخداماته وأهميته على المستوى الصناعي وفي الحياة اليومية؛ فقد أنعم الله على خلقه بكثير من النعم، وجعل لكل من النباتات وثمارها طعمًا ورائحة مميزين؛ إذ تعود إلى أنواع المركبات العضوية التي توجد فيها، مثل الإسترات، والألديهايدات، وغيرها من المركبات العضوية التي تعرف بالنكهات الطبيعية، وقد تمكن الباحثون من استخلاص كثير من هذه المواد ودراستها والتعرف إلى مكوناتها وخصائصها؛ مما ساعد على
أنعم الله على خلقه بكثير من النعم، وجعل لكل من النباتات وثمارها طعمًا ورائحة مميزين؛ إذ تعود إلى أنواع المركبات العضوية التي توجد فيها، مثل الإسترات، والألديهايدات، وغيرها من المركبات العضوية التي تعرف بالنكهات الطبيعية، وقد تمكن الباحثون من استخلاص كثير من هذه المواد ودراستها والتعرف إلى مكوناتها وخصائصها؛ مما ساعد على
تصنيع مواد مشابهة عرفت بالنكهات الصناعية، حيث تستخدم في صناعة المواد الغذائية وأنواع العصائر المختلفة.
وتسهم الصناعات القائمة على المركبات العضوية وتفاعلاتها في النمو الاقتصادي في عدد من الدول؛ إذ تدخل في صناعة الوقود، والمستحضرات الصيدلانية، ومواد التجميل، والصناعات الزراعية، ولذلك يهتم الكيميائيون المختصون في الكيمياء العضوية بدراسة المركبات العضوية وطرائق تحضيرها والصناعات القائمة عليها أنظر الشكل(18).
تحضير الألكانات Preparation of Alkanes
كيف يتم الحصول على الألكانات؟
تُستخلص الألكانات بشكل رئيس بعملية التقطير التجزيئي للنفط والغاز الطبيعي،
كما يمكن تحضيرها بالتكسير الحراري أو إضافة الهيدروجين إلى الألكين.
إنتاج الألكانات بالتكسير الحراري: Produce Alkanes by cracking
يُسخّن خليط النفط إلى درجات حرارة عالية في أبراج ضخمة، أنظر الشكل(19)؛
فتتكسر سلاسل المركبات الهيدروكربونية الطويلة إلى مركبات أصغر في ما يعرف بعملية التكسير الحراري Thermal Cracking تؤدي إلى تكوين خليط غازيّ من الألكانات والألكينات؛ يتراوح عدد ذرات الكربون في مركباتها (2- 10) ، وتُفصل مكونات هذا الخليط عن طريق عملية التقطير التجزيئي، بالاعتماد على تفاوت درجات غليانها،
|
الربط مع الصناعة: هدرجة الزيوت Hydrogenation of Oils |
فمثلاً؛ عند إجراء تكسير للمركب C8H18 ؛ فإن الجزيء الواحد يتكسر بحيث يكون مجموع عدد ذرات الكربون في الألكان والألكين الناتجين عن تكسيره مساوياً لعدد ذرات الكربون فيه.
تحضير الألكانات من الألكينات Preparation of Alkanes from Alkenes
يحضر الألكان بإضافة الهيدروجين H2 إلى الألكين فيما يعرف بعملية الهدرجة التي تستخدم في هدرجة الزيوت صناعياً إلى دهون مشبعة. حيث يتم إضافة الهيدروجين H2 إلى الألكين؛ بوجود عامل مساعد، مثل النيكل Ni أو البلاتين Pt ، فمثلاً؛ يُحضّر الإيثان بإضافة غاز الهيدروجين إلى الإيثين عند درجة حرارة
CH2=CH2 + H2
إجابة سؤال أتحقَّق:
أكتب معادلة كيميائية توضح تحضير البروبان CH3CH2CH3؛باستخدام البروبين CH2=CHCH3
CH2=CHCH3 + H2
تحضير الألكينات Preparation of Alkenes
كيف تُحضر الألكينات؟ وما الطرقة المستخدمة لتحضيرها؟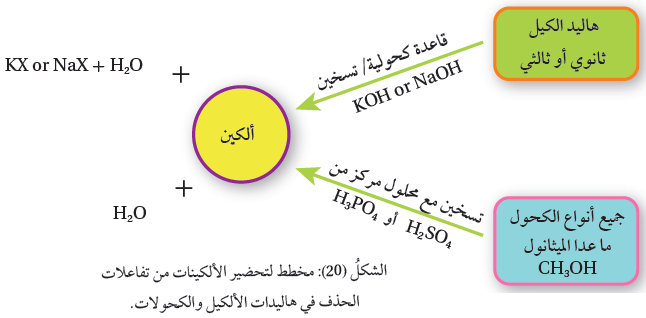
تنتج الألكينات صناعياً بالتكسير الحراري للألكانات.
وتحضر مخبرياً باستخدام تفاعلات الحذف في كلّ من هاليدات الألكيل RX، أو الكحولاتROH ، أنظر الشكل (20).
إنتاج الألكينات بالتكسير الحراري Produce Alkenes by Cracking
عرفتُ في ما سبق أن تكسير السلاسل الكربونية الطويلة للألكانات يؤدي إلى إنتاج خليط غازي من الألكانات والألكينات. حيث تفصل المكونات بالاعتماد على درجة غليان كل منها.
فمثلاً؛ عند تكسير سلسلة من الديكان C10H22 ، ينتج خليط من الأوكتان والإيثين، والهبتان والبروبين وغيرهما.
تحضير الألكينات من هاليدات الألكيل
Preparation of Alkenes from Alkyl Halides
يحضر الألكين مخبريا بتسخين هاليد الألكيل الثانوي أو الثالثي مع محلول مركّز من أيونات الهيدروكسيد (-OH )، الناتجة من محلول هيدروكسيد الصوديوم ،NaOH المذاب في الإيثانول، أو هيدروكسيد البوتاسيوم KOH ، المذاب في الإيثانول.
مثال(1): يحضر البروبين CH3CH=CH2 ، من تسخين 2-برومو بروبانCH3CHBrCH3 مع محلول مركز من هيدروكسيد الصوديوم NaOH الكحولي. أكتب معادلة كيميائية تبيّن تحضير البروبين.
الحلّ:
CH3CHBrCH3 + NaOH كحولي
تحضير الألكينات من الكحولات Preparation of Alkenes from Alcohols
يحضر الألكين بتسخين الكحول مع محلول مركز من حمض الكبريتيك H2SO4 ، أو محلول مركز من حمض الفسفوريك H3PO4 ، إذ ينزع جزيء ماء H2O ، من الكحول في أثناء التفاعل وينتج الألكين.
مثال (2):
أكتب معادلة تحضير الإيثين الناتج عن تسخين الإيثانول CH3CH2OH ؛ مع محلول مركز من حمض الكبريتيكH2SO4
الحلّ:
CH3CH2OH
إجابة سؤال أتحقَّق:
1 - أكتب معادلة كيميائية تبين تحضير 2-بيوتينCH3CH=CHCH3، باستخدام 2-برومو بيوتان CH3CHBrCH2CH3 ،
ومحلول مركز من هيدروكسيد البوتاسيوم KOH الكحولي.
CH3CHBrCH2CH3 + KOH كحولي (مركز)
2 - أكتب معادلة كيميائية تبين تحضير البروبين CH3CH=CH2 ؛ بتسخين 2- بروبانول CH3CHOHCH3 مع محلول حمض الكبريتيك H2SO4 المركز.
CH3CHOHCH3
تحضير هاليدات الألكيل Preparation of Alkyl Halide
تستخدم هاليدات الألكيل في كثير من الصناعات، مثل صناعة المبيدات الحشرية،
ومحاليل المُعقّمات الطبية، وصناعة طفايات الحريق، وصناعة المبلمرات، وغيرها.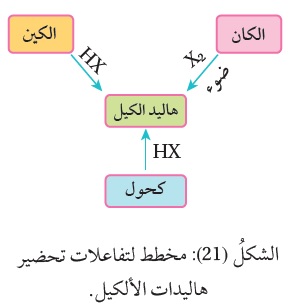
تُحضّر هاليدات الألكيل بطرائق عدة في المختبر منها:
الاستبدال في الألكان (هلجنة الألكان)، وإضافة هاليد الهيدروجين إلى الألكين، والاستبدال في الكحولات، أنظر الشكل ( 21 ).
تحضير هاليدات الألكيل من الالكانات
Preparation of Alkyl Halide from Alkanes
تُحضّر بعض هاليدات الألكيل البسيطة في المختبر؛ باستبدال ذرة هالوجين بذرة هيدروجين في الألكان بوجود الضوء، مثل تفاعل الميثان أو الإيثان مع الكلور Cl2 ، أو البروم Br2، بوجود الضوء.
مثال (3) : يُحضّر كلورو ميثان CH3Cl بتفاعل الميثان CH4 مع الكلور Cl2 ؛ بوجود الضوء
أكتب المعادلة الكيميائية للتفاعل الحاصل.
الحلّ: CH3Cl + HCl
تحضير هاليدات الألكيل من الكينات
Preparation of Alkyl Halides from Alkenes
يُحضر هاليد الألكيل RX ؛ بإضافة هاليد الهيدروجين إلى الألكين؛ وفق قاعدة
ماركو فينكوف.
مثال (4) :يُحضّر 2-كلوروبروبان CH3CHClCH3 ؛ بإضافة كلوريد الهيدروجين HCl إلى البروبين CH2=CHCH3 ، أكتب المعادلة الكيميائية للتفاعل الحاصل.
الحلّ:
CH2=CHCH3 + HCl
مثال (5) :أكتب معادلة كيميائية تبين تحضير المركب 2-برومو ميثيل بروبان
الحلّ:
تحضير هاليدات الألكيل من الكحولات Preparation of Alkyl Halides from Alcohols
تُحضّر هاليدات الألكيل باستخدام تفاعل الاستبدال في الكحولات؛ وذلك بتفاعل الكحول مع محلول حمض مركز مثل HCl ، أو HBr.
مثال(6): يُحضّر كلورو إيثان CH3CH2Cl ؛ بتفاعل الإيثانول CH3CH2OH ، مع محلول حمض الهيدروكلوريك HCl المركّز، اكتب معادلة كيميائية للتفاعل الحاصل.
الحلّ:
CH3CH2OH + HCl (مركز)
مثال(7):
أكتب معادلة كيميائية تبين تحضير 2- بروموبروبان
الحلّ:
إجابة سؤال أتحقَّق:
1- أكتب معادلة كيميائية لتحضير برومو إيثان بتفاعل الإيثان CH3CH3، مع البروم Br2؛ بوجود الضوء.
الحلّ:
CH3CH3 + Br2
2- أكتب معادلة كيميائية تبين تحضير 2- كلورو ميثيل بروبان
ميثيل-2-بروبانول
الحلّ:
تحضير الألديهايد والكيتون Preparation of Aldehyde and Ketone
كيف تحضر الالديهايدات والكيتونات؟ وما العوامل المستخدمة في تحضيرها؟
تعدّ تفاعلات التأكسد من الطرق الرئيسة لتحضير الألديهايدات والكيتونات التي تستخدم في المجالات الصناعية المتعددة في حياتنا اليومية؛ فتستخدم الألديهايدات في صناعة العطور، والمنظفات، والصابون، كما تستخدم الكيتونات في صناعة المنسوجات، والأصماغ، ومذيبات الدهانات، وغيرها.
تُحضّر الألديهايدات والكيتونات صناعيًا؛ بتسخين الكحولات الأولية أو الثانوية عند درجة حرارة
فمثلا؛ يتأكسد الإيثانول بوجود النحاس وفق المعادلة الآتية:
وكذلك يتأكسد الكحول الثانوي 2- بروبانول
أما في المختبر؛ فهناك طرائق عدة لتحضير كل من الألديهايد والكيتون، ومن أشهرها
أكسدة الكحول الأولي باستخدام كلوروكرومات البيريدينيوم PCC المذاب في ثنائي كلورو ميثان CH2Cl2 ، وينتج الألديهايد.
مثال(8): يتأكسد الايثانول CH3CH2OH، باستخدام كلوروكرومات البيريدينيوم PCC المذاب في ثنائي كلورو ميثان CH2Cl2 ، وينتج الايثانال ،CH3CHO ، أكتب معادلة التفاعل الحاصل.
الحلّ:
إجابة سؤال أفكر:
أصمّم مخططًا لسلسلة التفاعلات المستخدمة في تحضير الإيثانال بدءًا من الإيثين.
الحلّ:
في حين يتأكسد الكحول الثانوي باستخدام دايكرومات البوتاسيوم K2Cr2O7 ، في وسط حمضي(+H)،أو باستخدام المركب PCC ، المذاب في CH2Cl2 ؛ وينتج الكيتون.
مثال(9): يتأكسد 2- بروبانول CH3CHOHCH3 ، باستخدام دايكرومات البوتاسيوم K2Cr2O7 ، في وسط حمضي وينتج البروبانون CH3COCH3 ، أكتب معادلة التفاعل الحاصل.
الحلّ:
مثال(10): أكتب معادلة اكسدة 2- بروبانول CH3CHOHCH3 ، باستخدام كلوروكرومات البيريدينيوم PCC ، المذاب في ثنائي كلورو ميثان CH2Cl2 ، لتحضير البروبانون CH3COCH3 .
الحلّ :
مثال(11): أكتب معادلات تُبيّن تحضير الميثانال CH2O، باستخدام الميثان CH4 في المختبر، وبوجود الضوء وكلّ من المواد الآتية: Cl2 , KOH , PCC ,CH2Cl2 , HCl
الحلّ:
يتفاعل الميثان CH4 مع الكلور Cl2 ، بوجود الضوء لتكوين كلوروميثان CH3Cl ؛
كما في المعادلة الآتية: CH4 + Cl2
ثم يتفاعل كلوروميثان CH3Cl ، مع القاعدة KOH ، لتكوين الميثانول CH3OH ،
كما في المعادلة الآتية: CH3Cl + KOH
يتأكسد الميثانول CH3OH ، باستخدام العامل المؤكسد PCC ، وبوجود CH2Cl2 ، وينتج الميثانال؛
كما في المعادلة الآتية:
مثال(12):أكتب معادلات كيميائية تبيّن تحضير البروبانون
الحلّ:
يُحضّر البروبانون من أكسدة 2- بروبانول CH3CHOHCH3، وهو كحول ثانويّ يمكن الحصول عليه من إضافة الماء إلى البروبين CH3CH=CH2 ، والمعادلات الآتية توضح ذلك:
أولاً يضاف الماء إلى البروبين بوجود حمض H2SO4 ؛ فينتج 2- بروبانول CH3CHOHCH3
كما في المعادلة الآتية:
ثم يتأكسد 2- بروبانول باستخدام العامل المؤكسد K2Cr2O7 ، بإضافة قطرات من الحمض؛ نتج البروبانون كما في المعادلة الآتية:
|
الربط بالصحة: الكشف عن الكيتون في البول |
إجابة سؤال أتحقَّق: أصمّم مخططًا يبين صيغ المركبات العضوية الناتجة من سلسلة التفاعلات الكيميائية التي تجري لتحضير البيوتانون ؛CH3COCH2CH3 من
1- كلورو بيوتان CH3CH2CH2CH2Cl ،باستخدام مصدر حرارة والمواد الآتية:
KOH , K2Cr2O7 , H2SO4 , H2O
الحل:يحضر البيوتانون (كيتون) من أكسدة كحول ثانوي، لذلك نحضر الكحول الثانوي ثم نؤكسده كما يلي:
تحضير الكحولات Preparation of Alcohols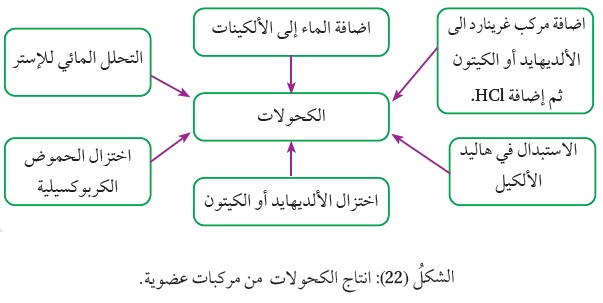
تعد الكحولات من أشهر المركبات العضوية، ولها أهمية كبيرة في الكيمياء العضوية؛ ويمكن تحضيرها من عدد من المركبات العضوية أنظر الشكل (22).
يعدُّ كل من الميثانول CH3OH ، والإيثانول CH3CH2OH ، أبسط أنواع الكحولات، ولهما أهمية في الصناعات المختلفة، لذلك يجري تحضيرهما صناعيًّا بكميات تجارية.
يُحضّر الميثانول صناعيًّا عن طريق هدرجة غاز أول أكسيد الكربون CO ، عند درجة حرارة
يُحضّر الإيثانول صناعيًا؛ من تخمير الجلوكوز الموجود في الذرة، أو العنب، أو الشعير،
باستخدام أنزيمات الخميرة، كما في المعادلة الآتية:
C6H12O6
تحضير الكحولات من الألكينات Preparation of Alcohols from Alkenes
يُحضّر الكحول بإضافة الماء إلى الألكين؛ بوجود عامل مساعد مثل حمض الكبريتيك H2SO4 ، أو حمض الفسفوريك H3PO4. والأمثلة الآتية توضح ذلك:
مثال(13): يحضر 2- بروبانول CH3CHOHCH3 ، باستخدام البروبين CH3CH=CH2 ، والماء، وحمض الفسفوريك ؛H3PO4 ،اكتب معادلة التفاعل الحاصل.
الحل:
إجابة سؤال أتحقَّق: أكتب معادلة تحضير 2- بيوتانول CH3CH2CHOHCH3 ؛
من تفاعل 1-بيوتين CH3CH2CH=CH2 مع الماء، بوجود حمض الكبريتيكH2SO4
الحلّ:
تحضير الكحولات من هاليدات الألكيل Preparation of Alcohols from Alkyl Halides
يُحضر الكحول الأولي من تفاعل هاليد الألكيل الأولي مع هيدروكسيد الصوديوم NaOH ؛ أو هيدروكسيد البوتاسيوم KOH.
مثال(14):أكتب معادلة كيميائية تبين ناتج تفاعل 1-برومو بروبان CH3CH2CH2Br
مع محلول هيدروكسيد الصوديوم NaOH.
الحلّ:
CH3CH2CH2Br + NaOH
ويمكن كتابة المعادلة على النحو الآتي:
-CH3CH2CH2Br + OH-
إجابة سؤال أتحقَّق: أكتب معادلات كيميائية تُبيّن تحضير الإيثانول CH3CH2OH ، إذا توافر لديك في المختبر إيثان CH3CH3 ، والكلور Cl2 ، والضوء، ومحلول هيدروكسيد البوتاسيوم KOH.
الحلّ:
CH3CH3 + Cl2
تحضير الكحولات من الألديهايدات أو الكيتوناتPreparation of Alcohols from Aldehydes or Ketones
يحضر الكحول باختزال الألديهايد أو الكيتون؛ باستخدام عوامل مختزلة، مثل
هيدريد الليثيوم والألمنيوم LiAlH4، في وسط من الإيثر الجافّ ، أو بورو هيدريد الصوديوم NaBH4 مذابا في الايثانول، ثم يضاف إليه محلول مخفف من حمض مثل H2SO4،
إذ يؤدي اختزال الألديهايد إلى إنتاج كحول أولي، بينما يؤدي اختزال الكيتون إلى إنتاج كحول ثانوي.
إجابة سؤال أفكر: يصعب تحضير المركب 2- بروبانول CH3CHOHCH3 مباشرة من تفاعل 2- كلورو بروبانCH3CHClCH3 .
الاجابة: لأن 2- كلورو بروبان هو هاليد الكيل ثانوي يتفاعل بالحذف بالتسخين مع قاعدة قوية مثل NaOH وينتج عن ذلك الكين ولا ينتج كحولاً.
مثال(15): أكتب معادلة كيميائية تُبيّن تحضير الإيثانول بتفاعل الإيثانال
الحلّ: يُحضّر الإيثانول باختزال الإيثانال كما في المعادلة الآتية:
مثال(16):أكتب معادلة كيميائية تبين تحضير 2- بروبانول
باستخدام هيدريد الليثيوم والألمنيوم LiAlH4 .
الحلّ: يُحضّر 2- بروبانول باختزال البروبانون كما في المعادلة الآتية:
كما يمكن الحصول على الكحولات صناعيًا باختزال الألديهايد والكيتون أيضاً؛ بإضافة غاز الهيدروجين إلى كلّ منهما بوجود عامل مساعد، مثل النيكل Ni ، عند درجة حرارة
إجابة سؤال أتحقَّق: أكتب معادلة كيميائية تبين تحضير 2- بيوتانول
الحلّ: يُحضّر 2- بيوتانول باختزال البيوتانون باستخدام NaBH4 كما في المعادلة الآتية:
تحضير الكحولات من الحموض الكربوكسيلية Preparation of Alcohols from Carboxylic Acids
يُحضّر الكحول الأولي باختزال الحمض الكربوكسيلي؛ باستخدام هيدريد الليثيوم والألمنيوم LiAlH4 ، المذاب في الايثر الجاف حيث يُختزل الحمض الكربوكسيلي وينتج الكحول الأولي.
مثال(17): أكتب معادلة كيميائية لتحضير الإيثانول CH3CH2OH ، من حمض الإيثانويك CH3COOH ؛ باستخدام هيدريد الليثيوم والألمنيوم LiAlH4.
الحلّ:
يُحضّر الإيثانول CH3CH2OH ، باختزال حمض الإيثانويك CH3COOH ،في وسط جاف من الإيثر، ثم إضافة قطرات من محلول حمض مُخفّف، كما في المعادلة الآتية:
إجابة سؤال أتحقَّق: أكتب معادلة كيميائية تبين تحضير 1- بروبانول CH3CH2CH2OH، من حمض البروبانويك CH3CH2COOH بوجود هيدريد الليثيوم والألمنيوم LiAlH4 ، والإيثر وحمض H2SO4 المخفّف.
الحلّ:
تحضير الكحولات من الاسترات Preparation of Alcohols from Esters
يتفكّك الإستر عند تسخينه مع محلول قاعدة قوية، مثل هيدروكسيد الصوديوم NaOH ؛ وينتج الكحول وملح الحمض الكربوكسيلي.
مثال (18) : أكتب معادلة كيميائية لتحضير الإيثانول CH3CH2OH بتسخين إيثانوات الإيثيل
الحلّ:
إجابة سؤال أتحقَّق: أكتب معادلات كيميائية تُبيّن تحضير الميثانول بتسخين إستر إيثانوات الميثيل CH3COOCH3 ، مع هيدروكسيد الصوديوم NaOH.
الحلّ:
تحضير الكحولات باستخدام مركبات غرينارد Preparation of Alcohols from Grinard’s Compounds
ما أهمية مركب غرينارد؟ وكيف تحضر الكحولات باستخدام مركب غرينارد؟
عرفت سابقا ان مركب غرينارد RMgX ينتج من تفاعل هاليد ألكيل RX، مع المغنيسيوم بوجود الإيثر الجاف.
تتفاعل مركبات غرينارد RMgX ، مع كلٍّ من الألديهايد RCHO ، والكيتونRCOR ؛ وينتج الكحول ROH ، وتعدّ هذه التفاعلات من أشهر الطرائق المتّبعة في تحضير الكحولات،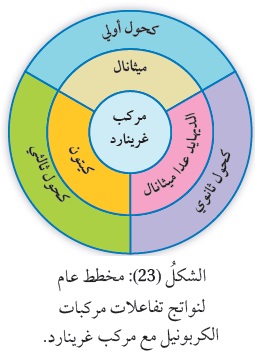
ويكون عدد ذرات الكربون في الكحول الناتج يساوي مجموع عدد ذرات الكربون في كلٍّ من مركب غرينارد والألديهايد أو الكيتون. يعتمد نوع الكحول الناتج على نوع الألديهايد أو الكيتون المتفاعل، ويبيّن الشكل(23) مخطّطًا عامًّا
لنواتج تفاعلات الألديهايد أو الكيتون مع مركب غرينارد.
مثال(19):
أكتب معادلات كيميائية تبين تحضير 1-بروبانول CH3CH2CH2OH ، من تفاعل الميثانال CH2O ، مع إيثيل كلوريد المغنيسيوم CH3CH2MgCl.
الحلّ:
المركب CH3CH2CH2OH هو كحول أوليّ؛ عدد ذرات الكربون فيه يساوي مجموع عدد ذرات الكربون في كلّ من مركب غرينارد CH3CH2MgCl ، حيث عدد ذرات الكربون فيه يساوي 2، والميثانال وعدد ذرات الكربون فيه يساوي 1، وبهذا يمكن تحضير 1- بروبانول CH3CH2CH2OH ؛ بإضافة مركب غرينارد ،CH3CH2MgCl إلى الميثانال CH2O ؛
وينتج المركب الوسطي كما في المعادلة الآتية:
يتفاعل المركب الوسطي الناتج في المعادلة السابقة مع حمض قوي مثل HCl ؛
وينتج الكحول 1- بروبانول؛ كما في المعادلة الآتية:
مثال (20): أكتب معادلات كيميائية تبين تحضير 2-بيوتانول
الحلّ:
المركبCH3CHOHCH2CH3 ، هو كحول ثانوي يتكون من أربع ذرات كربون، وتساوي مجموع عدد ذرات الكربون في مركب غرينارد والإيثانال، أي أن اثنتين منها مصدرهما إيثيل كلوريد المغنيسيوم CH3CH2MgCl، والأخريين مصدرهما الإيثانال CH3CHO .
وبذلك يُحضّر المركب 2- بيوتانول ؛CH3CHOHCH2CH3 بإضافة إيثيل كلوريد المغنيسيوم CH3CH2M Cl ، إلى الإيثانال CH3CHO ؛ وينتج المركب الوسطي كما في المعادلة الآتية:
يتفاعل المركب الوسطي الناتج في المعادلة السابقة مع حمض قوي مثل HCl ،
وينتج 2- بيوتانول؛ كما في المعادلة الآتية:
مثال (21): الكحول 2- ميثيل - 2- بيوتانول
الحل:
المركب
يتفاعل المركب الوسطي الناتج في المعادلة السابقة مع حمض قوي مثل HCl ، وينتج الكحول المطلوب، كما في المعادلة الآتية+
مثال(22): أكتب معادلات كيميائية توضح تحضير 2- بيوتانول CH3CHOHCH2CH3 ، في المختبر إذا توافر الإيثين CH2=CH2، و PCC/CH2Cl2 والمواد الآتية:
Mg , HCl , H2SO4 , H2O.
الحل:
الكحول المطلوب تحضيره 2- بيوتانول هو كحول ثانوي، ويتكون من أربع ذرات كربون؛
أي ضعف عدد ذرات الكربون في الإيثين. ولتحضيره أستخدم مركب غرينارد؛ وألديهايدًا، ويكون عدد ذرات الكربون فيهما يساوي أربع ذرات؛ لذا أستخدم مركب غرينارد وألديهايدًا يتكون كلّ منهما من ذرتي كربون. أقسم الكمية المتوافرة من الإيثين إلى قسمين؛
أستخدم أحدهما لتحضير الألديهايد (الإيثانال)،
وأستخدم القسم الآخر لتحضير مركب غرينارد (إيثيل كلوريد المغنيسيوم) CH3CH2MgCl.
يمكن الحصول على الإيثانال من أكسدة كحول أولي؛ ولذلك أضيف الماء إلى الإيثين بوجود حمض الكبريتيك H2SO4 ، للحصول على الإيثانول كما يأتي:
CH2=CH2 + H2O/ H2SO4
أجري أكسدة الإيثانول باستخدام كلورو كرومات البيريدينيوم المذاب في ثنائي كلوروميثان PCC\CH2Cl2 للحصول على الإيثانال كما يأتي:
أحضر مركب غرينارد (إيثيل كلوريد المغنيسيوم CH3CH2MgCl)، من تفاعل هاليد الألكيل مع المغنيسيوم؛ بوجود الإيثر الجاف؛ولذلك أحضر هاليد الألكيل(كلورو إيثان CH3CH2Cl )؛ بإضافة حمض الهيدروكلوريك HCl ، إلى الإيثين، ثم أفاعل كلورو إيثان الناتج مع المغنيسيوم بوجود الإيثر، وينتج ايثيل كلوريد المغنيسيوم CH3CH2MgCl ؛ كما يأتي:
CH2=CH2 + HCl
CH3CH2Cl + Mg
أضيف مركب غرينارد الناتج إلى الإيثانال، وينتج المركب الوسطي الذي يتفاعل مع حمض الهيدروكلوريك لتكوين الكحول المطلوب، كما يأتي:
مثال(23): أكتب المعادلات الكيميائية التي توضح كيفية تحضير الإيثانول CH3CH2OH ؛ من الميثان CH4 باستخدام الضوء، والمواد الآتية: الإيثر، PCC/CH2Cl2 , HBr , NaOH , Mg , Br2.
الحلّ:
المركب المطلوب تحضيره هو الإيثانول CH3CH2OH ، هو كحول أولي، وعدد ذرات الكربون فيه أكبر من الميثان، ولا يمكن أن ينتج إلا بتفاعل الميثانال مع مركب غرينارد؛ ولتحضيره
أُحضّر مركب غرينارد أولً، ثم أُحضّر الميثانال، وأفاعلهما معًا كي أحصل على الإيثانول.
يتفاعل الميثان مع الهالوجين؛ مثل البروم بالاستبدال لتكوين هاليد الألكيل كما في المعادلة:
أقسم المركب برومو ميثان CH3Br الناتج إلى قسمين؛
أستخدم أحدهما لتحضير مركب غرينارد ميثيل بروميد المغنيسيوم CH3MgBr ، كما يأتي:
أستخدم القسم المتبقي من برومو ميثان CH3Br ، لتحضير الميثانال CH2O ،
حيث يتفاعل CH3Br مع NaOH، وينتج الميثانول CH3OH ، كما يأتي:
CH3Br + NaOH
وبعدها أجري أكسدة الميثانول؛ باستخدام كلورو كرومات البيريدينيوم PCC\CH2Cl2 ، لتكوين الميثانال كما يأتي:
ثم أضيف ميثيل بروميد المغنيسيوم إلى الميثانال؛ فينتج المركب الوسطي ثم أفاعله مع حمض HBr ، فيتكون كحول الإيثانول المطلوب؛ كما في المعادلات الآتية:
مثال(24):
أكتب المعادلات التي تبين تحضير 2-بروبانول
الحلّ:
الكحول المراد تحضيره 2- بروبانول هو كحول ثانوي، وعدد ذرات الكربون فيه أكبر من عددها في أيّ من المركبين العضويين المتوافرين، ويساوي مجموع عددها في كلّ من المركّبين، ولتحضير هذا المركب؛ نستخدم طريقة غرينارد، حيث يجري تحضير ألديهايد ومركب غرينارد أولاً، ثم تجري مفاعلتهما معًا.
ولمّا كان الكحول المطلوب ثانويًا؛ فإنه يلزم لتحضيره ألديهايد عدا الميثانال، ولذلك؛
يستخدم المركب CH2=CH2، لتحضير الألديهايد CH3CHO، ويستخدم المركب CH4، لتحضير مركب غرينارد ميثيل كلوريد المغنيسيوم CH3MgCl ، كما يأتي:
أضيف الماء إلى الإيثين CH2=CH2؛ للحصول على كحول الإيثانول CH3CH2OH ،
كما في المعادلة الآتية:
ثم تجري أكسدة الإيثانول باستخدام كلورو كرومات البيريدينيوم PCC\CH2Cl2 ؛ للحصول على الإيثانال كما يأتي:
يتفاعل الميثان مع الكلور Cl2 بالاستبدال؛ فينتج كلورو ميثان CH3Cl ، كما في المعادلة الآتية:
يتفاعل كلوروميثان CH3Cl ، مع المغنيسيوم Mg ؛ بوجود الإيثر للحصول على مركب غرينارد (ميثيل كلوريد المغنيسيوم) كما في المعادلة الآتية:
أضيف ميثيل كلوريد المغنيسيوم CH3MgCl الى الإيثانال CH3CHO ؛ فينتج المركب الوسطي ثم أفاعله مع الحمض HCl ، فيتكون 2- بروبانول، كما في المعادلات الآتية:
إجابة سؤال أتحقَّق:أكتب صيغ المركبات العضوية , A, B, C, D, E الناتجة من سلسلة
التفاعلات المبيّنة في المخطط الآتي:
الحلّ:
تحضير الايثرات Preparation of Ethers
ما اهم الايثرات؟ وكيف يمكن تحضيرها؟
يُحضر العديد من الإيثرات صناعيًا؛ ومن أهمها ثنائي إيثيل إيثر ،CH3CH2OCH2CH3
حيث يستخدم مذيبًا عضويًا في كثير من التفاعلات، ويُحضّر صناعياً بتسخين
الإيثانول CH3CH2OH ، مع حمض الكبريتيك المركز H2SO4 ، إلى درجة حرارة تصل
2CH3CH2OH
أما في المختبر؛ فتُحضّر الإيثرات بشكل أساسي بتفاعل هاليد الألكيل الأولي RX ، مع مركبات ألكوكسيد، مثل ألكوكسيد الصوديوم R-ONa ، حيث يحلّ أيون الألكوكسيد -RO ، محلّ أيون الهالوجين.
مثال(25): أكتب معادلات كيميائية توضّح تحضير ثنائي ميثل إيثر CH3-O-CH3 ؛ في المختبر من الميثان CH4 ، مستخدمًا الضوء والمواد الآتية: NaOH , Br2 ,Na
الحلّ:
ثنائي ميثل إيثر CH3-O-CH3 ، المراد تحضيره يتكون من مجموعتين ألكيل متماثلتين CH3 ، على جانبي ذرة الأكسجين، تتكون كلّ منهما من ذرة كربون واحدة، يكون مصدر إحداهما هاليد الألكيل بروموميثان ،CH3Br ومصدر الأخرى أيون الميثوكسيد -CH3O ،
لذلك أستخدم الميثان لتحضير بروموميثان CH3Br كما يأتي:
CH4 + Br2
بروموميثان الميثان
أقسم المركب بروموميثان إلى قسمين
أحتفظ بأحدهما، وأستخدم القسم الآخر لتحضير أيون الميثوكسيد،
حيث أفاعل بروموميثان مع هيدروكسيد الصوديوم؛ فينتج الميثانول CH3OH ، كما يأتي:
CH3Br + NaOH
الميثانول بروموميثان
ثم أفاعل الميثانول CH3OH ، مع الصوديوم Na ، فينتج ميثوكسيد الصوديوم CH3ONa
كما في المعادلة الآتية:
CH3OH + Na
وبعدها أفاعل بروموميثان CH3Br مع ميثوكسيد الصوديوم CH3ONa، الذي يتأين وينتج أيون -CH3O، الذي يحلّ محل ذرة الهالوجين Br، في بروموميثان، وينتج ثنائي ميثيل ايثر CH3-O-CH3؛ كما في المعادلة الآتية:
CH3Br + CH3O-
مثال(25): أكتب معادلات كيميائية توضّح تحضير إيثيل ميثل ايثر CH3CH2-O-CH3، إذا توافر في المختبر الميثان CH4 والإيثين CH2=CH2؛مستخدمًا الضوء ، والمواد الآتية:NaOH,HCl,Cl2,Na
الحلّ:
الإيثر المراد تحضيره هو إيثيل ميثل ايثر CH3CH2-O-CH3،ويتكون من مجموعتي ألكيل مختلفتين إحداهما CH3 والأخرى CH3CH2، ولذلك أستخدم أحد المركّبين العضويين لتحضير هاليد الألكيل RX ، ويستخدم الآخر لتحضير مركب الألكوكسيد RONa ،
ولذلك أضيف HCl إلى الإيثين CH2=CH2 ؛ فينتج كلورو ايثان CH3CH2Cl، كما في المعادلة الآتية:
CH2=CH2 + HCl
ثم أستخدم الميثان CH4، لتحضير الألكوكسيد CH3ONa،
حيث يتفاعل الميثان مع الكلور Cl2، بوجود الضوء بتفاعل الاستبدال، وينتج كلورو ميثان CH3Cl؛ كما في المعادلات الآتية: CH4+ Cl2
ثم أفاعل كلورو ميثان CH3Cl، مع هيدروكسيد الصوديوم NaOH؛ فينتج الميثانول CH3OH ، كما يأتي: CH3Cl + NaOH
بعد ذلك؛ أفاعل الميثانول CH3OH، مع الصوديوم Na؛ فينتج ميثوكسيد الصوديوم CH3ONa:
CH3OH + Na
ثم أفاعل كلورو إيثان CH3CH2Cl، مع ميثوكسيد الصوديوم؛ فينتج إيثيل ميثيل إيثر؛ كما في المعادلة الآتية:
CH3CH2Cl + CH3ONa
إجابة سؤال أتحقَّق:
أكتب معادلات كيميائية توضح تحضير الإيثر
1- كلورو بروبانCH3CH2CH2Cl، والإيثين CH2=CH2، والمواد الآتية: NaOH , HCl , Na, H3PO4, H2O
الحلّ:
لتحضي ايثر يلزم توفر هاليد الكيل اولي ومجموعة ألكوكسيد ،والايثر المطلوب تحضيره يتكون من مجموعتي الكيل
احداهما CH3CH2 ومصدرها هاليد الكيل أولي، والاخرى متفرعة مصدرها ألكوكسيد ثانوي، ولذلك نستخدم الإيثين CH2=CH2 لتحضير هاليد الكيل أولي ، ونستخدم CH3CH2CH2Cl لتحضير ألكوكسيد ثانوي الذي يحضر من كحول ثانوي، والمعادلات الآتية توضح تحضير الايثر المطلوب:
تحضير هاليد الألكيل: وذلك باضافة HCl الى الايثين كما يلي:
CH2=CH2 + HCl
تحضير الألكوكسيد: نحضر كحول ثانوي ثم نحضر منه الألكوكسيد كما يلي:
CH3CH2CH2Cl + NaOH
CH3CH2CH2OH
CH3CH=CH2 + H2O
تحضير الايثر المطلوب: أفاعل هاليد الالكيل ومركب الكوكسيد الثانوي كما يلي:
تحضير الحموض الكربوكسيلية Preparation of Carboxylic Acids
يُحضّر حمض الإيثانويك صناعيًّا على نطاق واسع عن طريق تفاعل الميثانولCH3OH مع أول أكسيد الكربون CO؛ بوجود عامل مساعد من يود-روديوم (RhI)؛ كما في المعادلة الآتية:
CH3OH + CO
وتُحضّر الحموض الكربوكسيلية في المختبر بطرائق عدة منها:
أكسدة الكحولات الأولية أو أكسدة الألديهايدات باستخدام عوامل مؤكسدة قوية، مثل دايكرومات الصوديوم Na2Cr2O7 ، أو دايكرومات البوتاسيوم K2Cr2O7 في وسط حمضي،
وتحضر ايضاً من التحلل المائي للإستر وذلك بتفاعل الإستر مع محلول قاعدة
قوية، مثل هيدروكسيد الصوديوم NaOH أو هيدروكسيد البوتاسيوم KOH ؛ فينتج
الكحول وملح الحمض الكربوكسيلي الذي تجري مفاعلته مع محلول مخفف من
حمض الهيدروكلوريك HCl ؛ فينتج الحمض الكربوكسيلي.
مثال(27): أكتب معادلات كيميائية تبين تحضير حمض الميثانويك HCOOH؛من ميثانوات الإيثيل HCOOCH2CH3،باستخدام قاعدة قوية مثل هيدروكسيد الصوديوم NaOH، وحمض HCl.
الحلّ:
يُحضّر الحمض الكربوكسيلي بتسخين ميثانوات الإيثيل مع محلول القاعدة NaOH ، وينتج الإيثانول وميثانوات الصوديوم؛ كما في المعادلة الآتية:
يُفصل الإيثانول من المحلول بعملية التقطير، ثم يضاف حمض الهيدروكلوريك HCl ، إلى محلول ميثانوات الصوديوم المتبقي؛ فيتفاعل أيون الهيدروجين+H مع أيون-HCOO،
وينتج حمض الميثانويك HCOOH ، كما في المعادلة الآتية:
مثال (28):أكتب معادلات كيميائية تبين أكسدة البروبانال CH3CH2CHO للحصول
على حمض البروبانويك CH3CH2COOH.
الحلّ:
يُحضّر حمض البروبانويك CH3CH2COOH ؛ بأكسدة البروبانال CH3CH2CHO ، باستخدام دايكرومات البوتاسيوم K2Cr2O7 ، في وسط حمضي (+H)، كما في المعادلة الآتية:
إجابة سؤال أتحقَّق: أكتب معادلات كيميائية تبيّن تحضير حمض الميثانويك HCOOH
مخبريًا؛ من الميثان CH4 ، مستخدمًا الضوء، والمواد الآتية: NaOH , K2Cr2O7 , HCl , Cl2
الحلّ: يحضر الحمض الكربوكسيلي بأكسدة كحول أولي باستخدام K2Cr2O7 بوسط حمضي،
لذلك نحضر من الميثان كحول أولي ثم نؤكسده باستخدام K2Cr2O7 فينتج الميثانويك كما يلي:
CH4 + Cl2
CH3Cl + NaOH
CH3OH
تحضير الإسترات Preparation of Esters
تستخدم عملية الأسترة في تحضير الكثير من المركبات العضوية ذات الأهمية الكبرى
في حياتنا؛ مثل الأسبرين ومضافات لتحسين الوقود، ومُنكّهاتٍ غذائيةً، وفي صناعة النسيج، وتستخدم في صناعة الصابون، والمنظّفات، وغيرها.
يُحضّر الإستر في المختبر بطرائق عدة؛ منها تفاعل الحمض الكربوكسيلي مع الكحول
في وسط حمضي (محلول حمض الكبريتيك H2SO4 )، وذلك في ما يعرف بعملية الأسترة وهي العملية الأكثر شيوعًا صناعيًّا.
مثال(29):أكتب معادلات كيميائية توضح تحضير إيثانوات الميثيل CH3COOCH3، في المختبر إذا توافر CH4 , CH3CH2Br والضوء والمواد الآتية: K2Cr2O7 , KOH , H2SO4 , Br2
الحلّ:
المركب CH3COOCH3؛هو إستر ينتج من تفاعل حمض كربوكسيلي مع كحول في وسط حمضي، وبالتدقيق في صيغته؛يمكن تحديد الجزء المشتق من الحمض والجزء المشتق من الكحول
كما يأتي:
ألاحظ أن الجزء المشتق من الحمض يتكون من ذرتي كربون؛ولذلك
أستخدم المركبCH3CH2Br ، لتحضير الحمض الكربوكسيلي CH3COOH ،بينما يتكون
الجزء المشتق من الكحول من ذرة كربون واحدة؛ فأستخدم المركبCH4، لتحضير الكحول، والمعادلات الآتية توضح ذلك:
أفاعل برومو إيثانCH3CH2Br، مع هيدروكسيد البوتاسيوم KOH، فينتج الإيثانول CH3CH2OH، كما في المعادلة الآتية: CH3CH2Br + KOH
ثم تجري أكسدة الإيثانول CH3CH2OH،باستخدام K2Cr2O7، بوسط حمضي،
وينتج حمض الإيثانويك CH3COOH ، كما في المعادلة الآتية:
CH3CH2OH
ثم يجري تحضير الميثانول CH3OH، من الميثان CH4 كما يأتي:
أفاعل الميثان CH4، مع البروم بوجود الضوء؛ فينتج بروموميثان CH3Br، كما يأتي:
CH4 + Br2
ثم أفاعل برومو ميثان CH3Br، مع هيدروكسيد البوتاسيوم KOH؛ فينتج الميثانول CH3OH، كما في المعادلة الآتية: CH3Br + KOH
بعدها أفاعل الميثانول CH3OH، مع حمض الايثانويك CH3COOH،في وسط حمضي،
وينتج الإستر CH3COOCH3؛ كما في المعادلة الآتية:
إجابة سؤال أتحقَّق: أكتب معادلات كيميائية تبيّن تحضير إيثانوات الإيثيل CH3COOCH2CH3 ؛ بدءًا من الإيثانال CH3CHO ، وباستخدام المواد الآتية:
Ni, H2 , H2SO4 , K2Cr2O7
الحلّ: يحضر الاستر من تفاعل حمض كربوكسيلي مع كحول، ولذلك نحدد الشق المشتق من الحمض في الاستر وكذلك الشق المشتق من الكحول، كمايلي:
CH3CO \ OCH2CH3
الجزء المشتق من الكحول OCH2CH3 ، الجزء المشتق من الحمض CH3CO
كلا الجزئين يتكون من ذرتي كربون ، لذلك نقسم الإيثانال CH3CHO الى قسمين :
نستخدم أحدهما لتحضير الحمض الكربوكسيلي، فنؤكسد الايثانال باستحدام K2Cr2O7 في وسط حمضي للحصول على الايثانويك CH3COOH، كما يلي:
اما الكحول فنحصل عليه من اختزال القسم المتبقي من الايثانال باضافة الهيدروجين،كما يلي:
ثم نفاعل الحمض الكربوكسيلي CH3COOH مع الكحول CH3CH2OH في وسط حمضي فنحصل على الاستر ايثانوات الايثيل كما يلي:
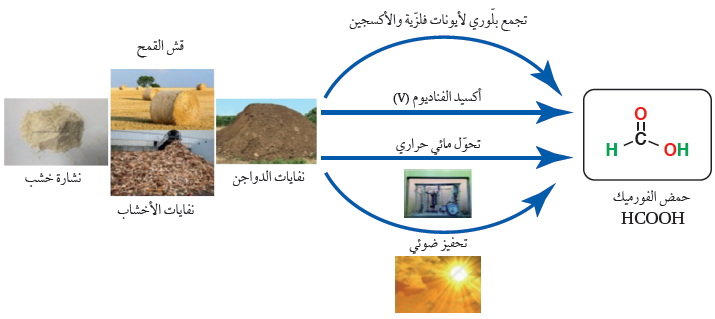
الإثراءُُ والتوسع: تحضير حمض الفورميك من أكسدة الكتلة الحيوية
يعدّ حمض الفورميك أو حمض الميثانويكHCOOH، من المواد الكيميائية المهمة في صناعات متعددة منها؛صناعة المنسوجات، والأدوية، والمواد الكيميائية الغذائية، وصناعة الجلود، والدباغة، ويستخدم مادةً حافظةً ومضادة للجراثيم في أعلاف الماشية. وكذلك يتوقع أن يصبح حمض الفورميك مصدرا لوقود الهيدروجين؛ إذ يمكن الحصول على حوالي % 100 من الهيدروجين المخزّن فيه لاستخدامه في خلايا الوقود.
ويحضر حمض الفورميك بعدة طرائق؛ وأكثرها شيوعا التحلّل المائي لميثانوات الميثيل، حيث يجري تحضيره صناعيًا بتفاعل أول أكسيد الكربون مع الميثانول مكونًا ميثانوات الميثيل، وبعد ذلك تتحلّل ميثانوات الميثيل في الماء لينتج حمض الميثانويك وكحول الميثانول، ويفصل الحمض، ثم يعاد استخدام الميثانول مرة أخرى لتكوين ميثانوات الميثيل، وهكذا.
أما في الوقت الحاضر؛ فهناك دراسات متعددة تركز على الكتلة الحيوية Biomass ، بوصفها مصدرًا للحصول على حمض الفورميك؛ نظرا لوفرتها وتدني تكلفتها. يطلق مصطلح الكتلة الحيوية على المخلفات العضوية للمحاصيل المختلفة، مثل قشّ القمح، ومخلفات الأخشاب، ونشارة الخشب، ومخلفات الدواجن.
حيث تجري أكسدة الكتلة الحيوية تحت ظروف مختلفة كما في الشكل، فتتحلّل وتتحول إلى حمض الفورميك؛بوجود فوق أكسيد الهيدروجين H2O2 ، والأكسجين O2 ، بوصفهما عاملان مؤكسدان.