- المفاهيم والمصطلحات :
عزيزي الطالب ستتعرف في هذا الدرس على هذه المفاهيم والمصطلحات العلمية :
|
المولُ |
Mole
|
|
عددُ أفوغادرو |
Avogadro’s Number
|
|
الكتلةُ المولية |
Molar Mass (Mr)
|
|
الكتلةُ الذريةُ النسبيةُ
|
Relative Atomic Mass (Am)
|
|
الكتلةُ الجزيئيةُ |
Molecular Mass (Mm)
|
|
كتلةُ الصيغةِ |
Formula Mass (Fm)
|
- الكتلة الذرية النسبية : (Relative Atomic Mass (RAM
- نستخدم في حياتنا اليومية أدوات مختلفة لقياس الأشياء حولنا مثل :
1) نستخدم (الميزان ) لقياس الكتلة
2) نستخدم المتر أو المسطرة لقياس المسافات وأطوال الأجسام
3) نستخدم بعض المصطلحات التي تعبر عن عدد محدد من الأشياء مثل :
- كلمة زوج (pair) : التي تدل على العدد إثنين (2) من أي شيء
- كلمة دزينة (dozen) : التي تدل على العدد إثني عشر (12) من أي شيء قابل للعد بغض النظر عن المادة المعدودة .
- توصل العلماء إلى أن :
- الذرة تتكون من إلكترونات وبروتونات ونيوترونات متناهية في الصغر حيث أن :
كتلة كل من البروتون أو النيوترون تقريبًا تساوي 1.67 x 10-24 g وكتلة الإلكترون تساوي من كتلة البروتون .
- إن كتلة الذرة صغيرة جدًا لذلك وجد العلماء صعوبة في التعامل معها بإستخدام أدوات القياس الشائعةِ فلجأ العلماء إلى طريقة لقياس كتلة الذرة بالنسبة إلى كتلة ذرة معيارية .
اعتمد العلماء ذرة الكربون (C12) التي تحتوي على 6 بروتونات و 6 نيوترونات بإعتبارها أساسًا لقياس كتل الذرات الأخرى.
- الشكل الأتي يمثل التركيب لذرة الكربون :
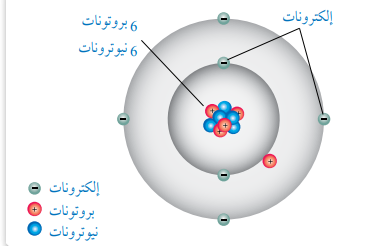
- كتلة هذه الذرة تساوي 12 وحدة سميت كل منها بــ ( وحدة كتلة ذرية ) (ِamu)
- إن وحدة الكتلة الذرية (amu) لأي عنصر تساوي من كتلة ذرة الكربون (C12)
ملاحظة : إن كتلة الذرة تعتمد على كتلة البروتونات والنيوترونات فيها .
- بما أن كتلة البروتون أو النيوترون تساوي 1 amu تقريبًا لذلك يتوقع أن تكون الكتلة الذرية للعنصر رقمًا صحيحًا
- لكن في الواقع إن القيم المقيسة تحتوي عادةً على كسور نظرًا لوجود نظائر للعنصر لها كتل مختلفة ولذلك فإن متوسط كتلها ليس رقمًا صحيحًا. وبهذا تم حساب الكتلة الذرية النسبية .
من هنا نصل لتعريف الكتل الذرية النسبية وطريقة حسابها
- الكتلة الذرية النسبية : ( وهي متوسط الكتل الذرية لنظائر ذرة عنصرٍ ما )
- لحساب الكتل الذرية النسبية لعنصر ما يجب :
- أخذ نظائره ونسب تواجدها بالطبيعة بالإعتبار
- ملاحظة : الكتل الذرية المستخدمة في الجدول الدوري تعبر عن متوسط الكتل الذرية النسبية لنظائر ذرات العنصر، ولتسهيل التعامل معها نستخدم قيمًا تقريبية كما في الأمثلة الواردة في الجدول الأتي والذي يمثل الكتل الذرية النسبية والتقريبية لبعض الذرات :
|
العنصر |
الكتلة الذرية النسبية |
الكتلة الذرية التقريبية |
|
H |
1.008 |
1 |
|
N |
14.007 |
14 |
|
O |
15.999 |
16 |
|
Na |
22.989 |
23 |
- تقاس الكتلة الذرية النسبية بوحدة الكتل الذرية (amu) ويمكن التعبير عنها أيضًا بوحدة (g)
- يمكن حساب الكتلة الذرية النسبية (Am) من خلال القانون التالي :
قانون الكتلة الذرية النسبية
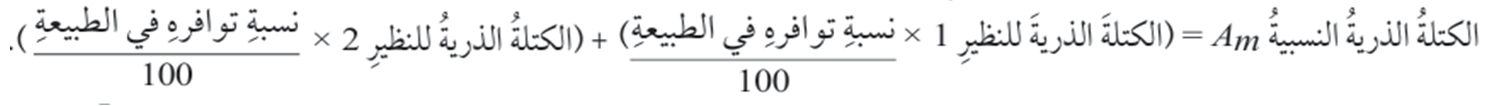
ويعبر عنه بالرموز بالصورة الأتية :
Am = Am1% + Am2%
مثال (1) :
إذا علمت أن عنصر الليثيوم (Li) يوجد في الطبيعة على صورة النظير 3Li6 ، و أن كتلته الذرية = 6.02 بنسبة 7.5 % ، وأن النظير 3Li7 ، وكتلته الذرية 7.02 بنسبة 92.5 %، فاحسب الكتلة الذرية النسبية لعنصر الليثيوم:
الحل:
Am = Am1% + Am2%
= (6.02 x 7.5%) + (7.02 x 92.5%)
= 0.4515 + 6.4935
= 0.4515 + 6.4935
Am = 6.945 amu
- الكتلة الجزيئية : Molecular Mass (Mm)
- تعريفها : هي مجموع الكتل الذرية للذرات الموجودة في الجزيء الذي ترتبط ذراته بروابط تساهمية مقيسة بوحدة amu
- تختلف المركبات الكيميائية بحسب أنواع الذرات المكونة لها
- يمكن حساب الكتلة الجزيئية للجزيء الواحد في المركب التساهمي من خلال معرفة الصيغة الجزيئية للمركب .
- يمكن حساب الكتلة الجزيئية (Mm) من خلال القانون الأتي :
الكتلة الجزيئية (Mm) = ( الكتلة الذرية للعنصر الأول × عدد ذراته في المركب ) + ( الكتلة الذرية للعنصر الثاني × عدد ذراته في المركب)
ويعبر عنه بالرموزبالصورة الأتية :
Mm = Am1 x N + Am2 x N
مثال (2) :
احسب الكتلة الجزيئية لجزيءالماء (H2O) علمًا بأن الكتل الذرية للعناصر هي :
(H = 1, O = 16)
الحل :
Mm = Am H x N + Am O x N
Mm = (1 X 2) + (16 X 1)
Mm = 2 +16
Mm = 18 amu
مثال (3) :
احسب الكتلة الجزيئية لجزيءالماء (HNO3) علمًا بأن الكتل الذرية للعناصر هي :
(H = 1, O = 16, N = 14)
الحل :
Mm = Am H x N + Am N x N + Am O x N
Mm = (1 X 1) + (1 X 14) + (3 x 16)
Mm = 1 +14 + 48
Mm = 63 amu
مثال (4) :
احسب الكتلة الجزيئية لسكر الغلوكوز (C6H12O6) علمًا بأن الكتل الذرية للعناصر هي :
(H = 1, O = 16, C = 12)
الحل :
Mm = Am C x N + Am H x N + Am O x N
Mm = (6 X 12) + (12 X 1) + (6 x 16)
Mm = 72 +12 + 96
Mm = 180 amu
- كتلة الصيغة : Formula Mass (Fm)
- المركب الأيوني : هو إرتباط الأيونات الموجبة والسالبة بروابط أيونية .
- ملاحظة : تسمى الصيغة الكيميائية للمركب الأيوني بـوحدة الصيغة الكيميائية للمركب الأيوني.
- وحدة الصيغة الكيميائية : هي أبسط نسبة للأيونات في المركب الأيوني .
- كتلة الصيغة النسبية : (Relative Formula Mass (Fm :
- تعريفها : هي مجموع الكتل الذرية للعناصر في وحدة الصيغة وتقاس بوحدة amu
- حسابها : يمكن حسابها بنفس الطريقة التي يتم من خلالها حساب الكتلة الجزيئية وذلك من خلال القانون الأتي :
كتلةالصيغة (Fm) = ( الكتلة الذرية للعنصر الأول × عدد ذراته في المركب ) + ( الكتلة الذرية للعنصر الثاني × عدد ذراته في المركب)
- ويعبر عنه بالرموز بالصورة الاتية :
Fm = Am1 x N + Am2 x N
مثال (5) :
احسب كتلة الصيغة النسبية للمركب (Al(NO3)3) علمًا بأن الكتل الذرية للعناصر هي
(Al = 27, O = 16, N = 14)
الحل :
يلاحظ من صيغة المركب أنها تحتوي على 9 ذرات من الأكسجين (O)، و 3 ذرات نيتروجين (N)، وذرة ألمنيوم (Al)
Fm = Am Al x N + Am N x N + Am O x N
Fm = (27 X 1) + (14 X 3) + (16 x 9)
Fm = 27 + 42 + 144
Fm = 213 amu
سؤال (1) :
أحسب كتلة الصيغة للمركب NaCl علمًا بأن الكتل الذرية للعناصر هي :
(Na = 23, Cl= 35.5)
الحل :
Fm = Am Na x N + Am Cl x N
Fm = (1 X 23) + (1 X 35.5)
Fm = 23 + 35.5
Fm = 58.5 amu
- المول : The Mole
- المول : وهو الوحدة الدولية المستخدمة في قياس كمية المادة ويساوي عدد ذرات C12 الموجودة في 12g منه .
- توصل العالم الفيزيائي أفوغادرو إلى أن :
- المول الواحد من المادة يحوي 6.022 x 1023 من الذرات أو الجزيئات أو الأيونات أو وحدات الصيغة .
- سمي العدد الذي توصل إليه أفوغادرو بــ عدد أفوغادرو تكريمًا له ويرمز له بالرمز) NA)
ملاحظة (1) : يختلف المول الواحد لكل من الحديد وملح الطعام والماء مثلًا في الجسيمات التي يتكون منها كما هو موضح في الشكل الأتي الذي يبين مول واحد من مواد مختلفة

- نلاحظ أن كتلة المول الواحد من المواد تختلف لكنها تحتوي على العدد نفسه من جسيمات N الذي يساوي عدد أفوغادرو مثلًا :
- كتلة مول من الهيليوم تساوي 4g ، وكتلة مول من الأكسجين تساوي 32g ، وكتلة مول من النيتروجين تساوي 28g
- ملاحظة (2) :
- الكتل الذرية لذرات العناصر المختلفة تحتوي على عدد أفوغادرو من الذرات فمثلاً:
- عدد الذرات الموجودة في 23g من الصوديوم يساوي عدد الذرات الموجودة في 27g من الألمنيوم ويساوي عدد أفوغادرو وهو 6.022 x 1023
- لذلك : أصطلح على إستخدام مفهوم الكتلة المولية للدلالة على كتلة مول واحد من المادة.
- الكتلة المولية : Molar Mass (Mr)
- هي مفهوم أصطلح على إستخدامه للدلالة على كتلة مول واحد من المادة
- يرمز لها بالرمز (Mr)
- تقاس بوحدة ( g/mol)
- حيث أن : كتلة المول الواحد من ذرات العنصر تسمى بــ الكتلة المولية للعنصر : وهي تمثل عدديًا كتلته الذرية مقيسةً بوحدة g
- مثلًا : إن مول واحدًا من ذرات عنصر المغنيسيوم يحوي عدد أفوغادرو من ذرات المغنيسيوم وكتلته 24g .
- يرتبط عدد المولات (n) Moles بعلاقة رياضية مع عدد أفوغادرو (NA) وعدد الجسيمات (N) من الذرات أو الجزيئات أو وحدات الصيغة بالشكل الأتي :
- يرتبط عدد مولات المادة (n)، بكتلة المادة (m) مقيسةً بوحدة g وكتلتها المولية (Mr) بعلاقة رياضية بالشكل الأتي :
مثال (6) :
احسب عدد مولات (n) الكربون التي تحتوي على 3.01 x 1023 ذرةِ
الحل :
مثال (7) :
احسب عدد الجزيئات (N) الموجودة في 3 مول من غاز الميثان CH4 .
الحل :
N = n x NA
N = 3 x 6.022 x 1023
atom N = 1.806 x 1024
مثال (8) :
احسب كتلة 4 مول من جزيئات H2O، علمًا بأن الكتلة الذرية لكل من :H = 1, O = 16 ))
الحل :
في البداية نحسب الكتلة المولية Mr للجزيء، بنفس طريقة حساب الكتلة الجزيئية له ومن ثم نضرب الناتج بعدد المولات
Mr = Am O x N + Am H x N
Mr = (2 x 1 ) + (1 x 16)
Mr = 2 + 16
Mr = 18 g/mol
M = 4 x 18
M = 72 g
سؤال (2) :
احسب عدد ذرات (N) عنصر البوتاسيوم K الموجودة في 1 x 103 mol من العنصر:
الحل :
N = n x NA
N = 1 x 103 x 6.022 x 1023
N = 6.022 x 1026 atom
سؤال (3) :
عينة من مركب ما كتلتها 4g، والكتلة المولية Mr للمركب تساوي 40 g/mol فما عدد المولات n :
الحل :
مثال (9) :
احسب الكتلة المولية لمركب CaCO3 علمًا بأن الكتل الذرية للعناصر هي : (Ca = 40, C = 12, O = 16)
الحل :
Mr = (1 x 40 ) + (1 x 12) + ( 3 x 16) Mr = 100 g/mol