- المفاهيم والمصطلحات :
عزيزي الطالب ستتعرف في هذا الدرس على هذه المفاهيم والمصطلحات العلمية :
|
السعة الحرارية |
Heat Capacity |
|
الحرارة النوعية |
Specific Heat |
|
حالة المادة |
Matter State |
|
المُسعر |
Calorimetry |
|
الحرارة الممتصة |
Heat Absorbed |
|
الحرارة المنبعثة |
Heat Emitted |
الطاقة الممتصة والمنبعثة من المادة(Absorbed and Emitted Energy of Matter) :
- تبادل الطاقة بين المادة والمحيط : (Energy Exchange between Matter and the Sorrounding)
- تتبادل المواد المختلفة الحرارة مع الوسط المحيط بها حيث:
* تنتقل الحرارة عادةً من المادة ذات درجة الحرارة العليا إلى المادة ذات درجة الحرارة الدنيا، مثل :
* عند تسخين كأس تحتوي كمية من الماء فإن الماء سوف ترتفع درجة حرارته وعند وضع الكأس في الهواء لفترة وجيزة سوف تنخفض درجة حرارة الماء بداخله .
* ويرجع السبب في ذلك إلى أنه :
قد فقد كمية من طاقته الحرارية وإنتقلت إلى الوسط المحيط به (الهواء) مما يسبب إنخفاضًا في درجة حرارة الماء والشكل الأتي يبين عملية التبادل للحرارة بين المواد والوسط المحيط بها :

- تعد تفاعلات إحتراق الوقود من التفاعلات الطاردة للطاقة الحرارية فمثلأ:
- عند تسخين كمية معينة من الماء بإستخدام البرافين السائل (الكاز)، فإن الحرارة الناتجة عن الإحتراق سوف تنتقل إلى الماء مسببة رفع درجة حرارته كما في الشكل الأتي الذي يبين قياس الحرارة الناتجة عن إحتراق الوقود :
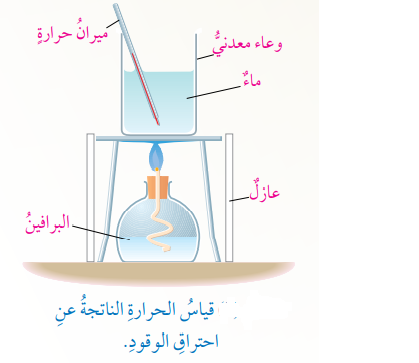
- إن إرتفاع درجة الحرارة للماء خلال فترة زمنية معينة من التسخين يعد مؤشرًا على كمية الحرارة الناتجة عن الإحتراق مع مراعاة أن جزءًا قليلًا من الحرارة الناتجة عن الإحتراق سوف ينتقل إلى الهواء المحيط .
- تختلف كمية الحرارة الناتجة عن الإحتراق بإختلاف نوع الوقود المستخدم.
- تختلف المواد في قدرتها على إمتصاص الحرارة بإختلاف نوع المادة وطبيعتها.
- السعة الحرارية : (Capacity Heat)
تعريفها : هي كمية الحرارة اللازمة لرفع درجة حرارة المادة درجة سيليوس واحدة.
رمزها: (C)
وحدة قياسها: جول/درجة سيليوس(J/ Cᵒ)
- تعتمد السعة الحرارية على كتلة المادة ومقدار التغير في درجة الحرارتها
- يمكن قياس كمية الحرارة التي تمتصها المادة عند تسخينها أو التي تنبعث منها عند تبريدها من خلال العلاقة الآتية :
q = C. Δt حيث أن :
q: هي كمية الحرارة الممتصة أو المنبعثة وتقاس بوحدة الجول (J)
C: السعة الحرارية للمادة وتقاس بوحدة جول/درجة سيليزية (J/ Cᵒ)
Δt: التغير في درجة الحرارة وتساوي ( درجة الحرارة النهائية – درجة الحرارة البدائية )
- الحرارة النوعية : (Specific Heat)
تعريفها : هي كمية الحرارة اللازمة لرفع درجة حرارة غرام واحد من المادة درجة سيليزية واحدة عند ضغط ثابت
رمزها : (S)
وحدة قياسها: جول/غرام .درجة سيليزية (J/g. Cᵒ)
- تعد الحرارة النوعية من الخصائص المميزة للمادة
مثال (1):
الحرارة النوعية للماء تساوي (4.18 J/g. Cᵒ) وهذا يعني أنه:
" لرفع درجة حرارة غرام واحد من الماء درجة سيليزية واحدة فإن الغرام الواحد يمتص طاقة حرارية مقدارها 4.18J"
مثال (2):
الحرارة النوعية للحديد تساوي (0.45 J/g. Cᵒ) وهذا يعني أنه:
" لرفع درجة حرارة غرام واحد من الحديد درجة سيليزية واحدة فإنه يمتص طاقة حرارية مقدارها 0.45 J وهذا أقل بكثير من الحرارة التي يمتصها الماء لتزداد درجة حرارته درجة سيليزية واحدة "
ملاحظة :
كلما قلت الحرارة النوعية للمادة فإنها تمتص كميات قليلة من الحرارة تؤدي إلى زيادة ملحوظة في درجة حرارتها.
مثال (3): علل:
عند تسخين وعاء من الحديد أو الألمنيوم يحتوي على كمية من الماء لفترة وجيزة يلاحظ أن درج حرارة طرف الوعاء البعيدة عن الماء ترتفع بدرجة أعلى بكثير من درجة حرارة الماء بداخله :
الإجابة :
السبب في ذلك هو أن الحرارة النوعية للفلزات بصفة عامة أقل (أدنى) بكثير من الحرارة النوعية للماء مما يجعلها تكتسب حرارة أكبر بكثير مما يكتسب الماء والجدول الأتي يبين الحرارة النوعية لبعض المواد عند درجة الحرارة C25
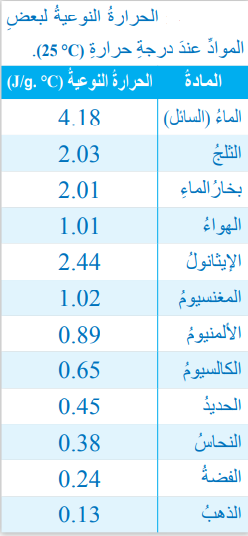
- نلاحظ أن الحرارة النوعية للماء أكبر من الحرارة النوعية الفلزات .
- قياس الحرارة النوعية للمادة :
الجهاز المستخدم للقياس : المسعر الحراري (Calorimetry)
- المسعر الحراري (Calorimetry):
- تعريفه : وهو وعاء معزول حراريًا يستخدم لقياس كمية الطاقة الممتصة أو المنبعثة من تفاعل كيميائي أو تحول فيزيائي .
- طريقة عمله : توضع فيه كمية معلومة من الماء تعمل على إمتصاص الحرارة الناتجة من التفاعل أو تزويد التفاعل بالحرارة .
- طريقة القياس: يمكن قياس التغير في درجة حرارة الماء بإعتبارها تمثل التغير في درجة حرارة التفاعل بهذه الطريقة يمكن قياس الحرارة الممتصة أو المنبعثة وبالتالي قياس الحرارة النوعية.
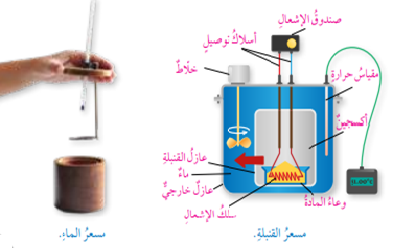
- أنواعه وأشكاله : ( مُسعر القنبلة، مُسعر الماء، مُسعر الثلج ، مُسعر التكثيف وغيرها )
الشكل الأتي يمثل مُسعر القنبلة ومُسعر الماء :
سؤال(1):
لماذا تبقى درجة جسم الإنسان السطحية ثابتة تقريبًا (C37( رغم تعرضه لتقلبات الحرارة اليومية :
الإجابة :
لأن (70%) من كتلة الجسم تتكون من الماء ونظرًا لإرتفاع الحرارة النوعية للماء، فإن تأثره بالحرارة يكون قليلًا، ومن ثم فإن جسم الإنسان لا يتأثر بتغيرات الحرارة كباقي المواد.
- حساب كمية الحرارة الممتصة أو المنبعثة :
- إن قدرة الفلزات على إمتصاص الحرارة وتوصيلها أكبر بكثيرمن قدرة الماء لأن الماء له حرارة نوعية أكبر من الفلزات ، فمثلًا :
- عند تعريض كتلة من الماء وقطعة من الحديد أو الألمنيوم لهما الكتلة نفسها لأشعة الشمس لمدة محددة نجد أن:
- قطعة الحديد أو الألمنيوم ترتفع درجة حرارتها أضعاف ما ترتفع إليه كتلة الماء وهذا يعني أنها تمتصكمية من الحرارة أكبر من تلك التي تمتصها كتلة الماء، أي أن كمية الحرارة الممتصة تعتمد على الحرارة النوعية للمادة والتغير في درجة الحرارة وكتلة المادة .
- يمكن حساب كمية الحرارة التي تمتصها المادة نتيجة تعرضها للحرارة من العلاقة الأتية :
q= S. M. Δt حيث أن:
q: هي كمية الحرارة الممتصة أو المفقودة وتقاس بوحدة الجول (J)
S: هي الحرارة النوعية للمادة وتقاس بوحدة (جول/غرام. درجة سيليزية) (oJ/g. C)
M: هي كتلة المادة وتقاس بوحدة الغرام (g)
Δt: هي التغير في درجة الحرارة (درجة الحرارة النهائية – درجة الحرارة البدائية) وتقاس بوحدة (C)
t2 – t1 = Δt
مثال (4):
جرى تسخين (20g) من الماء من (25C) إلى (C30)، أحسب كمية الحرارة التي إمتصتها هذه الكتلة من الماء، علمًا بأن الحرارة النوعية للماء تساوي J/g. Cᵒ4.18 :
الحل :
المعطيات :
M = 20 g
S = 4.18 J/g. Cᵒ
t2 – t1 = Δt
30 – 25 = Δt
5 Cᵒ = Δt
الحل :
q= S. M. Δt
q= 4.18 x 20 x 5
q= 418 J
مثال (5):
سخنت قطعة من الحديد كتلتها (50g) فارتفعت درجة حرارتها من (25 Cᵒ) إلى (40 Cᵒ) ، أحسب كمية الحرارة التي إمتصتها هذه الكتلة من الحديد : علمًا بأن الحرارة النوعية للحديد تساوي (0.45 J/g. Cᵒ)
الحل :
المعطيات :
M = 50 g
S = 0.45 J/g. Cᵒ
t2 – t1 = Δt
40 – 25 = Δt
15 Cᵒ = Δt
الحل :
q= S. M. Δt
q= 0.45 x 50 x 15
q= 337. 5 J
ملاحظة :
- عند تبريد المادة و خفض درجة حرارتها فإنها ستفقد الطاقة الحرارية إلى الوسط المحيط .
- تعتمد كمية الطاقة المنبعثة (المفقودة) على التغير في درجة حرارة المادة وكتلتها .
- الطاقة المنبعثة (المفقودة) تكون مساوية لكمية الحرارة الممتصة عند الظروف نفسها .
- يمكن حساب الطاقة المفقودة (المنبعثة) من خلال العلاقة السابقة لكن الفارق في هذه العلاقة أن كمية الحرارة في هذه الحالة ستتخذ إشارة سالبة، وهذا يعني أن الحرارة منبعثة من المادة .
مثال (6):
وضعت قطعة من النحاس كتلتها (5g) ودرجة حرارتها (25 Cᵒ) في حوض ماء بارد، فإنخفضت درجة حرارتها إلى (15 Cᵒ)، أحسب كمية الحرارة المنبعثة من هذه القطعة :علمًا بأن الحرارة النوعية للنحاس تساوي (0.38 J/g. Cᵒ)
الحل :
المعطيات :
M = 5 g
S = 0.38 J/g. Cᵒ
t2 – t1 = Δt
15 – 25 = Δt
-10 Cᵒ = Δt
الحل :
q= S. M. Δt
q= 0.38 x 5 x -10
q= -19 J
والإشارة السالبة هنا تدل على أن الطاقة منبعثة
سؤال(2):
قطعة من الألمنيوم كتلتها (150g)، ما كمية الحرارة اللازمة لرفع درجة حرارتها (30 Cᵒ)؟ علمًا بأن الحرارة النوعية للألمنيوم تساوي (0.89 J/g. Cᵒ)
الإجابة :
|
المعطيات : M = 150 g S = 0.89 J/g. Cᵒ t2 – t1 = Δt 30 – 0 = Δt 30 Cᵒ = Δt |
الحل :
q= S. M. Δt q= 0.89 x 150 x 30 q= 4005 J |
سؤال(3):
عُرضت قطعة من الفضة كتلتها ( 50g) ودرجة حرارتها (45 Cᵒ) لتيار هواء بارد، فانطلقت كمية من الحرارة مقدارها (240 J)، فكم تكون درجة حرارتها النهائية : علمًا بأن الحرارة النوعية للفضة تساوي (0.24 J/g. Cᵒ):
الإجابة :
|
المعطيات : M = 50 g S = 0.24 J/g. Cᵒ ???? = Δt -240 J = q الإشارة السالبة هنا للدلالة على أن الطاقة منبعثة
المطلوب : حساب درجة الحرارة النهائية
|
الحل :
q= S. M. Δt 240= 0.24 x 50 x Δt-
Δt= -20 Cᵒ t2 – t1 = Δt t2 – 45 = 20- 45 t2 = -20 + 25 Cᵒ t2 |
- الربط مع علوم الأرض : نسيم البر ونسيم البحر
- نسيم البحر :
- يحدث نسيم البحر : بسبب إختلاف تسخين أشعة الشمس لكل من ماء البحر، واليابسة المجاورة.
- بما أن الحرارة النوعية لليابسة أقل من الحرارة النوعية لماء البحر :
- فإن اليابسة تمتص كمية من الحرارة أكثر من الحرارة التي يمتصها الماء وتسخن بسرعة أكبر من الماء وبالتالي يسخن الهواء الموجود فوق اليابسة أسرع من الهواء الموجود فوق الماء ويرتقع للأعلى ، ويسبب إنخفاضًا في الضغط الجوي فوق اليابسة مع بقاء الهواء فوق الماء أقل درجة حرارة ، وأكثر كثافة وأكثر ضغطًا؛ فيندفع نحو اليابسة على شكل تيارات هوائية تسمى بنسيم البحر ويحدث عادةً أثناء النهار أيام الصيف والربيع.

- نسيم البر :
- يحدث ليلًا :
- بسبب إرتفاع الحرارة النوعية للماء فإنه يفقد الحرارة ببطءٍ أكثر من اليابسة التي تفقد الحرارة بسرعة أكبر
تبقى درجة حرارة الهواء فوق الماء أكبر من الهواء فوق اليابسة ويرتفع للأعلى، ويقل الضغط الجوي فوق الماء، فيندفع الهواء البارد من اليابسة نحو البحر على شكل تيارات هوائية باردة تسمى بـنسيم البر .

- التجربة(2) : قياس الحرارة النوعية للنحاس
- المواد والأدوات المستخدمة :
- كأسان زجاجيتان بسعة 300 ml
- كأس بوليسترين
- ميزان حرارة كحولي
- ماسك معدني (ملقط)
- ميزان حساس
- ماء مقطر
- كرة نحاسية
- منصب
- لهب بنسن أو سخان كهربائي
- خطوات العمل :
- أزن الكرة النحاسية بإستخدام الميزان الحساس، وأسجل كتلتها
- أضيف إلى الكأس الزجاجية (100 ml) من الماء، وأضيف إليها الكرة النحاسية، وأضعها على اللهب أو السخان الكهربائي
- أُضيف إلى كأس البوليسترين (100 ml) من الماء، وأضعها في الكأس الزجاجية الفارغة، وأقيس درجة حرارة الماء (t1) وأسجلها .
- أُلاحظ غليان الماء في الكأس، وعندها أقيس درجة حرارة الكأس والكرة النحاسية (t2) وأُسجلها .
- أستخرج الكرة النحاسية من الماء بإستخدام الملقط، وأضعها في كأس البوليسترين، وأُسجل أعلى درة حرارة يصل إليها الماء (t3)
- أُلاحظ هل إرتفعت درجة حرارة الماء بعد وضع الكرة النحاسية فيه؟ أم إنخفضت؟
- أُنظم البيانات والقياسات في الجدول .
- أنظف مكان عملي وأغسل يديّ جيدًا بعد الإنتهاء من العمل .
- الهدف من التجربة :
تقدير الحرارة النوعية للنحاس عمليًا
- التحليل والإستنتاج:
1. أُحدد التغير في درجة حرارة الماء في كأس البوليسترين بعد إضافة الكرة النحاسية إليه. ماذا أستنتج؟
2. أُحدد التغير في درجة حرارة الكرة النحاسية بعد وضعها في كأس البوليسترين؟ ماذا أستنتج؟
3. أُبين العلاقة بين كمية الحرارة في الحالتين السابقتين
4. أستنتج الحرارة النوعية للنحاس
5. أُطابق النتيجة التي حصلت عليها مع القيمة المسجلة في الجدول، أُفسر سبب الإختلاف إن وجد.
- الملاحظات على التجربة :
1) ترتفع درجة حرارة الماء بعد وضع الكرة النحاسية فيه، وأستنتج أن الماء اكتسب الحرارة من الكرة النحاسية (المادة الأعلى درجة حرارة )
2) تنخفض درجة حرارة الكرة النحاسية، أستنتج أن الحرارة إنتقلت من المادة الأعلى درجة حرارة إلى الوسط المحيط (الماء الأدنى درجة حرارة )
3) كمية الحرارة التي تفقدها الكرة النحاسية تساوي كمية الحرارة التي يكتسبها الماء
4) إستنتاج الحرارة النوعية للنحاس :
لاحظ أن كمية الحرارة التي يكتسبها الماء تساوي كمية الحرارة التي تفقدها الكرة النحاسية، أي أن :
وبتطبيق البيانات التي تم الحصول عليها بالتجربة في العلاقة السابقة، يمكن حساب الحرارة النوعية للنحاء حيث :
يتوقع أن تحصل على نتيجة قريبة من القيمة (0.38J/g. Cᵒ) المسجلة في الجدول، ويعود سبب الإختلاف بين القيمتين إلى أخطاء في القياس . وعادةً تُجرى الكثير من التجارب، وتقدر الحرارة النوعية بالمتوسط الحسابي لنتائج تلك التجارب.