- المفاهيم والمصطلحات :
عزيزي الطالب ستتعرف في هذا الدرس على هذه المفاهيم والمصطلحات العلمية :
|
المركبات الأيونية |
Ionic Compound |
|
المركبات التساهمية (الجزيئية) |
Covalent (molecular) Compound |
|
الرموز |
Symbols |
|
الصيغ الكيميائية |
Chemical Formula |
- الخصائص الفيزيائية للمركبات الأيونية: Physical Properties of Ionic Compounds)) :
- تسمى المركبات التي تحتوي على روابط أيونية بـ (المركبات الأيونية )
- توجد المركبات الأيونية على شكل بلورات صلبة تترتب في شبكة بلورية
-- من أشهر الأمثلة على المركبات الأيونية هو : ملح الطعام (NaCl)
حيث : يحاط الأيون الموجب للصوديوم بستة أيونات سالبة للكلرويد، وكذلك يحاط الأيون السالب للكلوريد بستة أيونات موجبة للصوديوم، ما يكسب المركب الأيوني القوة والصلابة، علمًا بأن : شكل بلورة كلوريد الصوديوم مكعب كما تظهر في الشكل الآتي :
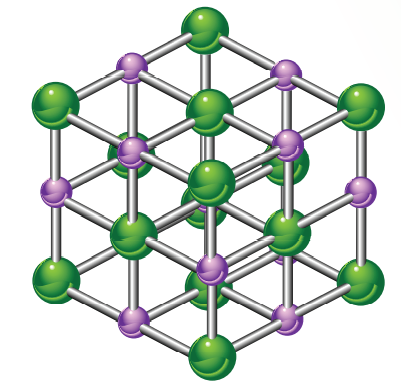
سؤال (1) :
أُفسر النسبة بين أيونات الصوديوم إلى أيونات الكلوريد في البلورة :
الإجابة :
النسبة هي ( 1:1 ) لأن كل أيون صوديوم موجب محاط بستة أيونات كلوريد سالبة وكل أيون كلوريد سالبة محاط بستة أيونات صوديوم موجبة وبهذا تكون النسبة بين الأيونين هي (1:1)
- خصائص البلورات الصلبة لهذه المركبات أنها بلورات :
1) قاسية (Hard) : والسبب هو :
قوة التجاذب بين الأيونات الموجبة والأيونات السالبة في البلورة (قوة الرابطة الأيونية )، فيصعب الفصل بين هذه الأيونات .
2) هشة (Brittle) : أي سهلة الكسر والسبب هو :
إقتراب الأيونات المتماثلة في الشحنة من بعضها البعض عند الضغط على البلورة فتتنافر مبتعدة عن بعضها ما يسهل عملية كسر البلورة وتفتيتها.
3) إرتفاع درجات إنصهارها وغليانها (Melting and Boiling Points) وذلك لأن :
التغلب على قوى التجاذب بين الأيونات الموجبة والسالبة يتطلب وجود طاقة كبيرة والجدول الآتي يبين درجات الإنصهار والغليان لمركبي NaCl و MgO

- يلاحظ من الجدول أن درجتي الإنصهار والغليان لمركب MgO الذي يحمل الشحنات Mg2+ O2- أعلى منها للمركب NaCl الذي يحمل الشحنات Na+ Cl- لأن زيادة الشحنات على الأيونات تؤدي إلى زيادة الشحنات على الأيونات تؤدي إلى زيادة قوة التجاذب بينها فتحتاج إلى طاقة أكبر للتغلب عليها .
4) الذائبية (Solubility) العالية في الماء :
تذوب بسهولة بسبب قدرة جزيئات الماء على عمل تجاذب مع أيونات البلورة ما يؤدي إلى فصل الأيونات عن البلورة، فتصبح حرة الحركة بين الجزيئات، والشكل الآتي يبين ذوبان المركب الأيوني في الماء :
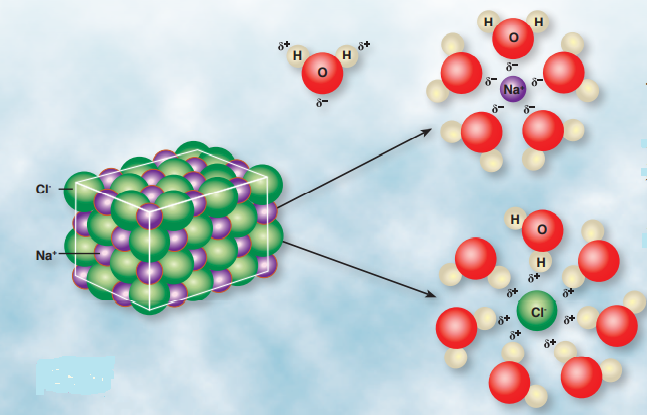
سؤال (2) :
أٌفسر أثر الشحنات على جزيء الماء في ذوبان المركب الأيوني
الإجابة :
ينشأ تجاذب بين الأقطاب المشحونة في الماء والأيونات المخالفة لها بالشحنة؛ ما يؤدي إلى إنفصال هذه الأيونات عن البلورة وتحررها، وتصبح حرة الحركة في الحلول .
سؤال (3) :
ما الفرق بين الذوبان والإنصهار :
الإجابة:
الذوبان : يحدث بين مادتين حيث تحفز الأولى ذوبان المادة الأخرى والخليط الناتج يتضمن كلا المادتين
الإنصهار : تحول مادة واحدة فقط من الحالة الصلبة إلى الحالة السائلة بفعل الحرارة أو أي عامل أخر من العوامل مؤثرة على الإنصهار
- ينتج من عملية الإنصهار سائل مكون من مادة واحدة فقط ، بينما ينتج عن الذوبان سائل مكون مادة مذابة ومادة مذيبة سائلة حتى لو لم تظهر المادة المذابة .
5) التوصيل الكهربائي للمركبات الأيونية :
التجربة الآتية توضح التوصيل الكهرابئي للمركبات الأيونية :
- التجربة (1) : التوصيل الكهربائي للمركبات الأيونية
- المواد والأدوات المستخدمة :
- ملح الطعام NaCl
- ماء
- دارة كهربائية
- كأس زجاجية
- وعاء
- خطوات العمل :
- أُكون دارة كهربائية موصولة إلى قطبي جرافيت
- أضع 50g من ملح الطعام في وعاء ثم أغمس قطبي الجرافيت في الملح ملاحظًا ما يحدث للمصباح الكهربائي في الدارة
- أُذيب 50g من ملح الطعام في كأس زجاجية مملوءة حتى منتصفها بالماء، ثم أغمس قطبي الجرافيت في المحلول، ملاحظًا ما يحدث للمصباح الكهربائي في الدارة.
- الهدف من التجربة :
استقصاء خاصية التوصيل الكهربائي في المركبات الأيونية
- التحليل والإستنتاج:
1. في أي الحالتين أضاء المصباح
2. أُفسر ملاحظاتي :
- الملاحظات على التجربة :
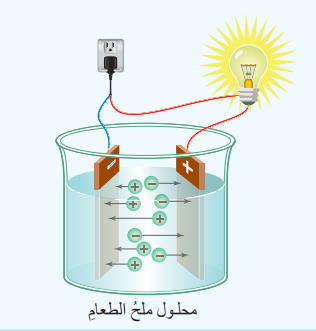
1) في حالة المحلول
2) عند ذوبان المركب الأيوني في الماء تتحرر الأيونات التي كانت مقيدة الحركة، وتصبح قادرة على حركة بحرية، ما يجعلها قادرة على توصيل الكهرباء للتيار .
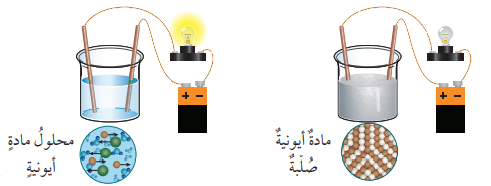
- نلاحظ من التجربة السابقة أن المركبات الأيونية تكون غير موصلة للتيار الكهربائي وهي بالحالة الصلبة بسبب قوى التجاذب القوية بين الأيونات المختلفة في شحناتها مما يجعل هذه الأيونات مقيدة في أماكنها في البلورة ويمنع حركتها .
- أما المحاليل (أو مصاهير) هذه المركبات تكون موصلة للتيار الكهربائي بصورة جيدة، نظرًا إلى تفكك البلورات عند صهرها أو إذابتها في الماء فتصبح الأيونات حرة الحركة
- الشكل الآتي : يبين التوصيل الكهربائي للمركب الأيوني :
- الربط مع الحياة :
أكسيد المغنيسيوم MgO :
يستخدم مركب أكسيد المغنيسيوم MgO على نطاق واسع في الصناعات المتعلقة بأعمال البناء؛ إذ يدخل في صناعة الإسمنت، ومواد المقاومة للحرائق مثل الطوب الحراري، نظرًا إلى إرتفاع درجة إنصهاره التي قد تصل إلى درجة أكبر من 2800 C°
- الخصائص الفيزيائية للمركبات التساهمية : Physical Properties of molecular Compounds)) :
- تسمى المواد التي تحتوي على روابط تساهمية بـ (المركبات التساهمية الجزيئية)(Covalent (molecular) Compound )
- توجد هذه المركبات بإحدى الحالات الفيزيائية الثلاث ( الصلبة، السائلة، الغازية )
- تمتلك المركبات التساهمية البسيطة درجات انصهار وغليان منخفضة مقارنة بالمركبات الأيونية؛ ما يجعلها مركبات متطايرة Volatile
- تمتاز غالبية المركبات التساهمية بـــ:
1) عدم قابليتها للذوبان في الماء
2) عدم إحتواء محاليلها على أيونات ما يجعلها غير موصلة للتيار الكهربائي بوجه عام
ملاحظة (1):
بعض المركبات التساهمية مثل HCl يصبح موصلًا للتيار الكهربائي عند إذابته في الماء نظرًا لإحتواء محاليله على أيونات .
- النجربة الآتية توضح مثالًا على عدم قدرة المركبات التساهمية على التوصيل الكهربائي
- التجربة (2) : التوصيل الكهربائي للمركبات التساهمية
- المواد والأدوات المستخدمة :
- سكر الجلوكوز C6H12O6
- ماء
- دارة كهربائية
- كأس زجاجية
- وعاء
- سخان كهربائي
- خطوات العمل :
- أُكون دارة كهربائية موصولة إلى قطبي جرافيت
- أُلاحظ : أضع 50g من سكر الجلوكوز في وعاء ثم أغمس قطبي الجرافيت في السكر والاحظ ما يحدث للمصباح الكهربائي في الدارة
- أُلاحظ : أُذيب 50g من ملح الطعام في كأس زجاجية ، وأستعمل السخان الكهربائي لإذابة الكمية كلها من السكر إن لزم الأمر ، ثم أغمس قطبي الجرافيت في المحلول، والأحظ ما يحدث للمصباح الكهربائي في الدارة.
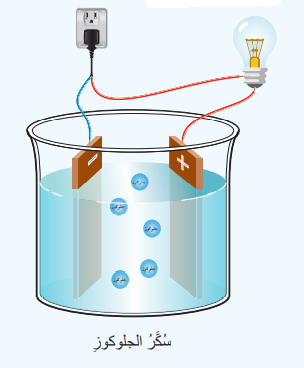
- الهدف من التجربة :
استقصاء خاصية التوصيل الكهربائي في المركبات التساهمية
- التحليل والإستنتاج:
1. هل أضاء المصباح في إحدى الحالتين
2. أُفسر ملاحظاتي :
- الملاحظات على التجربة :
1. لا، لم يضيء المصباح في كلتا الحالتين
2. المركبات التساهمية هي جزيئات غير متأينة، أي لا يوجد فيها أيونات
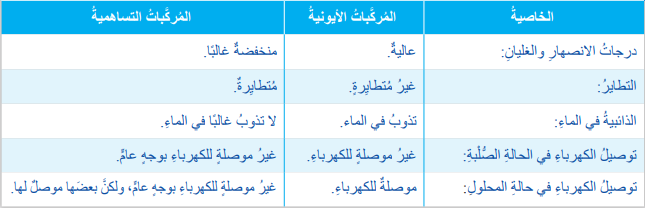
- الجدول الآتي يبين أوجه المقارنة بين المركبات الأيونية والمركبات التساهمية
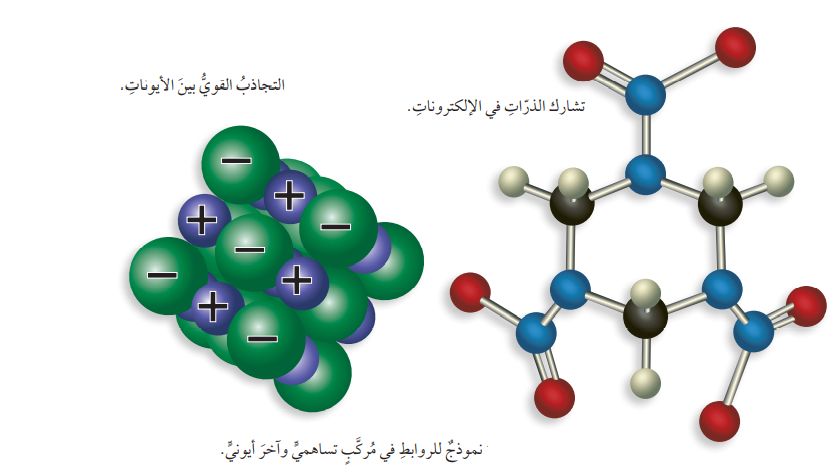
- الشكل الآتي يمثل نموذجًا للروابط في مركب تساهمي وأخر أيوني
- الخصائص الفيزيائية للفلزات : Physical Properties for Metal)) :
- الفلزات هي مواد صلبة ( بإستثناء الزئبق فهو سائل) وتمتاز الفلزات بأنها:
1) لامعة (Shiny)
2) قابلة للطرق (Malleable) والسحب (Ductile)
فعند طرق فلز ما تتكون الصفائح وعند سحبه تتكون الأسلاك
وهذا يعني أن بلورات الفلز لا تتكسر، لأن صفوف الأيونات الموجبة ينزلق بعضها عن بعض لكنها تضل في بحر الإلكترونات نفسه . والشكل الآتي يبين أن الفلزات قابلة للطرق والسحب:
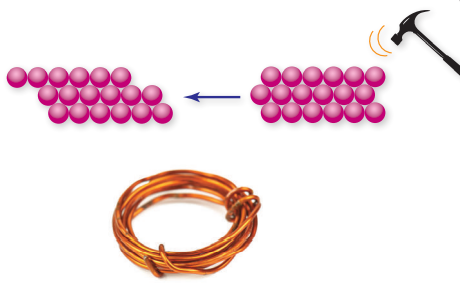
3) الفلزات موصلة جيدة للتيار الكهربائي والحرارة (Conductors of Electricity and Heat) نظرًا إلى حركة الإلكترونات الحرة في بلورة الفلز.
سؤال (4) :
أٌفسر ما يأتي : الفلزات قابلة للطرق والسحب :
الإجابة:
لأن صفوف الأيونات الموجبة ينزلق بعضها عن بعض لكنها تضل في بحر الإلكترونات نفسه
الربط مع الصحة:
إستخدم أطباء الأسنان منذ القدم مزيجًا مكونًا من فلزات مختلفة مثل: النحاس، والفضة، والقصدير، والزئبق؛ لحشو فجوات الأسنان. ونظرًا إلى ما تسببه أبخرة الزئبق السامة من ضرر بالصحة، فقد منع إستخدامه في طب الأسنان، وأستعيض عنه بمزيج من الصمغ والبورسلان بوصفه بديلًا أمنًا.
أما في مجال تقويم الأسنان : فاستخدمت سبائك من النيكل والتيتانيوم لأنها لا تصدأ ولا تتأكل.
- الصيغ الكيميائية للمركبات : Chemical Formula For Compounds)) :
- تستعمل الرموز والصيغ الكيميائية للتعبير عن المواد الكيميائية وتعرف بإسم الرموز Symbols
تعريف الرموز Symbols: هي طريقة لتمثيل ذرات العناصر ، والجدول الآتي يبين أسماء بعض العناصر وشحنة الأيون وإلكترون التكافؤ :
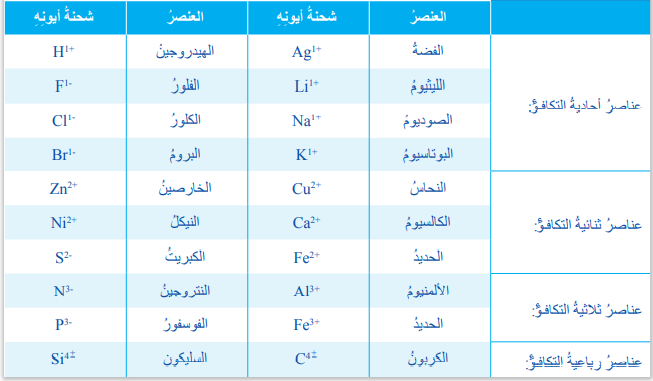
- يلاحظ من الجدول أن :
تكافؤ العنصر يساوي عدد الإلكترونات التي تفقدها الذرة أو تكتسبها، أو تشارك فيها، وأنه يساوي شحنته عدديًا.
- تعريف الصيغ الكيميائية : هي طريقة موجزة للتعبير عن عدد ذرات العناصر ونوعها، التي يتكون منها أي مركب كيميائي.
مثلًا :
مركب MgCl2 يتكون من عنصري المغنيسيوم Mg والكلورCl ويسمى هذا المركب من خلال كتابة إسم الأيون السالب (Cl- الكلوريد) ثم إسم الأيون الموجب (Mg2+ مغنيسيوم) لذا يسمى مركب MgCl2 بـ كلوريد المغنيسيوم.
- -- - الجدول الآتي يبين المجموعات الأيونية وشحنتها وتكافؤ كل منها :
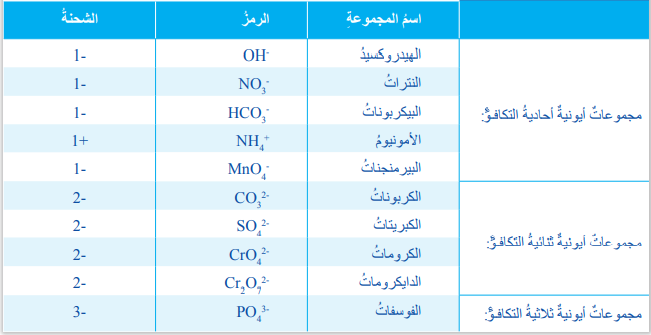
- يلاحظ من الجدول أن :
- بعض الأيونات تحتوي على أكثر من نوع واحد من الذرات ( متعددة الذرات) وتعرف بإسم المجموعات الأيونية، وينظر إليها بوصفها وحدة واحدة كما في رموز العناصر.
- ترتبط الذرات في المجموعات الأيونية بروابط تساهمية، في حين ترتبط بالأيونات الأخرى بروابط أيونية.
- المجموعة الأيونية تسمى أولًا ثم يليها إسم الأيون الموجب.
- فمثلًا :
- يسمى مركب CaSO4 كبريتات الكالسيوم
- لذلك لمعرفة الصيغة الكيميائية يجب معرفة رموز العناصر التي يتكون منها وكذلك تكافؤ كل عنصر وشحنته.
- خطوات كتابة الصيغة الكيميائية لمركب ما؛ أيوني، أو جزيئي :
1) كتابة إسم المركب باللغة العربية.
2) كتابة رموز العناصر التي يتكون منها المركب تحت اسم كل عنصر .
3) كتابة رقم التكافؤ أسفل كل رمز .
4) استبدال رقم التكافؤ لأحد الرمزين بالأخر.
5) حذف أرقام التكافؤ في حال تساويها، أما إذا كان بينها قاسم مشترك فتجب القسمة على الرقم الأصغر للحصول على أبسط قيمة عددية صحيحة .
6) كتابة صيغة المركب النهائية.
مثال(1) :
أكتب الصيغة الكيميائية لمركب أكسيد الألمنيوم :
الإجابة :
1) إسم المركب : أكسيد الألمنيوم
2) رمز كل عنصر: O Al
3) رقم التكافؤ: 2 3
4) إستبدال رقم التكافؤ لأحد الرمزين بالأخر:
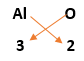
5) لا يوجد قاسم مشترك، ما يعني أن هذه الأرقام تمثل أبسط نسبة عددية صحيحة
6) صيغة المركب النهائية : Al2O3
مثال(2) :
أكتب الصيغة الكيميائية لمركب ثاني أكسيد الكربون :
الإجابة :
1) إسم المركب : ثاني أكسيد الكربون
2) رمز كل عنصر: O C
3) رقم التكافؤ: 2 4
4) إستبدال رقم التكافؤ لأحد الرمزين بالأخر:

5) القسمة على الرقم الأصغر، وهو في هذه الحالة (2)، للحصول على أبسط قيمة عددية صحيحة
6) صيغة المركب النهائية : CO2
مثال(3) :
أكتب الصيغة الكيميائية لمركب هيدروكسيد الكالسيوم :
الإجابة :
لكتابة الصيغة الكيميائية للمركبات التي تحتوي على المجموعات الأيونية تستخدم الطريقة نفسها:
1) إسم المركب : هيدروكسيد الكالسيوم
2) رمز كل عنصر: OH Ca
3) رقم التكافؤ: 1 2
4) إستبدال رقم التكافؤ لأحد الرمزين بالأخر:
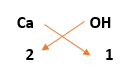
5) صيغة المركب النهائية: Ca(OH)2
- من الملاحظ أن مجموعة الهيدروكسيد قد وضعت داخل قوسين، لأن الرقم (2) يشير إلى عدد مجموعات (OH) لكن إذا وضعت الصيغة على شكل CaOH2 فإن الرقم (2) يشير إلى عدد ذرات الهيدروجين فقط وهذا خطأ.
- إذا كان للعنصر أكثر من تكافؤ فتستخدم أرقام خاصة للتمييز بينها، تسمى بالأرقم الاتينية (III, II, I)
- فمثلًا :
للحديد Fe أكثر من تكافؤ (2, 3)؛ لذلك يكتب الرقم الاتيني الذي يدل على تكافئه بعد إسم المركب فثلًا :
أكسيد الحديد (II) : يدل على أن تكافؤ الحديد في هذا المركب هو 2
أكسيد الحديد (III) : يدل على أن تكافؤ الحديد في هذا المركب هو 3
سؤال (5) :
أكتب الصيغة الكيميائية للمركبات الآتية :
- كبريتات الصوديوم
- فوسفات الكالسيوم
- نتريد المغنيسيوم
الإجابة:
- كبريتات الصوديوم : Na2SO4
- فوسفات الكالسيوم : Ca3(PO4)2
- نتريد المغنيسيوم : Mg(NO3)2
- الربط بالحياة: المركبات الأيونية :
توجد في الطبيعة خامات عديدة للمركبات الأيونية، حيث تنظم الأيونات المكونة للمركبات في شبكة بلورية ضخمة تحافظ على تماسك البلورة، ويؤدي الإختلاف في شحنة الأيونات وحجومها إلى تكون بلورات مختلفة الأشكال ومن الأمثلة عليها :
- مركب الباريت (BaSO2)
- مركب البيرل (Be3Al2Si6O18)
- مركب الأرجونيت (CaCO3)
- مركب الهيماتيت (Fe2O3)
- مركب كبريتات النحاس (CuSO4)
- السالبة الكهربائية وأنواع الروابط الكيميائية : Electronegativity and Types of Chemical Bond))
- تذكر أن :
السالبية الكهربائية للذرة تصف قدرة الذرة على جذب إلكترونات الرابطة نحوها عند إرتباطها بذرة أخرى لذلك؛ فإن نوع الرابطة الكيميائية بين الذرتين يعتمد على مقدار الفرق في الكهروسلبية بين الذرتين
- الجدول الآتي يبين نوع الرابطة بحسب الفرق في السالبية الكهربائية بين الذرات وفقًا لمقياس باولينج الأكثر شيوعًا:
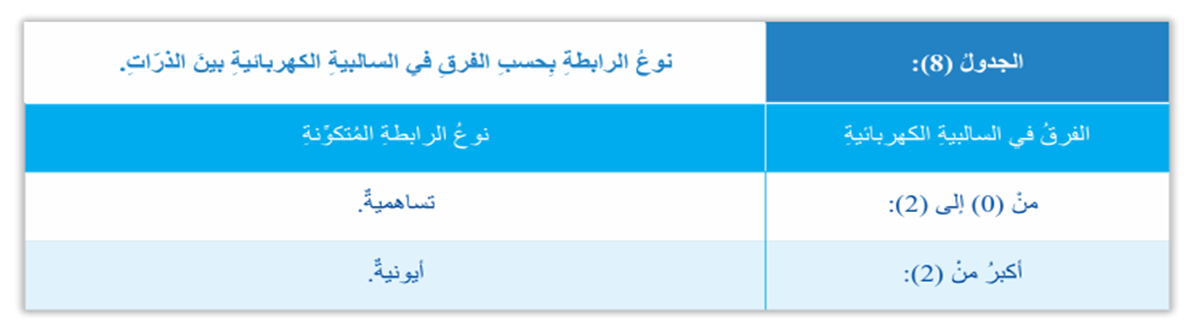
- في مقياس باولينج يكون عنصر الفلورF هو أعلى العناصر من حيث السالبية الكهربائية إذ تبلغ 4.1 ويكون عنصر الفرانسيوم Fr أقلها؛ إذ تبلغ 0.7، وتتراوح قيم السالبية الكهربائية للعناصر الباقية في الجدول الدوري بين هاتين القيميتين .
- يلاحظ من الجدول السابق أن الرابطة التساهمية تتكون عندما يتراوح الفرق في السالبية الكهربائية بين ذرتين مختلفتين بين (0) و (2) مثل : (HCl) و (HF) و (CO).
- في حال وجود ذرتين متشابهتين للعنصر نفسه مثل : N2, O2, Cl2 ، فإنه يكون للذرتين السالبية الكهربائية نفسها؛ أي أن الفرق في السالبية الكهربائية بينهما تساوي صفرًا وتكون الرابطة تساهمية أيضًا.
- إذا كان الفرق في السالبية الكهربائية بين الذرتين أكبر من 2 فإن الرابطة تكون أيونية.
سؤال (6) :
ما المقصود بالسالبية الكهربائية:
الإجابة:
السالبية الكهربائية : هي قدرة الذرة على جذب إلكترونات الرابطة نحوها عند إرتباطها بذرة أخرى
الإثراء والتوسع : السبائك Alloys:
- الفلزات النقية لينة جدًا، ونشطة كيميائيًا؛ لذا، فهي تتأكل عند تفاعلها مع المواد الأُخرى، ويتطلب استخدامها في أغراض معينة إضافة عنصر أو عناصر أخرى إلى العنصر الأصلي بنسب محددة لتحسين خصائصه التي فقدها فينتج ما يسمى بالسبائك .
- تعريف السبائك: هي خليط من فلز وعنصرٍ أخر على الأقل قد يكون فلزًا أو لا فلز.
- تمتاز السبائك بــصفات فريدة مثل :
-
( القوة والمتانة وخفة الوزن و تحمل درجات الحرارة العالية )
- هذه الصفات تجعل السبائك أهلًأ لإستخدامات عدة متنوعة من الأمثلة عليها :
-
*سبيكة الفولاذ والمنغنيز التي تتكون من فلز الحديد مضافًا إليه عنصر المنغنيز بنسبة تقدر بنحو 13، وهي تستخدم في صناعة الأتِ الحفر، والسكك الحديدية، لأنها تتحمل درجات حرارة العالية.
*سبيكة الفولاذ (الحديد الصلب) التي تصنع بإضافة نسب محددة من الكربون إلى الحديد ليصبح أكثر قوة وصلابة، وغير قابل للصد، وهي تستخدم في أعمال البناء.
- بوجه عام، فإن السبائك أكثر قوة وصلابة من فلزاتها الأساسية، ما جعلها تستخدم في الكثير من مجالات الحياة
