الذَّوبانُ Dissolving
- إذا تفحَّصْنا المكوِّناتِ المدوّنةَ على علبةِ الصابون نجدُ أنَّ الصّابونَ يتكوّنُ منْ عدّةِ مكوِّناتِ خُلِطَتْ معًا بانتظامٍ ونِسَبٍ محدّدةٍ، ويطلَقُ على هذا النوعِ منَ المَخاليطِ اسمُ المخلوطِ المتجانِسِ . Homogenous Mixture.
- منَ الأمثلةِ الأُخرى على المَخاليطِ المُتجانِسةِ السكَّرُ المُذابُ في الماءِ.
- إذ تنتشرُ جسيماتُ السكَّرِ بينَ جزيئاتِ الماءِ، وتتوزَّعُ بانتظامٍ، فتبدو كأنَّها اختفتْ؛ إذْ لا يمكنُ رؤيتُها. تُعرَفُ هذهِ العمليَّةُ بالذوبانِ Dissolving ؛ إذْ يذوبُ السكّرُ في الماءِ مُكَوِّنًا
ما يُعرَفُ بالمحلولِ Solution وهوَ مخلوطٌ متجانسٌ يتكوّنُ منْ مُذابٍ ومُذيبٍ، ويكونُ حجمُ جسيماتِ المُذابِ فيهِ صغيرًا جدًّا، ولا يمكنُ تمييزُهُ بالعينِ المجرّدةِ. - يُعرَفُ المذابُ Solute بأنَّهُ المادةُ التي تَتَفَكَّكُ جسيماتُها بعضُها عنْ بعضٍ، وتنتشرُ بينَ جزيئاتِ المذيبِ، وقدْ تكونُ صُلْبةً، أوْ سائلةً، أوْ غازِيَّةً.
- يُعرَفُ المذيب Solvent بأنَّهُ المادّةُ التي تعملُ على تفكيكِ جسيماتِ المُذابِ؛ ففي مَحلولِ السكّرِ والماءِ يكونُ الماءُ هوَ المذيبَ والسكّرُ هوَ المذابَ.
تركيزُ المحلولِ Concentration of Solution
- يُعَدُّ الماءُ مُذيبًا جيِّدًا لكثيرٍ منَ الموادِّ الصُّلْبةِ والسائلةِ والغازيّةِ.
- تسمّى المحاليلُ التي يكونُ الماءُ فيها مُذيبًا المحاليلَ المائيّةَ، ولها أهميةٌ كبيرةٌ في مجالاتِ التفاعلات والتطبيقاتِ الصناعيّةِ. فعندَ تفحُّصِ إحدى عُلبِ العصيرِ أوْ زجاجاتِ الماءِ ألاحظُ وجودَ معلوماتٍ عنِ الموادِّ المُذابَةِ فيهِ، ولكلٍّ منْها كمّيّةٌ محددّةٌ بالنسبةِ إلى المحلولِ.
- يُستخدَمُ مفهومُ تركيزِ المحلولِ Concentration of Solution للتعبيرِ عنِ العلاقةِ بينَ كمّيّتَيِ المُذابِ والمُذيبِ في المحلولِ.
- عندَ تحضيرِ المحاليلِ في الصناعاتِ المختلفةِ، فإنَّهُ منَ الضّروريِّ تحديدُ كمّيّتَيِ المُذابِ والمُذيبِ في المحلولِ لحسابِ تركيزِهِ.
- منَ الطرائقِ المستخدَمةِ لحسابِ تركيزِ المحاليلِ حسابُ نسبةِ كتلةِ المُذابِ بالغرامِ (g) إلى حجمِ المحلولِ بالملليترِ (mL)، وتكونُ وحدةُ التركيزِ (g/mL)، كما في العلاقةِ
الرياضيّةِ الآتيةِ: تركيزُ المحلولِ = كتلةَ المذابِ (g) / حجمِ المحلوِل (mL)
الذائبيةُ والعواملُ المؤثِّرةُ فيها Solubility & Affecting Factors
- عندَ أُضافُة كميّةً قليلةً منَ الملحِ إلى كأسٍ تحوي ماءً في درجةِ حرارةِ الغرفةِ فإنَّها تذوبُ فيهِ، وإذا أضفْتُ كميّاتٍ أخرى منَ الملحِ إلى الكأسِ نفسِها فإنَّ المحلولَ يصلُ إلى حدٍّ لا يمكنُهُ أنْ يذيبَ فيهِ أيَّ كميّاتٍ إضافيةٍ منَ الملحِ، ويُسمّى عندئذٍ المحلولَ المُشبَعَ ( Saturated Solution ).
- أمّا إذا أضفْتُ كميّةً أخرى منَ الملحِ إلى المحلولِ المُشبَعِ فإنَّها تترسَّبُ في قعرِ الكأسِ، ويُسمّى عندئذٍ المحلولَ فوقَ المُشبَعِ.
- تُسمّى أكبرُ كتلةٍ منَ المذابِ التي تذوبُ في ( 100g) منَ الماءِ عندَ درجةِ حرارةٍ معيّنةٍ الذائبيةَ Solubility
- تتأثّرُ ذائبيّةُ الموادِّ الصُّلْبةِ في الماءِ بعواملَ عدَّةٍ، منْها: درجةُ الحرارةِ، وطبيعةُ المادَّةِ.
درجةُ الحرارةِ Temperature
- عندَ إعدادِ محلولِ شرابِ السكّرِ(القَطْرِ) تُضافُ كمّيّةٌ كبيرةٌ منَ السكّرِ إلى حجمٍ محدَّدٍ منَ الماءِ.
- لتتمَّ عمليّةُ الذوبانِ يُسَخَّنُ المحلولُ؛ إذْ تزدادُ ذائبيّةُ معظمِ الموادِّ الصُّلْبةِ في الماءِ بارتفاعِ درجةِ الحرارةِ.
- عندَ تسخينِ المحلولِ تزدادُ حركةُ جزيئاتِ الماءِ؛ ما يزيدُ المسافاتِ والفراغاتِ بينَها، فتستوعبُ كميّاتٍ أكبرَ منْ جسيماتِ المذابِ التي تنتشرُ وتتوزَّعُ بانتظامٍ بينَ جزيئاتِ الماءِ في المحلولِ.
طبيعةُ المادّةِ Nature of Matter
- تختلفُ الموادُّ في ذائبيَّتِها باختلافِ طبيعةِ كلٍّ منْها؛ فلكلِّ مادةٍ ذائبيَّةٌ خاصَّةٌ بها.
- يمكنُ زيادةُ سرعةِ ذوبانِ المادةِ الصُّلْبةِ في الماءِ بطحنِها، وتحويلِها إلى مسحوقٍ؛ إذْ تزدادُ مساحةُ سطحِ المادّةِ المُذابةِ فتلامِسُ عددًا أكبرَ منْ جزيئاتِ الماءِ، وتزدادُ سرعةُ ذوبانِها. فسرعةُ ذوبانِ السكّرِ المطحونِ في ( 100g) منَ الماءِ عندَ درجةِ حرارةِ الغرفةِ أكبرُ منْ سرعةِ ذوبانِ مكعبِ السكّرِ عندَ الظروفِ نفسِها.
ذائبيةُ الغازاتِ في الماءِ Solubility of Gases in Water
- يُذيبُ الماءُ كثيرًا منْ غازاتِ الهواءِ الجويِّ مثلِ غازِ الأكسجينِ وغازِ ثاني أكسيدِ الكربونِ؛ إذْ تحتاجُ إليْها الكائناتُ الحيةُ التي تعيشُ في الماءِ للتنفُّسِ والبناءِ الضوئيِّ.
- تُعرَّفُ ذائبيةُ الغازاتِ (Solubility of Gases) بِأنَّها أكبرُ كمّيّةٍ مِنَ الغازِ تذوبُ في لِترٍ منَ الماءِ عندَ درجةِ حرارةٍ معيَّنةٍ وضغطٍ جويٍّ محدَّدٍ.
- تتأثَّرُ ذائبيةُ الغازاتِ بعدَّةِ عواملَ، منْها الضّغطُ الواقعُ عليها؛ فكلَّما زادَ الضغطُ زادتْ ذائبيَّةُ الغازِ في الماءِ عندَ درجةِ حرارةٍ معيّنَةٍ، ولذلكَ عندَ فَتْحِ علبةِ مشروبٍ غازيٍّ ألاحظُ خروجَ فقاعاتِ غازٍ، وإذا تركْتُها مدَّةً منَ الزمنِ ستتصاعدُ فقاعاتٌ أكثرُ منَ الغازِ، وعندَما أتذوَّقُ المشروبَ الغازيَّ أجدُ طعمَهُ غيرَ مُستساغٍ بسببِ خروجِ الغازِ منْهُ، وتقلُّ ذائبيَّةُ الغازاتِ في الماءِ بزيادةِ درجةِ الحرارةِ، وهذا يفسِّرُ خروجَ فقاعاتٍ غازيّةٍ عندَ تسخينِ الماءِ؛ إذْ تقلُّ ذائبيّةُ الغازاتِ الذائبةِ في الماءِ، وتظهرُ على شكلِ فقاعاتٍ
استخلاصُ الأملاحِ Salts Extraction
تحتوي مياهُ البحارِ على كثيرٍ منَ الأملاحِ التي يمكنُ الاستفادةُ منْها في مجالاتِ الصناعةِ، ويمكنُ فصلُ الأملاحِ عنِ الماءِ بطرائقَ عدَّةٍ ، أهمُّها: التّبخُّرُ، والتقطيرُ.
التبخُّرُ Evaporation
- تُستخدمُ الطاقةُ الشمسيّةُ للحصولِ على أملاح البحرِ الميتِ في الأردنِّ وذلك بتعريضِ مياهِ البحرِ إلى أشعّةِ الشمسِ، فيتبخّرُ الماءُ وتترَّسبُ الأملاح بالتدريجِ وفقَ الاختلافِ في ذائبيَّتِها في أحواضٍ خاصَّةٍ تُسمّى المَلّحاتِ، ثمَّ تُستخلَصُ بطرائقَ كيميائيّةٍ خاصَّةٍ للاستفادَةِ منْها في صناعاتٍ عَديدةٍ.
التقطيرُ Distillation
- تُعَدُّ عمليّةُ التقطيرِ منْ أكثرِ الطرائقِ فعاليةً لاستخلاصِ الأملاح منْ محاليلِها المائيّةِ. ويتمُّ في عمليةِ التّقطيرِ تبخيرُ الماءِ وتكثيفُ بخارِهِ؛ للحصولِ على الماءِ النقيِّ. في جهازِ تقطيرِ الماءِ ، كما في الشكلِ أدناه
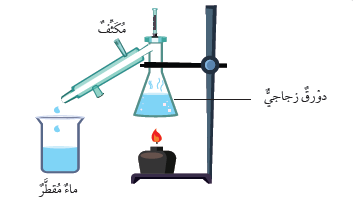
- يتبخَّرُ الماءُ عندَ تسخينِ المحلولِ، ويتصاعدُ بخارُ الماءِ إلى داخلِ المكثّفِ (سطحٌ باردٌ)، فيتكاثفُ، ويتحوّلُ إلى ماءٍ مقطّرٍ (نقيٍّ) يتجمَّعُ في الكأسِ الزجاجيّةِ، وتترسَّبُ الموادُّ الصُّلْبةُ في الدورقِ، وبهذهِ الطريقةِ يمكنُ الحصولُ على الأملاحِ ، إضافةً إلى ماءٍ نقيٍّ بدرجةٍ عاليةٍ .