الدرس الثاني: قوانين سرعة التفاعلات R e a c t i o n R a t e L a w s
الفكرةُ الرئيسة:
يصف قانون سرعة التفاعل الكيميائي العلاقة بين سرعة التفاعل وتراكيز المواد
المتفاعلة؛ مرفوعة لأسس محددة يجري التوصل إليها بالتجربة العملية.
المفاهيمُ والمصطلحات:
رتبة التفاعل Reaction Order
الرتبة الكُليّة للتفاعل
Overall Reaction Order
أثر التراكيز في سرعة التفاعل
The Effect of Concentrations on Reaction Rate
درست سابقًا كيفية حساب سرعة التفاعل الكيميائي؛ بمعرفة التغيّر
في كمية إحدى المواد المتفاعلة المستهلكة، أو كمية إحدى المواد الناتجة
خلال زمن معين. ولكن قد تعتمد سرعة التفاعل الكلية على تركيز أكثر من
مادة واحدة متفاعلة، وهذه المواد المتفاعلة لا يمكن تحديد أثرها في سرعة
التفاعل من معادلة التفاعل الموزونة؛ إنما من التجارب العملية.أنظر
الشكل ( 7)، الذي يُبيّن تفاعلً كيميائيًّا بين بيرمنغنات البوتاسيوم KMnO4
وفوق أكسيد الهيدروجين .H2O2 . فمثلاً؛ في
التفاعل(A + B → C + D )، تتناسب سرعة التفاعل طرديًا مع تراكيز المواد
المتفاعلة مرفوعة لقوى معينة عند درجة حرارة ثابتة، كما يأتي:
ولتحويل علاقة التناسب إلى علاقة مساواة، يتم إدخال ثابت التناسب الذي
يسمى ثابت سرعة التفاعل ( k)، لنحصل على قانون سرعة التفاعل كالآتي

رتبة التفاعل Reaction Order
يصف قانون سرعة التفاعل العلاقة بين سرعة التفاعلR وتراكيز المواد المتفاعلة عند درجة حرارة ثابتة.
يعبّر عن قانون سرعة التفاعل بحاصل ضرب ثابت سرعة التفاعل k في تركيز المادة المتفاعلة.ويعتمد ثابت سرعة التفاعل k، على درجة الحرارة، ولكل تفاعل ثابت سرعة k محدد تختلف قيمته عن الآخر.
يطلق على الرمز (x) رتبة التفاعل للمادة المتفاعلة A ؛ أما الرمز (y)فهو
رتبة التفاعل للمادة المتفاعلة B.وتعرَف رتبة التفاعلReaction Order؛للمادة المتفاعلة
بأنها الأسّ المرفوع تركيزُها إليه في قانون سرعة التفاعل، وتبيّن أثر تغير
تركيز المادة المتفاعلة في سرعة التفاعل. ويجري تحديد الرتبة من التجربة العملية
لا من معادلة التفاعل الموزونة، وقد تكون قيمة الرتبة صفر،1، 2، ...،صفر؛ فعندما تكون قيمة الرتبة x أو y صفر ؛ فهذا يعني أن التفاعل من الرتبة الصفرية للمادة المتفاعلة A أو B، وإذا كانت قيمة رتبة x أو y تساوي 1،فإن التفاعل يكون من الرتبة الأولى لتلك المادة المتفاعلة، في حين إذا كانت قيمة رتبة x أو y تساوي 2؛فإن التفاعل يكون من الرتبة الثانية لتلك المادة وهكذا.ويطلق على مجموع رتب المواد المتفاعلة x + y في قانون سرعة التفاعل؛ الرتبة الكُلية للتفاعل .Overall Reaction Order
المثال (9):
يتفاعل غاز أحادي أكسيد النيتروجينNO مع غاز الهيدروجينH2؛
وفق معادلة التفاعل الآتية:
2NO(g) + 2H2(g) → N2(g) + 2H2O(g)
جرى التوصل عن طريق التجربة عند درجة حرارة معينة؛ إلى أن قانون السرعة لهذا التفاعل هو:
1- ما رتبة التفاعل للمادة المتفاعلة NO؟
2- مارتبة التفاعل المادة المتفاعلة H2؟
3- ما الرتبة الكُلية للتفاعل؟
الحل
ألاحظ من قانون سرعة التفاعل أن:
1- الأسّ المرفوع تركيز المادة المتفاعلة NOإليه يساوي2؛أي أن رتبة المادةNOتساوي 2
2-الأسّ المرفوع تركيز المادة المتفاعلة H2 إليه يساوي 1؛أي أن رتبة المادةH2 تساوي 1
3-الرتبة الكلية تساوي مجموع رتبتي المادتين المتفاعلتين، وهي: 3=1+2
المثال 10
يتحلل خامس أكسيد ثنائي النيتروجين ؛N2O5 عند درجة حرارة معينة وفق معادلة التفاعل الآتية:
2N2O5(g) → 4NO2(g) + O2(g)
فإذا كان قانون السرعة لهذا التفاعل
وقيمة ثابت سرعة التفاعلk تساوي وتركيز N2O5يساوي ؛أحسب سرعة التفاعل.
المطلوب: أحسب سرعة التفاعلR
الحلّ:قانون سرعة التفاعل:
أعوض قيمة ثابت السرعة وقيمة التركيز؛ فأحصل على قيمة سرعة التفاعلR
أتحقَّق: ما المقصود برتبة التفاعل للمادة المتفاعلة؟
الإجابة:الأسّ المرفوع تركيزُها إليه في قانون سرعة التفاعل، وتبيّن أثر تغير
تركيز المادة المتفاعلة في سرعة التفاعل.
تحديد رتبة التفاعل Determining the order of reaction
تساعد معرفة رتب المواد المتفاعلة في توقع كيفية حدوث التفاعل الكيميائي.
ويمكن تحديد رتبة التفاعل بالنسبة لمادة متفاعلة بطريقة الرسم البياني أو بطريقة
السرعة الابتدائية.
طريقة الرسم البياني Graphical Method
أحدد رتبة التفاعل بالنسبة لمادة متفاعلة، وذلك بمعرفة تغير تركيز هذه
المادة مع الزمن أثناء سير التفاعل، مع المحافظة على بقاء تراكيز المواد المتفاعلة
الأُخرى ثابتة؛ وذلك باستعمال كميات كبيرة منها. وبعد قياس تراكيز المادة
المتفاعلة التي جرى اختيارها تجريبيًا؛ نرسم بيانيًا العلاقة بين التركيز مقابل زمن
التفاعل، وبما أن ميل المماس للمنحنى عند تركيز معين يساوي سرعة التفاعل
عند هذا التركيز ،فإنه يمكن حساب سرعات مختلفة للتفاعل عند تراكيز معينة، وبعد ذلك يُرسَم رسم بياني آخر يبين سرعة التفاعل مقابل تركيز المادة المتفاعلة. ويتيح لنا نمط هذا الرسم تحديد رتبة التفاعل بالنسبة لمادة معينة. وسنقتصر في دراستنا
باستخدام الرسم على الرتبة الصفرية والرتبة الأولى.
الرتبة الصفرية Zero Order
عندما يكون تركيز مادة متفاعلة مرفوعًا للأسّ صفر، فإن قيمته تساوي ( 1)؛
وهذا يعني أن تغير تركيز المادة لا يؤثر في سرعة التفاعل. فمثلاً؛ عند قياس سرعة
تحلل أحادي أكسيد ثنائي النيتروجين N2O، وفق المعادلة الآتية:
وجد أن سرعة التفاعل لا تعتمد على تركيز N2O الموجود بداية التفاعل وبهذا نرسم العلاقة بين تركيز المادة المتفاعلة مقابل الزمن؛ فنحصل على الرسم المبيّن في الشكل ()، ألاحظ أن تركيز المادة المتفاعلة يتناقص بمقدار ثابت بمرور الزمن؛ وبالتالي تكون العلاقة بين التركيز والزمن علاقة خطٍّ مستقيم متناقص مَيلُه مقدارٌ ثابت.
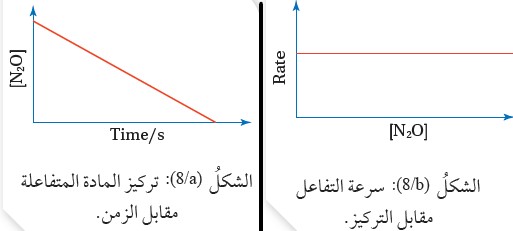
ويبين الشكل البياني ( )، علاقة خط مستقيم بين سرعة التفاعل مقابل التركيز،
ويشير ذلك إلى أن سرعة التفاعل لا تتأثر بتركيز المادة المتفاعلة N2O ، وبهذا يكون
قانون السرعة لهذا التفاعل:
وذلك لأن ؛ فلا يكتب تركيز N2O في قانون السرعة.
ونمط الرسم لهذا التفاعل هو فقط لتفاعلات الرتبة الصفرية كافّة؛ وبالتالي يمكن التنبؤ عن طريق الرسم مباشرة بالرتبة الصفرية.
الرتبة الأولى First order
عندما يكون تركيز مادة متفاعلة مرفوعًا للأس ( 1)؛ فإن سرعة التفاعل تتناسب
طرديًا مع تركيز المادة المتفاعلة، مما يعني أن تغير تركيز المادة يؤدي إلى التغيّر
نفسه في سرعة التفاعل، فمثلاً؛ نقصان تركيز المادة المتفاعلة إلى النصف يؤدي إلى
نقصان سرعة التفاعل إلى النصف، وكذلك مضاعفة تركيزها يؤدي إلى مضاعفة
سرعة التفاعل بالمقدار نفسه، ومثال ذلك تحلل فوق أكسيد الهيدروجين
وفق المعادلة الآتية:
حيث وجد عمليًا أن مضاعفة تركيز يؤدي إلى مضاعفة سرعة التفاعل؛
لذلك يعدّ هذا التفاعل من الرتبة الأولى بالنسبة للمادة المتفاعلة فوق أكسيد
الهيدروجين،ويعبّر عن سرعته بالقانون
ويمكن التحقق من التفاعل أنه رتبة أولى بتتبع تغيّر تركيز بمرور الزمن.
حيث يبين الشكل ( 9) ميل المماس عند تراكيز محددة من في زمن محدد ودرجة
حرارة ثابتة. ويعدّ شكل المنحنى هذا مؤشرًا عامًا لتفاعلات الرتبة الأولى كافة.
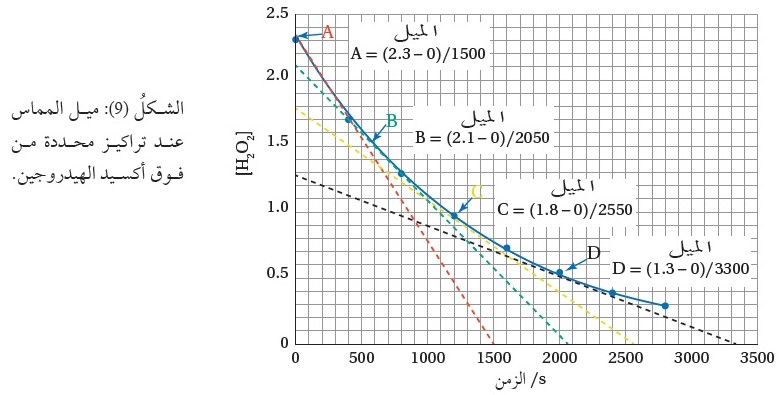
يتضح من الشكل أن الخطوط المنقطة A.B.C.D ؛ تمثل المماس عند تراكيز
محددة، وبحساب ميل المماس يمكن حساب سرعة هذا التفاعل عند تلك
التراكيز من العلاقة الآتية:
ويبين الجدول(2)الآتي قِيَم سرعة التفاعل المحسوبة عند تراكيز محددة من
الجدول (2): قِيَم سرعة التفاعل عندتراكيز محددة من
| 0 | 0 |
| 0.5 | 0.394 |
| 1.0 | 0.706 |
| 1.5 | 1.024 |
| 2.3 | 1.533 |
وبذلك يمكن رسم شكل بياني 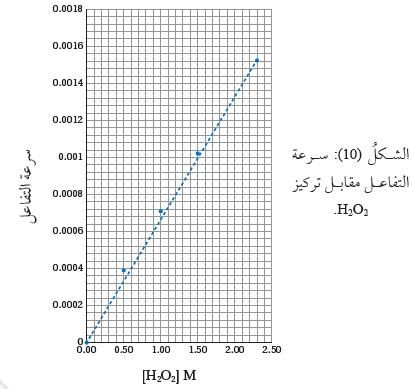
يوضح سرعة التفاعل مقابل التركيز،كما هو مبيّن في الشكل ( 10 )، حيث يظهر الشكل علاقة خط مستقيم متزايد، وهذا النمط ينطبق على هذا التفاعل وعلى تفاعلات الرتبة الأولى كافة؛ أي إذا كانت العلاقة خطًا مستقيمًا متزايدًا بين تركيز المادة المتفاعلة
وسرعة التفاعل؛ يعني ذلك أن التفاعل من الرتبة الأولى.
طريقة السرعة الابتدائية The Initial Rate Method
تستعمل هذه الطريقة في تحديد رتبة التفاعل عن طريق مقارنة السرعات
الابتدائية للتفاعل بتغير تركيز المواد المتفاعلة، حيث تقاس سرعة التفاعل
الابتدائية في اللحظة التي تُخلط فيها المواد المتفاعلة ذات التراكيز المعلومة.
فمثلاً؛ في التفاعل العام:
aA + bB → nC
بافتراض إجراء ثلاثة تجارب بتراكيز ابتدائية مختلفة لكل من المادتين المتفاعلتين
A و B، وسرعات ابتدائية عند درجة حرارة ثابتة كما يأتي:
| السرعةالابتدائية | التجربة | ||
| 0.1 | 0.1 | 1 | |
| 0.1 | 0.2 | 2 | |
| 0.2 | 0.1 | 3 |
فإن قانون سرعة التفاعل العام هو ، ولتحديد قيمة الرتبة x
للمادة A؛ أقارن بين تركيز المادة A وسرعة التفاعل في التجربتين (1 و 2) عند
ثبات تركيز المادة B، حيث ألاحظ أن تركيز المادة A في التجربة رقم ( 2) هو
ضعف تركيزها في التجربة رقم ( 1)، وألاحظ -أيضًا- أن سرعة التفاعل في
التجربة رقم ( 2) كان ضعفها في التجربة رقم ( 1)، أي أن نسبة الزيادة في تركيز
المادة هي نسبة الزيادة ذاتها في سرعة التفاعل، وبذلك؛ فإن التفاعل أحادي
الرتبة للمادة A، أي أن قيمة x تساوي 1.
كذلك؛ أطبق الطريقة ذاتها لتحديد قيمة رتبة y للمادة B؛ فإنني أقارن تركيز
المادة B مع سرعة التفاعل في التجربتين ( 1، 3) عند ثبات تركيز المادة A، حيث
ألاحظ أن تركيز المادة B في التجربة رقم ( 3)، هو ضعف تركيزها في التجربة
رقم ( 1)، وألاحظ -أيضًا- أن سرعة التفاعل في التجربة رقم ( 3) تزداد أربعة
مرات عنها في التجربة رقم ( 1)، وبذلك فإن التفاعل ثنائي الرتبة للمادة B؛ أي
أن قيمة y تساوي 2.
أستدل من المعلومات السابقة أن التفاعل للمادة A أحادي الرتبة؛ بينما
التفاعل للمادة B ثنائي الرتبة؛ وبهذا أتوصل إلى قانون السرعة لهذا التفاعل:
المثال 11
يتفاعل ثاني أكسيد النيتروجين مع حمض الهيدروكلوريك وفق معادلة التفاعل الآتية:
NO2(g) + 2HCl(g) → NO(g) +Cl2(g) + H2O(g)
أُجريت ثلاث تجارب بتراكيز مختلفة عند درجة حرارة ثابتة؛ وجرى حساب سرعة التفاعل الإبتدائية لكل تجربة، وسجلت النتائج؛ فكانت كما يظهر في الجدول الآتي:
| السرعةالابتدائية M/s | M[HCl] | [NO2]M | رقم التجربة |
| 0.3 | 0.3 | 1 | |
| 0.3 | 0.6 | 2 | |
| 0.6 | 0.3 | 3 |
1- أكتب قانون سرعة التفاعل العام؟
2-أستنتج رتبة المادة المتفاعلة NO2
3- أستنتج رتبة المادة المتفاعلة HCl
4- أستنتج قانون السرعة لهذا التفاعل.
5-أحسب قيمة ثابت سرعة التفاعلK، وأحدد وحدته؟
الحلّ:
1- قانون سرعة التفاعل العام
2-أجد قيمة الرتبة xللمادة المتفاعلة NO2، بمقارنة تركيز NO2 مع سرعة التفاعل في التجربتين رقم (1 و 2)عند ثبات تركيز HCl،حيث أقسم سرعة التفاعل R2 على سرعة التفاعل R1 كما يلي:
أعوض قيم السرعة والتركيز، وأحذف قيمة ثابت السرعة k ؛ لأنها ثابته في التفاعل ذاته.
ومنها 2 = 2x
أي أن: 1=x وهي رتبة المادة NO2
3- أجد قيمة الرتبة y للمادة المتفاعلة HCl ، بمقارنة تركيز HCl مع سرعة التفاعل في التجربتين رقم ( 1و 3)عند ثبات تركيز المادةNO2، حيث أقسم سرعة التفاعل R3 على سرعة التفاعل R1 كما يلي:
أعوض قيم السرعة والتركيز ورتبة NO2 وأحذف قيمة ثابت السرعة k لأنها ثابتة.
, ومنها 2 = 2y
أي أن: 1=y وهي رتبة المادة HCl
4- أستنتج قانون سرعة التفاعل:
5- أحسب قيمة ثابت السرعة من التجربة رقم(1) مثلا كما يأتي:
المثال 12
يتفاعل غاز أحادي أكسيد النيتروجينNOمع غاز الأكسجين O2 مكوّنًا غاز ثاني أكسيد النيتروجين NO2، وفق المعادلة الآتية:
وبقياس سرعة التفاعل الإبتدائية عند تراكيز ابتدائية مختلفة من NO و O2
سجلت النتائج كما يظهر في الجدول الآتي:
| السرعةالابتدائية | رقم التجربة | ||
| 1 | |||
| 2 | |||
| 3 |
أستعين بنتائج هذه التجارب في تحديد رتبة التفاعل بالنسبة لكل من أحادي أكسيد النيتروجين والأكسجين.
الحلّ:
لتحديد رتبة التفاعل للمادةNO، أقارن تركيزها مع سرعة التفاعل في التجربتين (1و2)عند ثبات تركيز الأكسجينO2،حيث ألاحظ أن تركيز NOتضاعف مرتين كما يأتي:
وبالمقابل تتضاعف السرعة 4 مرات كما يأتي:
أي أن التفاعل من الرتبة 2 بالنسبة للمادة NO.
كذلك؛ أستعمل الطريقة ذاتها لتحديد قيمة رتبة المادة O2،حيث أقارن تركيزها مع سرعة التفاعل في التجربتين(1و3) عند ثبات تركيز NO،حيث ألاحظ أن تركيز O2 تضاعف مرتين كما يأتي:
وأيضًا؛ تتضاعف السرعة مرتين كما يأتي:
وبهذا؛ فإن رتبة التفاعل للمادة O2 تساوي1
أستدل من المعلومات السابقة على قانون السرعة لهذا التفاعل:
المثال 13
جرى قياس السرعة الإبتدائية لثلاثة تجارب عند تراكيز ابتدائية مختلفة من تفاعل كلوروإيثان CH3CH2Cl مع هيدروكسيد الصوديوم NaOH وفق المعادلة الآتية:
CH3CH2Cl + NaOH → CH3CH2OH + NaCl
وسجلت النتائج كما في الجدول الآتي:
| السرعةالابتدائية | رقم التجربة | ||
| 0.1 | 0.025 | 0.02 | 1 |
| 0.15 | 0.025 | 0.03 | 2 |
| 0.3 | 0.050 | 0.03 | 3 |
أستعين بنتائج هذه التجارب في تحديد رتبة التفاعل بالنسبة لكل من كلوروإيثانCH3CH2Clوهيدروكسيد الصوديوم NaOH،وأكتب قانون سرعة هذا التفاعل.
الحلّ:
لتحديد رتبة التفاعل للمادة CH3CH2Cl أقارن تركيزها مع سرعة التفاعل في التجربتين(1و2)عند ثبات تركيز NaOH،حيث أجد أن:
وأحسب عندها سرعة التفاعل كما يأتي:
وبهذا؛ فان التفاعل من الرتبة 1 بالنسبة للمادةCH3CH2Cl
كذلك أستعمل الطريقة ذاتها لتحديد قيمة رتبة NaOH،حيث أقارن تركيزها مع سرعة التفاعل في التجربتين(2 و 3)عند ثبات تركيز CH3CH2Cl، حيث أجد أن:
وأحسب عندها سرعة التفاعل كما يأتي:
أي أن التفاعل من الرتبة 1 بالنسبة للمادةNaOH
قانون سرعة التفاعل:
المثال 14
في معادلة التفاعل الافتراضي نواتج → A(g) + B(g)
سجّلت البيانات كما يأتي:
| السرعة الابتدائية | رقم التجربة | ||
| 0.1 | 0.2 | 1 | |
| 0.1 | 0.4 | 2 | |
| 0.2 | 0.6 | 3 |
1-أستنتج رتبة المادة المتفاعلة A
2-أستنتج رتبة المادة المتفاعلة B
3-أستنتج قانون السرعة لهذا التفاعل.
4-أحسب قيمة ثابت سرعة التفاعل k، وأحدد وحدته؟
الحل:
1- أجد الرتبة x لللمادة المتفاعلة A من التجربتين (1و2) عند ثبات تركيز B
أعوّض قِيَم السرعة والتركيز
2-أجد الرتبة y للمادة المتفاعلة B من التجربتين(1و3)، أو ( 2و3) وذلك لأنه لا يوجد ثبات في تركيز المادة A ، فمثلا ؛ يمكن الرجوع إلى التجربتين (1و3) كما يلي:
3- أستنتج قانون سرعة التفاعل:
4-أحسب ثابت سرعة التفاعل، وأستنتج وحدته:
أتحقَّق: في قانون سرعة التفاعل العام R = k [A]x [B]y عند مضاعفة تركيز A مرتين مع ثبات تركيز B تضاعفت سرعة التفاعل مرتين، وعند مضاعفة تركيز AوB معا مرتين تضاعفت السرعة 8 مرات. أستنتج رتبة كل من A و B.
الإجابة: رتبة A تساوي 1 ، ورتبة B+A تساوي 3 ، فتكون رتبة B تساوي2.