- المفاهيم والمصطلحات :
عزيزي الطالب ستتعرف في هذا الدرس على هذه المفاهيم والمصطلحات العلمية :
|
الخصائص الدورية للعناصر |
Periodic Properties of the Elements |
|
نصف القطر الذري |
Atomic Radius |
|
شحنة النواة الفعالة |
Effective Nuclear Charge |
|
إلكترونات التكافؤ |
Valence Electrons |
|
طاقة التأين |
Ionization Energy |
|
الألفة الإلكترونية |
Electron Affinity |
|
السالبية الكهربائية |
Electron Negativity |
: الخصائص الدورية للعناصر (Periodic Properties of the Elements) :
- الخصائص الدورية للعناصر:
- تتشابه العناصر الكيميائية مع تقسيم المناطق المختلفة بحسب المناخ السائد على الكرة الأرضية حيث :
تقسم المناطق تبعًا لإختلاف منخها تبعًا لموقعها الجغرافي حيث تتشابه المناطق الواقعة ضمن دوائر العرض نفسها من حيث المناخ في حين تتغير المناطق المناخية كلما إتجهنا من شمال الكرة الأرضية إلى جنوبها وهذا يشبه كثيرًا العناصر الكيميائية إذ تمتاز بعدد من الخصائص الفيزيائية والكيميائية التي تحدد بناءً على موقع العنصر في الجدول الدوري.
- تقسم الخصائص الدورية للعناصر إلى :
أ) نصف القطر الذري ب) نصف القطر الأيوني جـ) طاقة التأين د) الألفة الإلكترونية هـ) السالبية الكهربائية
- نصف القطر الذري (Atomic Radius)
- يعد الحجم الذري إحدى الخصائص المهمة التي تحدد السلوك العام للذرات.
- يعبر عن حجوم ذرات الفلز بـمصطلح نصف القطر الذري
- تعريف نصف القطر الذري : هو " نصف المسافة الفاصلة بين ذرتين متجاورتين في البلورة الصلبة لعنصر الفلز"
- يعبر عن حجوم ذرات اللافلزات بـمصطلح نصف قطر التساهم
- تعريف نصف قطر التساهم : هو " نصف المسافة بين نواتي ذرتي عنصرفي الحالة الغازية بينهما رابطة تساهمية "
- الشكل الآتي يبين الفرق بين نصف القطر الذري و نصف قطر التساهم :
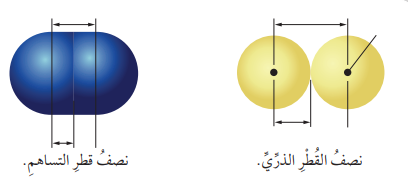
- يقاس نصف القطر الذري بوحدة البيكومتـر Pico meter (Pm)
- يتغير نصف القطر والحجم الذري تدريجيًا في الجدول الدوري سواء كان ذلك في الدورة الواحدة أم في المجموعة الواحدة تبعًا لـعاملين إثنين وهما :
1) عدد الكم الرئيس (n) (Principle Quantum Number) :
- يزداد نصف قطر الذرة والحجم الذري عند زيادة العدد الذري بالإتجاه من الأعلى للأسفل في المجموعة الواحدة نتيجةٌ لـ :
" زيادة رقم المستوى الخارجي (n)، مع بقاء تأثير جذب النواة لإلكترونات المستوى الخارجي ثابتًا؛ ما يزيد من بعد الإلكترونات الخارجية النواة"
2) شحنة النواة الفعالة (Effective Nuclear Charge) :
- تعريفها : " هي القدرة الفعلية للنواة الموجبة على جذب إلكترونات التكافؤ بعد تأثير الإلكترونات الحاجبة"
- تعمل البروتونات الموجبة في النواة على جذب إلكترونات المستوى الخارجي (إلكترونات التكافؤ) نحوها
- يتأثر مقدار الجذب الفعلي للنواة الموجبة بفعل إلكترونات المستويات الداخلية (الإلكترونات الحاجبة) حيث تقلل من قدرة النواة على جذب الإلكترونات.
- تزداد شحنة النواة الفعالة بزيادة العدد الذري بالإتجاه من اليسار إلى اليمين في الدورة الواحدة، مع بقاء الرقم نفسه للمستوى الخارجي؛ ما يزيد من تأثير جذب النواة لإلكترونات التكافؤ، فيزداد إقترابها من النواة ويقل نصف القطر ثم يقل الحجم الذري
- الشكل الآتي يبين نصف القطر والحجم الذري للذرات في الجدول الدوري :
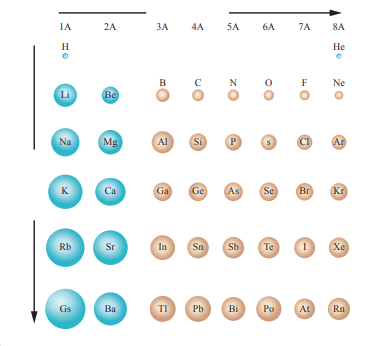
سؤال (1) :
من الشكل السابق : ما رمز العنصر الأكبر حجمًا :
الإجابة :
العنصر الأكبر حجمًا هو Cs
سؤال (2) :
من الشكل السابق : أي الذرتين أكبر حجمًا : Be أم Ba:
الإجابة :
الذرة الأكبر حجمًا هي Ba
سؤال (3) :
من الشكل السابق : أي الذرتين أصغر حجمًا S أم Al :
الإجابة :
الذرة الأصغر حجمًا هي S
مثال(1) :
أوضح أثر شحنة النواة الفعالة في حجوم ذرات العناصر الآتية : Al13 11Na , 12Mg ,
الإجابة :
بناءً على التوزيع الإلكتروني لهذه الذرات:
التوزيع الإلكتروني لـ Na11 [Ne] 3s1 :
التوزيع الإلكتروني لـ Mg12 [Ne] 3s2 :
التوزيع الإلكتروني لـ Al13 [Ne] 3s2 3p1 :
يتبين أنها جميعها من عناصر الدورة الثالثة و تتساوى في عدد المستويات الرئيسية وفي عدد الإلكترونات الداخلية (الإكترونات الحاجبة ) لكنها تختلف في عدد البروتونات الموجبة في النواة حيث أن :
الصوديوم (Na) : هي الأقل عددًا أي أنها أقل قدرةً على جذب إلكترونات المستوى الخارجي (إلكترونات التكافؤ) وهي أكبرها من حيث الحجم الذري
المغنيسيوم (Mg) : هي التي تلي الصوديوم من حيث كبر الحجم الذري والدرة على جذب إلكترونات التكافؤ
الألمنيوم (Al) : هي التي تمتلك أكبر عدد من البروتونات الموجبة في النواة مما يعني ؛ زيادة في جذب إلكترونات المستوى الخارجي (إلكترونات التكافؤ) بالتالي يقل الحجم الذري.
- نصف القطر الأيوني (Ionic Radius)
- تؤدي عملية تأين الذرات إلى :
1) إختلاف توزيعها الإلكتروني 2) تغير عدد إلكترونات في المستوى الأخير
3) تغير عدد المستويات الرئيسية المشغولة بالإلكترونات
لذلك : فإن :
- حجوم الأيونات تختلف عن حجوم ذراتها تبعًا لإضافة الإلكترونات وفقدها حيث :
- تقل حجوم الأيونات الموجبة مقارنةً بذراتها نتيجة فقدها للإلكترونات؛ مما يؤذي إلى تقليل عدد مستويات الأيون الرئيسية وزيادة جذب النواة للإلكترونات في المستوى الخارجي .
- تزداد حجوم الأيونات السالبة مقارنة بذراتها نتيجة كسبها للإلكترونات، مما يؤدي زيادة عدد إلكترونات في المستوى الخارجي، فيزيد التنافر بين الإلكترونات، مسببًا زيادة في حجم الأيون السالب
- الشكل الآتي يبين العلاقة بين حجوم الأيونات الموجبة والأيونات السالبة مقارنةً بذراتها :

سؤال (4) :
أيهما أكبر حجمًا أيون الفلوريدF-9 أم أيون الصوديوم Na+ 11 :
الإجابة :
أيون F- أكبر حجمًا من أيون Na+
بالرغم إمتلاك الأيونين التوزيع الإلكتروني نفسه ؛ فإن عدد البروتونات الموجبة في أيون الصوديوم أكبر منها في أيون الفلوريد مما يزيد من جذب الإلكترونات فيقل الحجم.
سؤال (5) :
أيهما أكبر حجمًا ذرة الأكسجين O أم أيون الأكسيد O2- ؟
الإجابة :
حجم أيون الأكسجين O2- أكبر من حجم ذرته.
مثال(2) :
اُقارن بين حجم ذرة عنصر البوتاسيوم K19 وحجم أيونها الموجب K+19
الإجابة :
بناءً على التوزيع الإلكتروني لــ :
عنصر البوتاسيوم K19: 1s2 2s2 2p6 3s2 3p6 4s1
أيون البوتاسيوم K+19: 1s2 2s2 2p6 3s2 3p6
فإن توزيع إلكترونات هذه الذرة ينتهي بالمستوى الرئيس الرابع، وفي حال فقدها إلكترونًا فإنها تتحول إلى أيون، ويصبح عدد المستويات الرئيسية الممتلئة بالإلكترونات هو 3 مستويات، وبذلك يصبح حجم أيون البوتاسيوم أصغر من حجم الذرة نفسها =.
مثال(3) :
اُقارن بين حجم ذرة عنصر الكلور Cl17 وحجم أيونها السالب Cl-17
الإجابة :
بناءً على التوزيع الإلكتروني لــ :
عنصر الكلور Cl17: 1s2 2s2 2p6 3s2 3p5
أيون الكلور Cl-17: 1s2 2s2 2p6 3s2 3p6
فإن كلًا من هذه الذرة وأيونها السالب يملك العدد نفسه من المستويات الرئيسية n، وإن عدد إلكترونات المستوى الخارجي للأيون يزداد نتيجة كسب الإلكترونات، مما يؤدي إلى زيادة التنافر بينها، فيزداد حجم الأيون.
- التجربة (1) : الإتجاهات الدورية في الحجوم الأيونية :
- الهدف من التجربة :
بيان علاقة الحجم الأيوني بالعدد الذري
- المواد والأدوات :
- ورق رسم بياني
- أقلام تلوين
- خطوات العمل :
- مستخدمًا قيم أنصاف أقطار الذرات والأيونات الواردة في الشكل (10) الموجود في الكتاب، أحدد على ورقة الرسم البياني نقاطًا تمثل نصف القطر الأيوني مقابل العدد الذري
- أصل بين النقاط الناتجة من عناصر الدورة الواحدة بإستخدام قلم تلوين
- أصل بين النقاط الناتجة من عناصر المجموعة الواحدة بإستخدام قلم تلوين مختلف
- التحليل والإستنتاج :
1) أُقارن بين حجم الذرة وأيونها الموجب، وحجم الذرة وأيونها السالب
2) أصف تغير نصف القطر الأيوني في الدورة الواحدة عن طريق الرسم البياني
3) أصف تغير نصف القطر الأيوني في المجموعة الواحدة عن طريق الرسم البياني
4) اُفسر سبب التغير في حجوم الأيونات الموجبة والأيونات السالبة
للتذكير :
الشكل (10) وشكل الرسم البياني:
 |
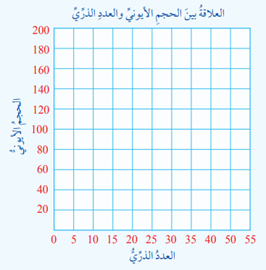 |
- الملاحظات على التجربة :
1) حجم الذرة أكبر من أيونها الموجب وأصغر من حجم أيونها السالب
2) تتناقص أنصاف أقطار الأيونات في الدورة الواحدة على مرحلتين :
الأولى : تناقص أيونات عناصر المجموعة الأولى، والثانية، والثالثة
الثانية : تناقص أيونات عناصر المجموعة الخامسة، والسادسة، والسابعة
3) تزداد أنصاف أقطار الأيونات في المجموعة الواحدة بالإنتقال من أعلى إلى الأسفل
4) تتناقص حجوم الأيونات الموجبة لفقدها الإلكترونات ما يؤدي إلى تقليل التنافر بين إلكترونات التكافؤ أو نقصان عدد المستويات الرئيسية. أما الأيونات السالبة فيزداد حجمها لزيادة عدد إلكترونات التكافؤ، وزيادة التنافر بين الإلكترونات
- طاقة التأين (Ionization Energy)
- إن عملية تحول الذرة المتعادلة إلى أيون موجب عن طريق فقدها إلكترونًا واحدًا أو أكثر من إلكترونات التكافؤ تتطلب تزويد الذرة بطاقة كافية لنقل الإلكترون إلى المستوى الانهائي؛ حيث يفقد ارتباطه بها ولا يكون لها أي تأثير فيه.
- تعبر هذه الطاقة عن :
- قوة إرتباط الإلكترون بالنواة وصعوبة نزعه من الذرة
- تعد مؤشرًا لنشاط العنصر في التفاعلات الكيميائية
- تعرف هذه الطاقة بإسم طاقة التأين
- تعريف طاقة التأين : " هي الحد الأدنى من الطاقة اللازمة لنزع الإلكترون الأبعد عن النواة في الحالة الغازية للذرة أو الأيون"
- يعبر عن طاقة التأين بالمعادلة الأتية :
- يعتمد تحديد مقدار طاقة التأين على :
- قوة التجاذب بين بروتونات النواة والإلكترونات؛ فكلما ازاد نصف القطر الذري أصبحت الإلكترونات أبعد عن النواة وأقل إرتباطًا بها فيقل مقدار طاقة التأين .
- عند إزدياد شحنة النواة الفعالة ( مع بقاء عدد مستويات الطاقة ثابتًا): يزداد جذب النواة لإلكترونات المستوى الخارجي ؛ ما يزيد من مقدار طاقة التاين .
- الشكل الآتي يبين قيم طاقة التأين لعدد من العناصر :
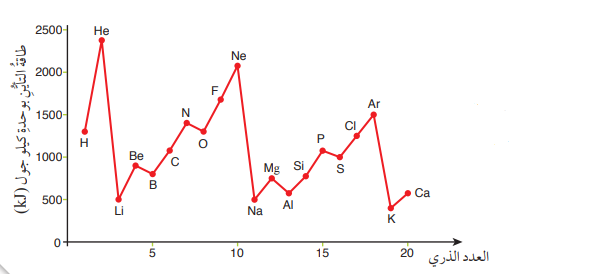
- يلاحظ من الشكل :
- زيادة قيم طاقة التأين للعناصر النبيلة مقارنةً بذرات العناصر الأخرى
- زيادة قيم طاقة التأين في الدورة الواحدة عامةً عند زيادة العدد الذري للعنصر
- إنخفاض قيم طاقة التأين في المجموعة الواحدة عند الإتجاه من الأعلى إلى الأسفل نظرًا إلى زيادة عدد مستويات الطاقة.
ملاحظات :
- تفقد بعض العناصر أكثر من إلكترون للوصول إلى تركيب يشبه تركيب العناصر النبيلة
- يختلف مقدار الطاقة اللازمة لنزع الإلكترونات من الذرة نفسها حيث :
- تعرف الطاقة اللازمة لنزع الإلكترون من الذرة المتعادلة بطاقة التأين الأولى
- تعرف الطاقة اللازمة لنزع الإلكترون من الأيون الأحادي الموجب بطاقة التأين الثانية
- يعبر عن طاقة التأين الثانية بالمعادلة الآتية :
- يعبر عن طاقة التأين الثالثة بالمعادلة الآتية :
- تزداد قيم طاقة التأين اللازمة لنزع الإلكترون من الأيونات عليها من الذرة المتعادلة فنجد أن :
- تكون طاقة التأين الثانية أعلى من طاقة التأين الأولى للعنصر نفسه
- تكون طاقة التأين الثالثة أعلى من طاقة التأين الثانية للعنصر نفسه
- نظرًا لــ " زيادة جذب النواة للإلكترونات في الأيونات"
سؤال (6) :
أُقسر : طاقة تأين Mg أعلى من طاقة تأين Al
الإجابة :
الفلك الخارجي للمغنيسيوم 3s2 ؛ أي ممتلئ لذا يلزم توافر طاقة أعلى لنزع الإلكترون من s؛ لأنه أكثر إستقرارًا من 3P1 في الألمنيوم .
سؤال (7) :
أرتب العناصر الأتية تبعًا لزيادة طاقة التأين :
Li, C, Na, He, Ne
الإجابة :
He > Ne > C > Li > Na
سؤال (8) :
إن قيم طاقة التأين للمغنيسيوم Mg12 هي كما يأتي :
ط1 = 738 ط2 = 1451 ط3 = 7730 ط4 = 10540
1) أكتب معادلة تمثل طاقة التأين الثانية :
2) أُفسر سبب ارتفاع قيمة طاقة التأين الثالثة مقارنةً بطاقة التأين الأولى والثانية :
الإجابة :
1)
2) لأن طاقة التأين الثالثة تعني الطاقة اللازمة لنزع الإلكترون من أيون المغنيسيوم Mg2+؛ الذي يشبه توزيعه الإلكتروني للغاز النبيل Ne .
- الربط مع الرياضيات :
توجد صلة وثيقة بين الصفات الدورية للعناصر الكيميائية والأنماط في مبحث الرياضيات؛ إذ تتكرر الصفات وفق تسلسل محدد في المجموعة الواحدة والدورة الواحدة، ويمكن التنبؤ بصفة العنصر قياسًا على نمط التغير في الدورة و المجموعة .
- الألفة الإلكترونية (Electron Affinity)
- عند إضافة إلكترون إلى الذرة:
فإنه يدخل أحد مستويات الطاقة في الذرة ويخضع لقوة جذب النواة؛ فتقل طاقة وضعه مما يسبب إنبعاث مقدار معين من الطاقة فتتغير طاقة الذرة بوجه عام للوصول إلى حالة الحد الأدنى من الطاقة، وإلى الحالة التي هي أكثر إستقرارًا.
- تعريف الألفة الإلكترونية : "هي مقدار التغير في الطاقة المقترن بإضافة إلكترون إلى الذرة المتعادلة في الحالة الغازية"
- يعبر عن الألفة الإلكترونية بالمعادلة الآتية :
- السالبية الكهربائية (Electronegativity)
- تميل بعض الذرات إلى التشارك مع ذرات أخرى عن طريق مساهمة كل منها في عدد من الإلكترونات، وتتنافس الذرات لجذب إلكترونات الرابطة إليها.
- تعريف السالبية الكهربائية : " هي قدرة الذرة على جذب إلكترونات الرابطة إليها " وذلك إعتمادًا على :
- نصف قطر الذرتين المكونتين للرابطة: فكلما زاد نصف قطر الذرة قل إنجذاب الإلكترونات المشتركة إليها، علمًا أن
- أصغر الذرات حجمًا هي أكثر قدرة على جذب إلكترونات الرابطة مما يعني أن :
" السالبية الكهربائية تزداد في الدورة الواحدة بالإتجاه من اليسار إلى اليمين "
" السالبية الكهربائية تزداد في المجموعة الواحدة بالإتجاه من الأسفل إلى الأعلى "
- تعد ذرة الفلور أكثر الذرات سالبية كهربائية، تليها ذرة الأكسجين ثم ذرة النيتروجين
- الشكل الآتي يبين قيم السالبية الكهربائية لعدد من عناصر الجدول الدوري :
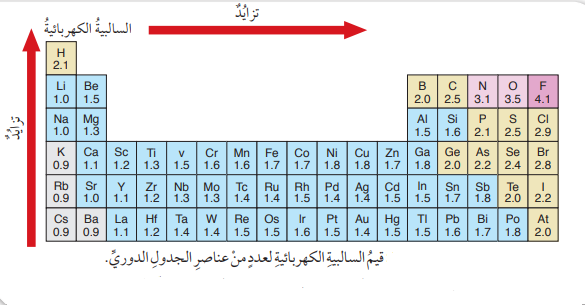
سؤال (9) :
أستنتج العلاقة بين قيم السالبية الكهربائية والحجم الذري للعنصر :
الإجابة :
إن العلاقة بين السالبية الكربائية والحجم الذري هي علاقة عكسية
سؤال (10) :
أرتب العناصر الآتية تصاعديًا بحسب السالبية الكهربائية :
S16, 8O, Na11 , N7
الإجابة :
O > N > S > Na
الإثراء والتوسع : " مجهر القوة الذرية "
تدين ثورة تقنية النانو في تقدمها المتسارع إلى التطور الكبير في تقنيات الميكروسكوبات الحديثة وتطبيقاتها، ويسعى العلماء دائمًا إلى تطوير هذه الأجهزة، لفتح آفاق علمية وتقنية جديدة تساعد على تعرف المزيد عن عالم النانو، وكيف يمكن الإستفادة منه إفادة مثلى.
- بوجه عام تصنف الميكروسكوبات النانوية إلى نوعين، هما :
1) الميكروسكوبات الإلكترونية EM: مثل : الميكروسكوب الإلكتروني الماسح SEM، والميكروسكوب الإلكتروني النافذ TEM
2) ميكروسكوبات المجسات الماسحة SPM : مثل : الميكروسكوب النفقي الماسح STM، وميكروسكوب القوة الذرية AFM
- يمتاز ميكروسكوب القوة الذرية AFM بــ:
- قدرته التحليلية الكبيرة التي تصل درجة دقتها إلى أجزاء من النانو، وبقدرته على التكبير التي تفوق قدرة الميكروسكوبات الضوئية بأكثر من 1000 مرة، ما يتيح رؤية أجسام تتراوح حجومها بين 20 نانو متر و 300 نانومتر؛ لذلك يعد الجهاز الأكثر شهرة من حيث ( التكبير، والقياس، والتحريك على المستوى النانوي)
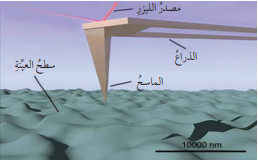
- يتكون ميكروسكوب القوة الذرية AFM من :
- ذراع مصنوعة من مادة السيليكون أو نيتريد السيليكون، ولا يتعدى نصف قطرها النانومترات ويوجد في نهايتها مجس مكون من رأس حاد لمسح سطح العينة؛ فعند إقتراب رأس المجس من سطح العينة تتولد قوة بين رأس المجس وسطح العينة تؤدي إلى إنحراف الذراع بناءً على قوة متبادلة تختلف بإختلاف نوع سطح العينة التي يراد دراستها.
- الشكل التالي يبين تركيب ميكروسكوب القوة الذرية AFM :
- ينشأ عن القوة المتبادلة بأشكالها المتعددة إنحراف في ذراع ميكروسكوب القوة الذرية، ما يؤدي إلى إنحراف شعاع الليزر عن مرأة مثبتة على ذراع الميكروسكوب، فينعكس هذا الشعاع على مصفوفة خطية من حساسات الضوء، ثم يرسل إلى أنظمة حاسوبية مخصصة لمعالجتها، وإخراجها على هيئة صورٍ ثلاثية الأبعاد :
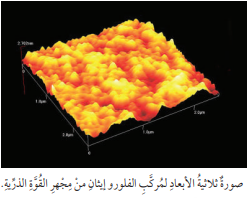
يذكر أن :
طريقة قياس الإنحراف بشعاع الليزر هي أكثر الطرائق دقة وإستخدامًا في الحصور على صور للذرات، والجزيئات والروابط الكيميائية التساهمية