- وجد البروتونات والنيوترونات في مركز الذرة (النواة) بينما تتوزع الإلكترونات في الفراغ المحيط بالنواة في مستويات من الطاقة، وكل منها يتسع لعدد محدد من الإلكترونات وتزداد سعته بزيادة بعده عن النواة
- الذرة المتعادلة تحتوي على عدد من الإلكترونات يساوي عدد البروتونات فيها أي ساوي عددها الذري.
- التوزيع الإلكتروني للعناصر الممثلة (المجموعة A) :
- تتوزع إلكترونات الذرة في أغلفة حول النواة تسمى بـمستويات الطاقة
- مستويات الطاقة :هي مناطق تحيط بالنواة لها نصفُ قطرٍ وطاقة محددان، يزداد كل منها بزيادة بعده عن النواة ويتسع كل مستوى لعددٍ محدد من الإلكترونات.
- المستوى الأول : يتسع كحد أقصى لإلكترونين
- المستوى الثاني : يتسع لـ (8) إلكترونات.
- الجدول الآتي يبين السعة القصوى من الإلكترونات لكل مستوى :

- ترتيب العناصر في الجدول الدوري :
- تترتب العناصر في الجدول الدوري؛ بناءً على :
1. العدد الذري لها 2. التشابه في الخصائص الكيميائية التي تعتمد على التوزيع الإلكتروني لذراتها
- الجدول الدوري يتكون من :
- 7 دورات
- 18 مجموعة تقسم إلى نوعين من المجموعات وهما :
+ مجموعات العناصر الممثلة (A) وعددها 8 مجموعات وتشمل المجموعات أو الأعمدة ذات الأرقام (1, 2, 13-18)
+ مجموعات العناصر الإنتقالية (B) وتشمل 8 مجموعات ذات الأرقام (3-12) وتضم 10 أعمدة تقع في وسط الجدول الدوري
- يرتبط ترتيب العناصر في الجدول الدوري في التوزيع الإلكتروني لذرته؛ حيث :
- يشير رقم الدورة في الجدول الدوري إلى عدد المستويات في التوزيع الإلكتروني للذرة
- يشير رقم المجموعة (العمود) في الجدول الدوري إلى عدد إلكترونات مستوى الطاقة الخارجي للذرة (إلكترونات التكافؤ)
- الخصائص الدورية في الجدول الدوري :
- تتغير خصائص العناصر في الدورة الواحدة بالإتجاه من اليسار إلى اليمين، ويتكرر هذا التغير بشكل منتظم في كل دورة
- تتفاوت خصائص عناصر المجموعة الواحدة بالإتجاه من الأعلى إلى الأسفل، ويتكرر ذلك لكل مجموعة بشكل منتظم
- الدورية : هي التغيرات المتكررة التي تحدث في خصائص العناصر في كل دورة .
- يستفاد من الدورية في :
- التنبؤ بسلوك العناصر وخصائصها فمثلًا :
يمكن التنبؤ بحجوم الذرات بناءً على موقعها في الجدول الدوري كما في الشكل الآتي الذي يبين تغير حجوم ذرات العناصر الممثلة في الجدول الدوري.
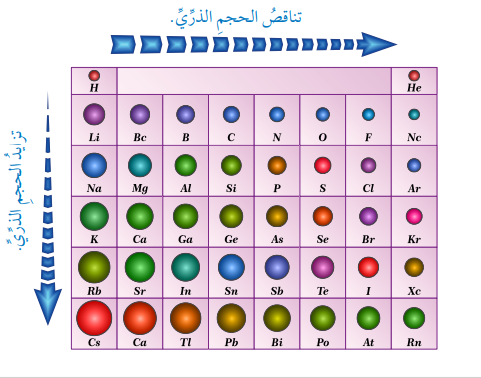
- يلاحظ من الشكل :
+ تناقص حجوم الذرات بزيادة العدد الذري في الدورة الواحدة أي (بالإتجاه من اليسار إلى اليمين )
. نجد في الدورة الواحدة أن ذرات الفلزات على اليسار هي الأكبر حجمًا في كل دورة بينما ذرات الغازات النبيلة على اليمين هي الأصغر حجمًا فمثلًا :
.. ذرة الليثيوم Li على يسار الدورة الثانية هي الأكبر حجمًا وتقل حجوم الذرات بالإتجاه إلى اليمين وصولًا إلى ذرة النيون Ne التي هي أصغر الذرات حجمًا في هذه الدورة .
.. ذرة الصوديوم Na هي الأكبر حجمًا على يسار الدورة الثالثة، وتتناقص حجوم الذرات بالإتجاه إلى اليمين وصولًا إلى ذرة الأرغون Ar في نهاية الدورة.
+ في المجموعات :
. يلاحظ من الشكل السابق أن :
. أن حجوم الذرات تتزايد بالإتجاه من من الأعلى إلى الأسفل في المجموعة الواحدة فمثلًا :
.. ذرة البيريليوم Be في المجموعة الثانية هي الأصغر حجمًا وبالإتجاه للأسفل تزداد حجوم الذرات وصولاً إلى ذرة الباريوم Ba الأكبر حجمًا في هذه المجموعة .
- نشاط العناصر (Reactivity of Elements) :
- يؤثر الحجم الذري في العديد من الخصائص الكيميائية للعنصر، فالنشاط الكيميائي يعتمد على حجم ذراته فمثلًا :
- الفلزات على يسار الجدول يزداد حجمها بالإتجاه إلى أسفل في المجموعة الواحدة وبذلك يزداد نشاطها الكيميائي وذلك لأن نشاطها الكيميائي يعتمد على فقدها الإلكترونات وتكوين ذراتها أيونات موجبة في مركباتها، وبزيادة حجوم الذرات تصبح إلكترونات المستوى الخارجي أبعد عن النواة؛ ما يسهل فقدانها .
- يمكن لذرات الفلز الأكبر حجمًا أن تتفاعل بسهولة أكبر مع العناصر الأخرى وتكوّن مركبات .
- في الدورات بالإتجاه إلى اليمين تقل حجوم الذرات وبذلك يقل نشاطها الكيميائي.
- اللافلزات : إن نشاطها الكيميائي يعتمد على إكتسابها أو جذبها للإلكترونات، وكلما قلت حجوم الذرات أصبحت إلكترونات المستوى الأخير أكثر قربًا إلى النواة، وأصبح من السهل على الذرة إكتساب الإلكترونات أو جذبها ونظرًا إلى صغر حجوم ذرات اللافلزات، فإنه عند تفاعلها مع الفلزات تكسب إلإلكترونات وتكون ذراتها أيونات سالبة .
- إن نشاط اللافلزات يزداد بنقصان حجوم ذراتها .
- إن ذرات اللافلز الأًصغر حجمًا تتفاعل بسهولة أكبر من ذرات اللافلز الأكبر حجمًا مع العناصر الأخرى.
التوزيع الإلكتروني والخصائص الكيميائية :
تتضمن الدورة في الجدول الدوري عددًا من العناصر يزداد عددها الذري بالإتجاه من اليسار إلى اليمين في الدورة إلا إن عناصر الدورة جميعها يكون لها العدد نفسه من مستويات الطاقة .
- بالنسبة للمجموعات :
- نجد أن : عناصر المجموعة الواحدة تمتلك العدد نفسه من الإلكترونات في المستوى الخارجي ومن ثم فإنها تتشابه في خصائصها الكيميائية.
- بعض مجموعات الجدول الدوري وبعض خصائصها الكيميائية :
- المجموعة الأولى Group (1A):
- تسمى عناصر هذه المجموعة بــ( الفلزات القلوية Alkali Metals) بإستثناء الهيدروجين.
- بشكل عام: تكون صفات هذه الفلزات هي :
- لامعة
- لينة
- يسهل قطعها بالسكينة
- لها درجتي إنصهار وغليان منخفضتان مقارنة بالفلزات الأخرى
- تتفاعل هذه الفلزات بشدة مع الهواء لذلك تحفظ في معتزل عنه.
- تتفاعل هذه الفلزات بشدة مع الماء مكونة هيدروكسيدات
- معلومة مهمة : " تتفاوت عناصر المجموعة الأولى في شدة تفاعلها مع الماء تبعًا لنشاطها الذي يزداد بالإتجاه إلى الأسفل في المجموعة"
- المجموعة الثانية Group (2A):
- تسمى عناصر هذه المجموعة بــ ( الفلزات القلوية الأرضية Alkaline Earth Metals)
- توجد عناصر هذه المجموعة في القشرة الأرضية على شكل صخور السيليكات والكربونات والكبريتات ومن صفاتها :
- قليلة الذوبان في الماء
- أكثر صلابة وكثافة من عناصر المجموعة الأولى
- أقل نشاطًا كيميائيًا من عناصر المجموعة الأولى حيث يعد ( عنصر البيريليوم أقلها نشاطًا و عنصر الباريوم أكثرها نشاطًا )
- يعد الكالسيوم والمغنيسيوم أكثرها نشاطًا وأكثرها أهمية تجارية .
- المجموعة الثالثة Group (3A):
- تستخدم عناصر هذه المجموعة في عدة مجالات فمثلًا :
- يستخدم البورون في صناعة أواني الطبخ الزجاجية التي يمكن وضعها في الفرن أو (المايكروويف) مثل البايركس
- يستخدم الألمنيوم في صناعة هياكل الطائرات وصناعة الأسلاك الكهربائية .
- يستخدم الغاليوم في صناعة رُقاقات الحاسوب .
- تستخدم بعض مركبات الإنديوم في صناعة شاشات الكريستال السائل.
- المجموعة الرابعة Group (4A):
- أن عناصر هذه المجموعة تحتلف في صفاتها، فبعضها لا فلز مثل ( عنصر الكربون (C) )، وبعضها شبه فلز مثل : ( عنصري السيليكون(Si) والجرمانيوم(Ge) ) وبعضها من الفلزات مثل : ( عنصري الرصاص(Pb) والقصدير(Sn) )
- يوجد تنوع كبير في إستخدام هذه العناصر العناصر مثل :
- يدخل الكربون في تركيب أجسام الكائنات الحية ويستخدم في صناعة أنواع البلاستيك المحتلفة وصناعة الأدوية
- السيليكون هو أكثر العناصر إنتشارًا في القشرة الأرضية فيدخل في تركيب معدن الكوارتز الموجود بكثرة في الرمل والذي يعد المكون الأساسي في صناعة الزجاج .
- يستخدم الجرمانيوم في صناعة الأجهزة الإلكترونية.
- يستخدم الرصاص في صناعة الألبسة الواقية من الأشعة السينية وأيضًا في صناعة الجدران الواقية من تسرب الأشعة في المفاعلات النوورية .
- يستخدم القصدير في صناعات عديدة أشهرها حشوةِ الأسنان.
- المجموعة الخامسةGroup (5A):
- يعد عنصري النيتروجين والفسفور من اللافلزات وهما يدخلان في تركيب الحموض النووية المسؤولة عن التركيب الوراثي في أجسام الكائنات الحية
- يعد غاز الأمونيا NH3 من أشهر مركبات النيتروجين
- يستخدم النيتروجين في العديد من الصناعات مثل صناعة الأسمدة النيتروجينية
- يستخدم الفسفور في صناعة أعواد الثقاب وصناعة الأسمدة الفوسفاتية.
- تتضمن المجموعة الخامسة عناصر أخرى مثل الزرنيخ (As)، و الأنتيمون(Sb) وهما من أشباه الفلزات وأيضًأ عنر البيزموث (Bi) الذي يعد من الفلزات ويدخل في تركيب الأدوية المعالجة لحموضة المعدة.
- المجموعة السادسةGroup (6A):
- من أشهر عناصر هذه المجموعة الأكسجين (O) والكبريت (S) وهما من العناصر الأساسية للحياة.
- الأكسجين ضروري لإنتاج الطاقة من الغذاء في أجسام الكائنات الحية .
- الكبريت فهو لا فلز صُلب أصفر اللون يدخل في صناعة حمض الكبريتيك H2SO4 الذي يستخدم في الكثير من الصناعات.
- تشمل هذه المجوعة عناصر أخرى مثل: السيلينيوم (Se) وهو عنصر موصل للتيار الكهربائي ويستخدم في بناء الخلايا الشمسية وفي ألاتِ التصوير الضوئي.
- المجموعة السابعة Group (7A):
- تسمى عناصر هذه المجموعة بــ ( الهالوجينات Halogens) أو مكوِنات الأملاح
- أن المستوى الخارجي لذراتها يحتوي على 7e فهي تكسب 1e عند تفاعلها مع الفلزات وتكون أيونات أحادية سالبة (-1)
- تكون مركبات متشابهة فمثلًا : جميعها تتفاعل مع الصوديوم بسهولة مكونة مركبات متشابهة في صيغتها الكيميائية مثل: (NaF, NaCl, NaBr, NaI)
- الهالوجينات جميعها لا فلزات تختلف في خصائصها الفلزية :
- الفلور غاز أصفر باهت اللون شديد التفاعل
- الكلور غاز أخضر باهت اللون
- البروم سائل بني محمر اللون
- اليود مادة صلبة سوداء لامعة
- الأستاتين (At) فهو شبه فلز مشع، وهو مادة سوداء اللون نادرة الوجود في الطبيعة
- تستخدم الهالوجينات في مجالات واسعة مثل :
- الفلور يستخدم في صناعة معجون الأسنان وتدخل مركبات الفلور في صناعة المبلمرات مثل التيفلون .
- الكلور يستخدم في تعقيم المياه وصناعة المنظفات .
- يستخدم البروم في صناعة المبيدات الحشرية .
- يستخدم اليود معقمًا وغيرها من الإستخدامات .
- المجموعة الثامنة Group (8A):
- أن المستوى الخارجي لذرات هذه العناصر ممتلئًا بالإلكترونات؛فهو يحتوي على 8e، ما عدا الهيليوم الذي يكون مستواه الخارجي ممتلئًا بالالكترونين فقط.
- لا تكتسب الإلكترونات أو تفقدها بسهولة مما يجعلها قليلة النشاط الكيميائي؛ وتوصف بأنها مستقرةٌ كيميائية
- توجد في الطبيعة على شكل ذرات في الحالة الغازية
- يطلق عليها إسم ) الغازات النبيلة Noble Gases)
-
معلومة مهمة : " بالرغم من قلة النشاط الكيميائي للغازات النبيلة إلا أن العلماء تمكنوا من تحضير بعض المركبات لعناصر هذه المجموعة في المختبر مثل :
1.ثنائي فلوريد الكربتون KrF2
2. فلوروهيدريد الأرغون HArF "
- للغازات النبيلة العديد من الإستخدامات فمثلًا :
- يستخدم الهيليوم في تعبئة بالونات الرصد الجوي والمناطيد.
- يستخدم النيون في صناعة أنابيب الإضاءة الحمراء والملونة .