- المفاهيم والمصطلحات :
عزيزي الطالب ستتعرف في هذا الدرس على هذه المفاهيم والمصطلحات العلمية :
|
العدد الذري |
Atomic Number |
|
التوزيع الإلكتروني |
Electronic Configuration |
|
مبدأ أوفباو |
Aufbau |
|
قاعدة هوند |
Hund’s Rule |
|
العناصر الممثلة |
The Representative Elements |
|
العناصر الإنتقالية |
Transition Elements |
|
التأين |
Ionization |
- مبادئ وقواعد التوزيع الإلكتروني للذرات ((Principles of Electronic Configuration
- تذكر: أنه يمكن وصف الإلكترون وطاقته ومعدل بعده عن النواة بإستخدام أعداد الكم.
- الذرة تترتب فيها الإلكترونات وفق مستويات الطاقة المختلفة وهذا ما يعرف بإسم ( التوزيع الإلكتروني)
- يراعى العدد الذري عند البدء بعملية التوزيع الإلكتروني
ملاحظة (1) : العدد الذري يمثل عدد البروتونات في نواة الذرة أو عدد الإلكترونات في الذرة المتعادلة
- مبدأ أوفباو للبناء التصاعدي (Aufbau Principle) :
نص مبدأ أوفباو: " امتلاء الأفلاك بالإلكترونات تبعًا لتزايد طاقتها، بحيث تتوزع الإلكترونات أولًا في أدنى مستوى للطاقة ثم تملأ المستويات العليا للطاقة"
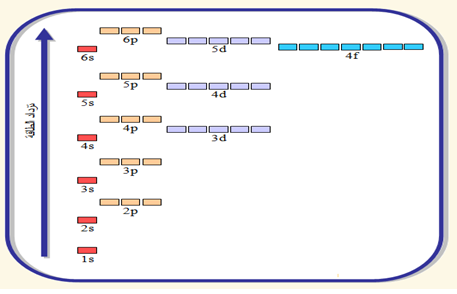
الشكل الآتي يبين ترتيب المستويات الفرعية تصاعديًا بحسب طاقة كل منها : ( ترتيب الأفلاك بحسب الطاقة ):
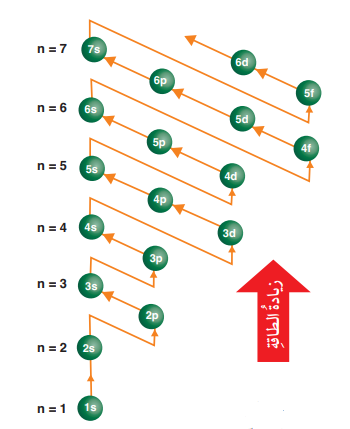 |
شكل مبسط يوضح ترتيب المستويات الفرعية تصاعديًا
|
- يلاحظ من الشكل السابق أن طاقة المستويات الفرعية تزداد عند زيادة عدد الكم الرئيس (n)، وأن المستويات تبدأ بالتداخل بعد المستوى الفرعي 3p
- يمكن تحديد المستوى الفرعي الأقل طاقة من مجموع (n +ℓ ) إذ تملأ الإلكترونات بالمستوى الأقل مجموعًا (n +ℓ )
- في حال كان مجموع (n +ℓ ) متساويًا :
- فإن المستوى الفرعي الأقل طاقة (الذي سيملأ أولاً) يكون الأقل قيمة (n)
مثال (1) :
ما السبب في أن المستوى الفرعي 4s يملأ بالإكترونات قبل المستوى 3d :
الإجابة :
لأن مجموع (n +ℓ ) للمستوى 4s = (0 + 4( = 4
لكن مجموع (n +ℓ ) للمستوى 3d = ( 2 + 3) = 5
بالتالي فإن طاقة المستوى 4s هو الأقل طاقة من المستوى 3d وحسب مبدأ أوفباو فإن المستوى الأقل طاقة يملأ أولاً بالإلكترونات .
مثال (2) :
أي المستويين الآتيين سيملأ أولًا بالإلكترونات (6p , 5d)
الإجابة:
في البداية نجد مجموع (n +ℓ ) لكل مستوى ومن ثم نحدد من الذي سيملأ أولًا حيث أن المستوى الأقل طاقة هو الذي سيملأ أولًا:
مجموع (n +ℓ ) للمستوى 6p = (1 + 6) = 7
مجموع (n +ℓ ) للمستوى 5d = (2 + 5) = 7
نلاحظ أن مجموع (n + ℓ) متساوي للمستويين الحل الأن يكون حسب قيمة (n) والذي يكون له أقل قيمة (n) سيملأ أولًا
إذًا المستوى الفرعي 5d سيملأ بالإلكترونات أولًا
مثال (3) :
رتب الأفلاك الأتية تصاعديًا وفق طاقتها :
(3s, 2p, 3d, 4s)
الإجابة:
للبدء بالترتيب نجد قيمة لجميع الأفلاك المطلوبة :
قيمة (n +ℓ ) للفلك 3s = (0 + 3) = 3
قيمة (n +ℓ) للفلك 2p = (1 + 2) = 3
هنا تساوت قيمة (n +ℓ ) نرجع لقيمة n الأقل لنحدد الفلك الأقل طاقة فيكون الفلك 2p هو الأقل طاقة من الفلك 3s
قيمة (n +ℓ ) للفلك 3d = (2 + 3) = 5
قيمة (n +ℓ ) للفلك 4s = (0 + 4) = 4
إذا الترتيب يصبح 3d > 4s > 3s > 2p
- ملاحظة (2) :
يمكن تعبئة الإلكترونات في مستويات الطاقة الفرعية وفق الترتيب الآتي :
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, .......
مثال (4) :
أي المستويين الفرعيين أقل طاقة : 5p أم 4f
الإجابة:
مجموع قيم (n +ℓ ) للمستوى 5p = ( 1 + 5) = 6، ومجموعها للمستوى 4f هو (3 + 4( والذي يساوي 7 لذا فإن المستوى 5p هو الاقل طاقة، مما يعني أنه سيملأ أولًا بالإلكترونات قبل المستوى 4f .
مثال (5) :
أي المستويين الفرعيين أقل طاقة : 5f أم 7p
الإجابة:
مجموع قيم (n +ℓ ) للمستوى 7p = ( 1 + 7) = 8، ومجموعها للمستوى 5f هو (3 +5 ( والذي يساوي 8 وبما أن مجموع (n +ℓ )
للمستويين متساوي إذا نلجأ لقيمة (n) وصاحب قيمة (n) الأقل هو الذي سيملأ أولًا بالإلكترونات ( المستوى الأقل طاقة )
ونلاحظ أن قيمة (n) للمستوى 5f = 5 وللمستوى 7p = 7
إذا المستوى الفرعي الأقل طاقة هو 5f
- قاعدة هوند (Hund’s Rule) :
نص قاعدة هوند : " توزع الإلكترونات بصورة منفردة على أفلاك المستوى الفرعي الواحد بإتجاه الغزل نفسه، ثم إضافة ما تبقى من الإلكترونات إلى الأفلاك بإتجاه مغزلي معاكس"
- الفائدة من هذه القاعدة في التوزيع : توفير الحد الأدنى للطاقة والقدر الأقل من التنافر بين الإلكترونات داخل أفلاك المستويات الفرعية
مثال للتوضيح :
في حال ملءِ أفلاك المستوى الفرعي p بالإلكترونات، فإنها توزع منفردة على الأفلاك (px, py, pz) في إتجاه الغزل نفسه وعند إضافة الإلكترون الرابع والإلكترون الخامس؛ فإنها تضاف في إتجاه غزل معاكس .
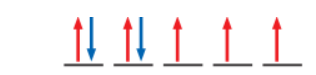
- الشكل الآتي يبين خطوات توزيع خمسة إلكترونات على أفلاك p الفرعية بحسب قاعدة هوند:
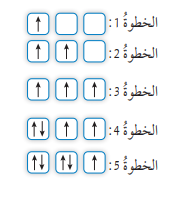
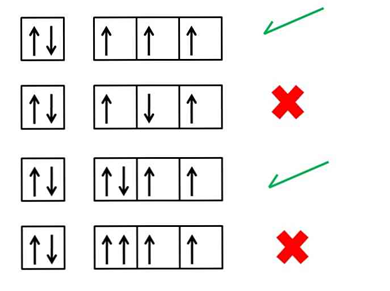
- الخلاصة للتوزيع الصحيح للإلكترونات حسب قاعدة هوند :
سؤال(1) :
أكتب التوزيع الإلكتروني لسبعة إلكترونات على أفلاك d الخمسة بحسب قاعدة هوند محددًا عدد الإلكترونات المنفردة :
الإجابة :
سؤال(2) :
أُرتب المستويات الفرعية الآتية تصاعديًا وفق طاقتها :
5p, 3d, 6p, 5d, 7p
الإجابة :
7p > 6p > 5d > 5p > 3d
- يحدد التوزيع الإلكتروني وفق قاعدة هوند حيث يمكن تحديد عدد الإلكترونات المنفردة في أفلاك المستوى الفرعي الواحد
فمثلًا :
- يمتلك النيتروجين N7 ثلاث إلكترونات منفردة موزعة على على أفلاك P بالشكل الآتي : 
- يمتلك الحديد Fe26 أربعة إلكترونات منفردة تتوزع على أفلاك المستوى d بالشكل الآتي : 
- دلالة التوزيع الإلكتروني :
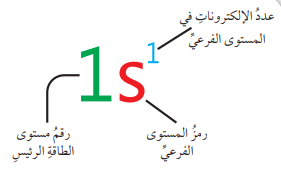
- التوزيع الإلكتروني لذرة الهيدوجين والتي عددها الذري (1)، وتوزيعها (1s1)
- التوزيع الإلكتروني لذرة الهيليوم والتي عدد الذري (2)، وتوزيعها (1s2)
- وبما أن المستوى الفرعي s لا يتسع سوى لإلكترونين فإن وجود إلكترون ثالث كما في ذرة الليثيوم التي عددها الذري يساوي 3
- التوزيع الإلكتروني لذرة الليثيوم والتي عددها الذري (3)، وتوزيعها يكون (1s2 2s1)
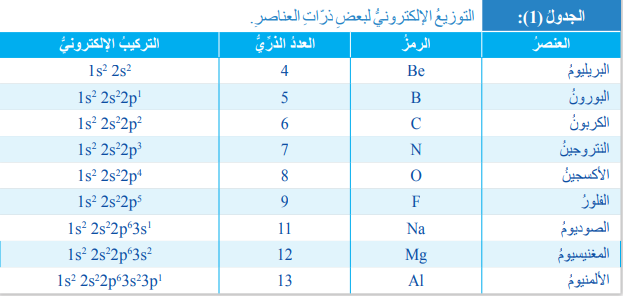
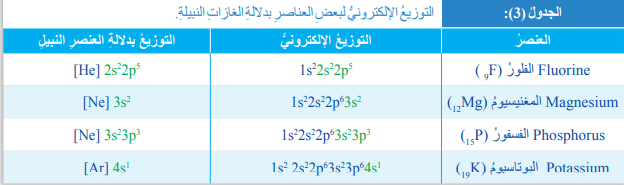
- الجدول الآتي يبين التوزيع الإلكتروني لبعض ذرات العناصر :
- التوزيع الإلكتروني بدلالة الغازات النبيلة :
- تمتاز ذرات عناصر الغازات النبيلة بإمتلاء أفلاك مستواها الخارجي بالإلكترونات
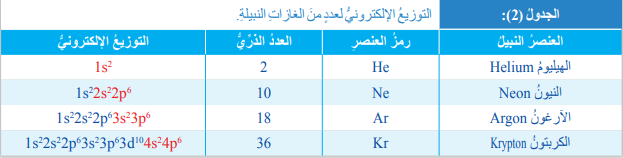
- لجدول الآتي يبين التوزيع الإلكتروني لعدد من الغازات النبيلة :
- يستفاد من هذا التوزيع في كتابة التوزيع الإلكتروني لذرات العناصر الأخرى بدلالة الغازات النبيلة؛ وذلك من خلال إستبدال توزيع إلكترونات المستويات الداخلية ليحل محله رمز الغاز النبيل الذي يماثلها في التوزيع
- الجدول الآتي يبين التوزيع الإلكتروني لعدد من ذرات العناصر بدلالة الغاز النبيل :
- الربط بالحياة ( منطاد مملوء بغاز الهيليوم ): يمتاز غاز الهيليوم He بكثافته المنخفضة مقارنة ببقية الغازات، ويعد غازًا أمنًا غير سام، وغير قابلٍ للإشتعال أو الإنفجار؛ نظرًا إلى قلة نشاطه الكيميائي؛ لذا تملأ به المناطيد، والبالونات الطائرة والغواصات البحرية.
سؤال(3):
أكتب التوزيع الإلكتروني بدلالة الغاز النبيل لكل من الذرتين :
N7 (عددها الذري 7) ، Si14 (عددها الذري 14)
الإجابة :
N7 (عددها الذري 7): [He] 2s2 2p3
Si14 (عددها الذري 14): [Ni] 3s2 3p2
- تصنيف العناصر :
- يتكون الجدول الدوري من 7 دورات تمثل المستويات الرئيسية للطاقة حول النواة.
- يضم الجدول الدوري 18 مجموعة.
- تترتب العناصر المتشابهة في خصائصها الكيميائية في مجموعة واحدة.
- تقسم عناصر الجدول الدوري لقسمين رئيسين وهما :
1) العناصر الممثلة 2) العناصر الإنتقالية
- العناصر الممثلة (Representative Elements) :
- يرمز لها بالرمز A
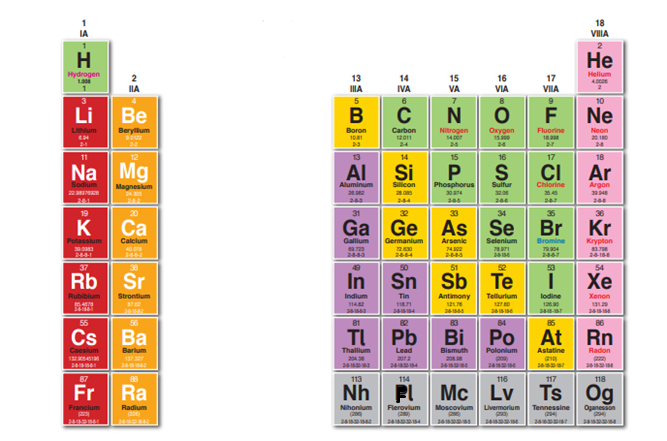
- تضم 8 مجموعات تمثلها الأرقام ( 1, 2 , 13, 14, 15, 16, 17, 18) وقد تمثلها الأرقام اللاتينية فمثلًا يعبر عن المجموعة 18 بالرقم (VIIIA) وتعني المجموعة (8) في العناصر الممثلة.
- الشكل الآتي يمثل مجموعات العناصر الممثلة في الجدول الدوري
يلاحظ عند كتابة التوزيع الإلكتروني لهذه العناصر أن الإلكترون الأخير يضاف إلى أفلاك المستوى الفرعي (s أو p) حيث يشير مجموع إلكترونات (s وَ p) في المستوى الخارجي إلى رقم مجموعة العنصر ويشير أعلى رقم للمستوى (n) إلى رقم دورة العنصر في الجدول الدوري
فمثلًا :
إذا كان التوزيع الإلكتروني لعنصر هو : ( 1s2 2s2 2p3) :
فإن مجموع إلكترونات المستوى الخارجي (2s , 2p) هو (5) فيكون رقم مجموعة العنصر هو (5) في العناصر الممثلة، في حين يكون رقم دورة العنصر هي أعلى رقم (n) في التوزيع وهي (2) إذا هذا التوزيع الإلكتروني هو لعنصر موجود في المجموعة الخامسة الدورة الثانية وعند البحث في الجدول الدوري عن هذا العنصر يتبين أن النيتروجين N.
- العناصرالإنتقالية (Transition Elements) :
- هي عناصر تقع في وسط الجدول الدوري
- يضاف الإلكترون الأخير في توزيعها إلى المستوى الفرعي (f أو d)
- يرمز لها بالرمز B
- تقسم العناصر الإنتقالية لقسمين وهما :
1) العناصر الإنتقالية (Transition Elements)
2) العناصر الإنتقالية الداخلية ( Inner Transition Elements)
- الشكل الآتي يمثل مجموعات العناصرالإنتقالية في الجدول الدوري
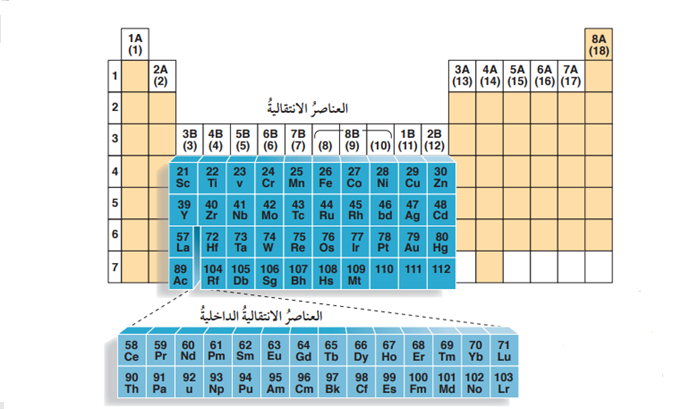
1) العناصر الإنتقالية (Transition Elements):
تتكون هذه العناصر من (10) مجموعات في الجدول الدوري، ويضاف الإلكترون الأخير في التوزيع الإلكتروني لذرات عناصرها إلى أفلاك المستوى الفرعي d
2) العناصر الإنتقالية الداخلية ( Inner Transition Elements)
تتكون هذه العناصر من (14) مجموعة في الجدول الدوري، ويضاف الإلكترون الأخير في التوزيع الإلكتروني لذرات عناصرها إلى أفلاك المستوى الفرعي f
- رقم المجموعة بالنسبة للعناصر الإنتقالية يساوي مجموع إلكترونات s في المستوى الخارجي (n)، ومجموع إلكترونات d(n-1) للمجموعات (3 – 7) B بحسب القاعدة الآتية:
رقم المجموعة = إلكترونات ns + إلكترونات d(n – 1)
- في حال كان المجموع (8) أو (9) أوB(10) فإن رقم المجموعة يكون B(8) التي تضم 3 أعمدة نظرًا للتشابه الكبير في خصائص عناصرها.
- المجموعتان B(2), B(1) على الترتيب فيحدد رقم كل منهما بناءً على عدد إلكترونات s في المستوى الخارجي
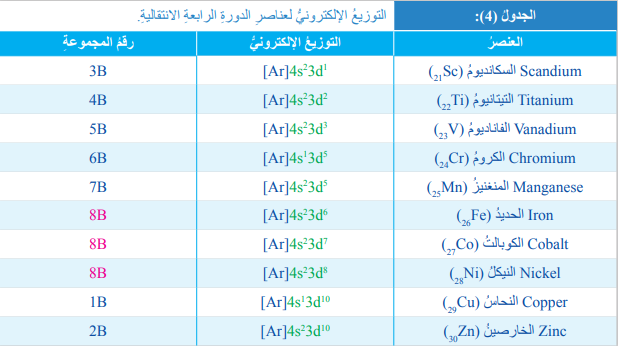
- الجدول الآتي يبين التوزيع الإلكتروني لعناصر الدورة الرابعة الإنتقالية B وأرقام مجموعاتها :
- يمكن إستخدام بنية الجدول الدوري في التعرف على التوزيع الإلكتروني للعنصر بناءً على موقعه في الجدول الدوري حيث أن :
- الجدول الدوري ينقسم إلى (4) أقسام؛ وأن كل قسم منها يضم عددًا من الأعمدة مساويًا لسعة المستويات الفرعية التي ينتهي بها التوزيع الإلكتروني فمثلًا :
- العناصر التي ينتهي توزيعها الإلكتروني بالمستوى الفرعي s تقع ضمن العمودين : 2A و 1A
- العناصر التي ينتهي توزيعها الإلكتروني بالمستوى الفرعي p تقع ضمن العمودين : (8A – 3A) وكذلك هو حال العناصر الإنتقالية.
- الشكل الآتي يبين تقسيم الجدول الدوري بحسب المستويات الفرعية الخارجية التي ينتهي بها التوزيع:
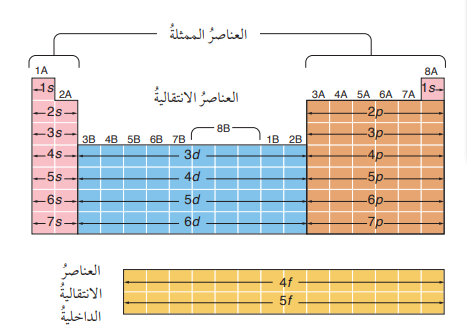
سؤال(4):
أكتب التوزيع الإلكتروني للعنصر الذي يقع في المجموعة الثانية A، والدورة الرابعة :
الإجابة :
بما أن العنصر هو أحد عناصر المجموعة الثانية A فإن الفلك الخارجي له هو s2 ولأن الدورة الرابعة تشير إلى n = 4، فإن الفلك الأخير هو 4s2 وإن الأفلاك التي تسبقه تملأ، فيصبح توزيعه الإلكتروني : [Ar] 4s2 وعدد الذري 20.
الربط بالحياة ( إستخدام التيتانيوم في الطب) :
- يعد التيتانيوم Ti22 فلزًا مهمًا من الناحية الإقتصادية والصناعية؛ نظرًا إلى صفاته التي جعلته منافسًا قويًا في العديد من المجالات الصناعية؛ إذ يمتاز بخفة وزنه، وصلابته الكبيرة، إضافةً إلى قلة نشاطه الكيميائي، وعدم تأثره بعوامل البيئة.
- يستخدم التيتانيوم على نطاق واسع في الطب، إذ يدخل في صناعة المفاصل البديلة، مثل مفصل الورك ومفصل الركبة، ويستخدم في علاج الإنزلاقات الغضروفية في العمود الفقري، ويدخل أيضًا في صناعة صفائح الجمجمة، وبراغي الأسنان والفك الصناعي وغير ذلك من الإستخدامات الطبية المهمة .
مثال (6) :
أكتب التوزيع الإلكتروني للعنصر الإفتراضي X الذي يقع في المجموعة السادسة A، والدورة الثالثة :
الإجابة :
إن المجموعة السادسة تمثل العمود الرابع من المنطقة p، وإن رقم الدورة يمثل رقم المستوى الخارجي n ، فيكون المستوى الخارجي 3p4 ويكون التوزيع الإلكتروني كما يلي :
X: 1s2 2s2 2p6 3s2 3p4
مثال (7) :
أكتب التوزيع الإلكتروني للعنصر الإفتراضي Y الذي يقع في المجموعة الخامسة B ، والدورة الرابعة :
الإجابة :
إن المجموعة الخامسة B تقع في العمود الثالث من المنطقة d، أي أن المستوى d لهذا العنصر يحتوي على 3 إلكترونات، وبما أنه من الدورة الرابعة فإن توزيعه الإلكتروني ينتهي بـ 4s23d3 ويكون التوزيع الإلكتروني له بالشكل الآتي :
Y: 1s2 2s2 2p6 3s2 3p6 4s2 3d3
- التوزيع الإلكتروني لأيونات العناصر :
- تميل ذرات العناصر إلى كسب الإلكترونات أو فقدها للوصول إلى توزيع يسبه توزيع الغازات النبيلة في ما يعرف بـ التأين
- تؤدي عملية التأين إلى التغير في عدد الإلكترونات ثم إختلاف في توزيعها الإلكتروني .
- تنشأ الأيونات الموجبة نتيجة فقد الإلكترونات من المستوى الخارجي للذرة فمثلًا:
التوزيع الإلكتروني لذرة الصوديوم Na11: 1s2 2s2 2p6 3s1
التوزيع الإلكتروني لأيون الصوديوم Na1+11: 1s2 2s2 2p6
- تضاف الإلكترونات المكتسبة في الأيونات السالبة إلى المستوى الخارجي للذرة فمثلًا :
التوزيع الإلكتروني لذرة الكلور Cl17: 1s2 2s2 2p6 3s2 3p5
التوزيع الإلكتروني لأيون الكلوريد -1Cl17: 1s2 2s2 2p6 3s2 3p6
مثال (8) :
أكتب التوزيع الإلكتروني لأيون المغنيسيوم Mg2+12 :
الإجابة :
التوزيع الإلكتروني لذرة المغنيسيوم Mg 12 : 1s2 2s2 2p6 3s2
التوزيع الإلكتروني لأيون المغنيسيوم Mg2+12 : 1s2 2s2 2p6
ذرة المغنيسيوم فقدت الكترونين وتحولت لأيون للوصول إلى التوزيع الإلكتروني الذي يشبه التوزيع الإلكتروني للعنصر النبيل
يمكن كتابة التوزيع الإلكتروني لأيون المغنيسيوم بدلالة العنصر النبيل بالصورة الآتية :
Mg2+: [Ne]12
مثال (9) :
أكتب التوزيع الإلكتروني لأيون النيتروجين N3-7:
الإجابة :
التوزيع الإلكتروني لذرة النيتروجين N7 : 1s2 2s2 2p3
التوزيع الإلكتروني لأيون النيتروجين N-37: 1s2 2s2 2p6
إن ذرة النيتروجين قد اكتسبت 3 إلكترونات من أجل الوصول إلى التوزيع إلكتروني الذي يشبه التوزيع الإلكتروني للعنصر النبيل
يمكن كتابة التوزيع الإلكتروني لأيون النيتروجين بدلالة العنصر النبيل بالصورة الآتية :
N3-: [Ne]7
ملاحظة (3):
تُكَوّن العناصر الإنتقالية أيونات موجبة عند فقد عدد من الإلكترونات، إذ أنها تفقد الإلكترونات من المستوى الفرعي s الخارجي ثم من المستوى الفرعي d .
مثال (10) :
أكتب التوزيع الإلكتروني لأيون التيتانيوم Ti3+22:
الإجابة :
التوزيع الإلكتروني لفلز التيتانيوم Ti22: [Ar] 3d2 4s2
التوزيع الإلكتروني لأيون التيتانيوم Ti3+22 : [Ar] 3d1
لقد فقد 3 إلكترونات 2 من االمستوى 4s وإلكترون من المستوى 3d
سؤال(5):
أكتب التوزيع الإلكتروني لكل من الأيونات الآتية :
Ca2+, 16S2-, 28Ni2+, 26Fe3+20
الإجابة :
20Ca2+: 1s2 2s2 2p6 3s2 3p6
16S2-: 1s2 2s2 2p6 3s2 3p6
28Ni2+: 1s2 2s2 2p6 3s2 3p6 3d8
26Fe3+: 1s2 2s2 2p6 3s2 3p6 3d5