|
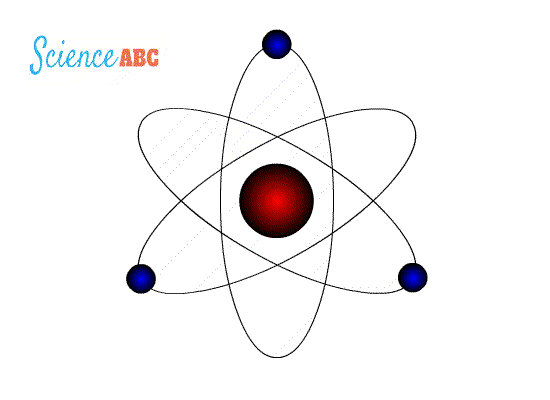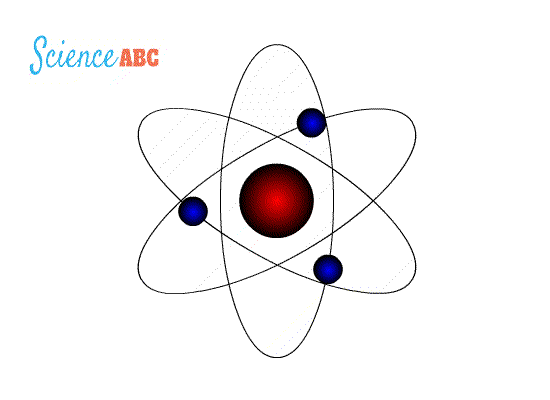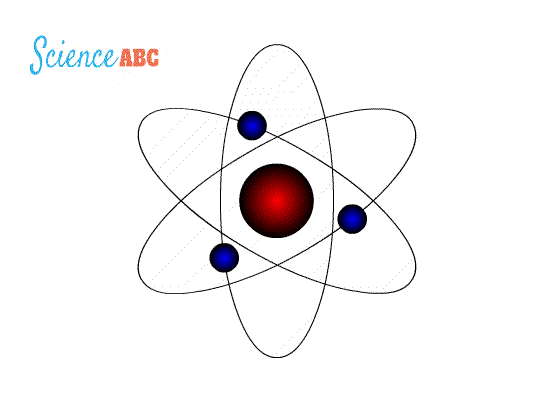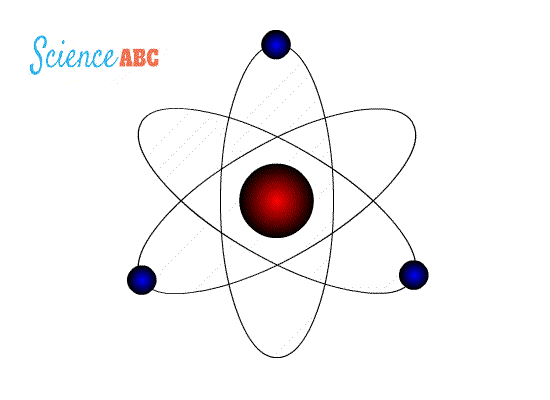
التركيب الذري (Atomic Structure): نموذج بور لذرة الهيدروجين : وضعت عدة نماذج لتفسير الذرة منها : 1- نموذج طومسون : إذ افترض أن الذرة عبارة عن كرة مصمتة موجبة الشحنة تتوزع فيها إلكترونات سالبة الشحنة لذلك فإن الذرة متعادلة كهربائيا لأن عدد الشحنات الموجبة يساوي الشحنات السالبة . 2- نموذج رذرفورد : حيث أثبت عدم صحة نموذج طومسون حيث افترض بناءا على تجربته المشهورة حيث قذف جسيمات ألفا على صفيحة من الذهب ولاحظ ما يلي : أ) أن الذرة تتكون من نواة موجبة تشغل حيزاً صغيراً جدا موجب الشحنةتتركز فيه معظم كتلة الذرة ب) إلكترونات سالبة تدور حول النواة كما تدور الكواكب حول الشمس، كما هو موضح في الشكل التالي: فشل هذا النموذج لأنه لم يستطع تفسير استقرار الذرة وسبب ذلك أن الإلكترون عندما يدور حول النواة يغير من اتجاه حركته باستمرار لذلك يتسارع مركزيا فيفقد طاقة على شكل مستمر أو متصل وبالتالي سينجذب نحو النواة يؤدي ذلك إلى انهيار التركيب الذري ونحن نعلم أن الذرة مستقرة والطاقة التي تشعها منفصلة ذات قيم محددة . ج) نموذج بور : تعارض مع نموذج رذرفورد في كيفية إشعاع الإلكترون للطاقة حيث افترض أن الإلكترون يفقد طاقة على شكل كمات محددة ( فوتونات ) وليس على شكل مستمر أو متصل وقد استخدم بور في بناء نموذجه : - مبدأ تكمية الطاقة لماكس بلانك . -نموذج رذرفورد السابق. -النموذج الجسيمي للإشعاع وبنى نموذجه على شكل فرضيات أربعة :
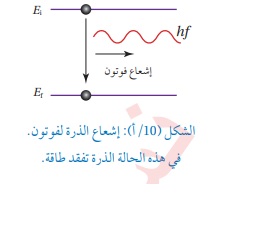
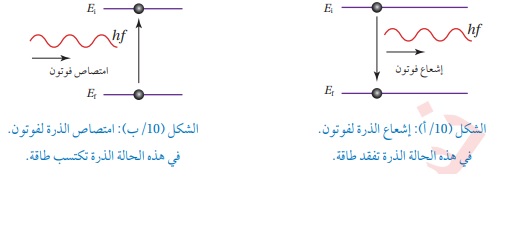
فرضيات بور لذرة الهيدروجين 1-يدور الإلكترون حول النواة بمسارات داخلية تحت تأثير قوة التجاذب الكهربائية بينه وبين النواة ( البروتون) 2- توجد مدارات محددة (مستويات طاقة ) مسموح للإلكترون بأن يحتلها ( يتواجد بها ) وإذا بقي بالمدار نفسه فلا يشع طاقةولا يمتصها 3- يشع الإلكترون طاقة أو يمتصها فقط إذا انتقل من مستوى طاقة إلى مستوى طاقة آخر حيث يشع طاقة على شكل فوتون عند انتقاله من مستوى طاقة أعلى إلى مستوى طاقة أقل كما في الشكل (10\أ)
ويمتص طاقة إذا انتقل من مستوى طاقة أقل إلى مستوى طاقة أعلى كما في الشكل (10\ب)
والطاقةالتي يشعها أو يمتصها تساوي فرق طاقتي المدارين (المستويين) .
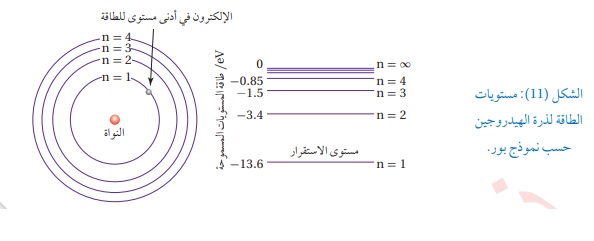
حيث: 4-المدارات المسموح للإلكترون أن يحتلها هي تلك التي يكون فيها مقدار زخمه الزاوي مضاعفات أي أن : حيث :n رقم المدار ويأخذ قيما صحيحة (1,2,3....)وهكذا me ;كتلة الإلكترون وتساوي r:نصف قطر مدار الإلكترون. ويمكننا حساب طاقة المدار بالمعادلة التالية : حيثn :هو :المدار ويسمى الرقم الكمي من المعادلة السابقة نستنتج أن 1- مستويات الطاقة غير متصلة (منفصلة) , أي تأخذ قيما محددة من الطاقة 2- هذه الطاقة مكماه , فمثلا وعند تطبيق العلاقة نلاحظ أن طاقة المدار الأول ( ( ( ملاحظات : نستطيع استنتاجها من الشكل (11).
1- المستوى الأول يسمى مستوى الاستقرار والمستويات الأخرى تسمى مستوياتالإثارة حيث عندما ينتقل الإلكترون بين هذه المدارات فإنه يمتص طاقة تسمى طاقة الإثارة وهي فرق الطاقة بين المستويين اللذين انتقل بينهم الإلكترون. 2- عندما ينتقل الإلكترون من أي مستوى إلى المالانهاية ( فإن الطاقة التي يمتصهاتسمى طاقة التأين , فمثلا طاقة التأين للمدار الأول = ( 3- تعريف طاقة التأين هي أقل طاقة لازمة لتحرير الإلكترون من الذرة دون إكسابه طاقة حركية سؤال؟؟؟ ماذا تعني الإشارة السالبة في قانون طاقة المدار ؟ تعني ضرورة تزويد الإلكترون بطاقة مقدارها ( افكر: ماذا يحدث للالكترون اذا زادت طاقة الفوتون الذي يمتصه على طاقة التأين ؟؟ الجواب : اذا امتص الكترون ذرة الهيدروجين طاقة اكبر من طاقة التاين هذا يعني انه تحرر الى الملانهاية وفي هذه الحالة فان الالكترون يمتلك الطاقة الزائدة على شكل طاقة حركية. ولكن اذا امتص طاقة اكبر من طاقة الاثارة حتى ينتقل بين المدارات فانه لا يغادر مداره لان الطاقة بين المدارات مكماة . مثال 10: اعتمادا على الشكل (11)أجد طاقة الفوتون المنبعث عند انتقال إلكترون ذرة الهيدروجين من مستوى الطاقة الثالث إلى مستوى الطاقة الثاني بوحدة ثم بوحدة j. الحل :
مثال 11: اعتمادا على الشكل (11)أجد طاقة الفوتون اللازمة لنقل الاكترون ذرة الهيدروجين من مستوى الاستقرار الحل:
مثال 12: لإلكترون في مستوى الطاقة الثاني لذرة الهيدروجين أجد ما يأتي: أ.الزخم الزاوي للاكترون ب.طاقة الإلكترون الحل: ب: مثال 13: أجد تردد الفوتون اللازم لنقل إلكترون ذرة الهيدروجين من مستوى الطاقة الثاني إلى مستوى الطاقة الثالث. الحل:
|
|
تمرين : انتقل إلكترون ذرة الهيدروجين من مستوى الطاقة ni إلى مستوى الطاقة الثاني ,فانبعث فوتون بطاقة أجد قيمة مستوى الطاقةni. الحل: لتسهيل الحل نحول الطاقة إلى وحدة إلكترون -فولت
سؤال خارجي: إذا كان الزخم الزاوي لإلكترون ذرة الهيدروجين في مدار ما تساوي الحل :
|
|
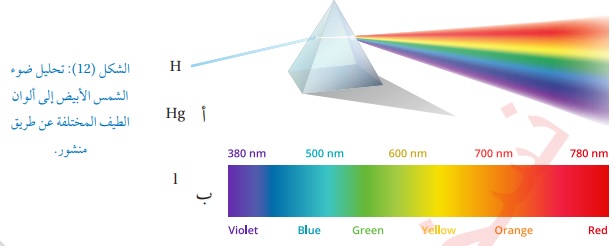
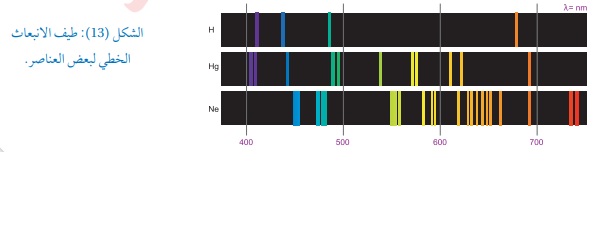
الأطياف الذرية : يوجد نوعان من الأطياف الأول : الطيف المتصل : هو ذلك الطيف الناتج من تحلل ضوء الشمس الأبيض بواسطةمنشور زجاجي كما يظهره الشكل(12/أ) حيث ينتج من التحلل سبعةألوان تسمى ألوان الطيف تبدأ باللون الأحمر وهو أطولها طول موجي وتنتهي باللون البنفسجي وهو أقصرها طول موجي وسمي متصلا لأنه يحتوي على كافة الأطوال الموجية كما يظهره الشكل التالي: الثاني : الطيف غير المتصل: وهو نوعان: أ/طيف الانبعاث الخطي ينتج من الذرات حيث أطياف الذرات ليست متصلة ولتفسير هذا الطيف نفترض وجود ذرة هيدروجين في مستوى الاستقرار فعندما يمتص إلكترونهافوتونا من الضوء فإنه ينتقل إلى مستوى أعلى من الطاقة فتصبح الذرة في مستوى إثارة وعندما تعود إلى مستوى الاستقرار تبعث فوتونا طاقتهEتساوي الفرق بين طاقتي المستويين اللذين انتقل بينهما . لذلك يكون للأشعة المنبعثة طولا موجيا محددا (لون محدد) وبتغير المستويان تتغير الطاقة المنبعثة فتبعث الذرة ألوانا مختلفة غير متصلة كما يظهره الشكل التالي: ويمكن تعريف طيفالانبعاث الخطي بأنه خطوط ملونة منفصلةعلى خلفية سوداء. ب/طيف الامتصاص الخطي : يظهر عند مرور ضوء الشمس خلال غاز عنصر معين فذرات الغاز تمتص أطوال موجية معينة فقط وبتحليل الطيف النافذ لوحظ وجود خطوط معتمة منفصلة على خلفية مضيئة كما يظهره الشكل التالي: والخطوط المعتمة ناتجة عن فقدان أطوال موجية معينة امتصتها ذرات الغاز وهي تقابل تماما الخطوط المضيئة التي ظهرت في طيف الانبعاث الخطي لذرات العنصر نفسه كما في الشكل (14/ب) فالأطوال الموجية الممتصة هي نفسها الأطوال الموجية التي يشعها الغاز ومن هنا نستطيع القول إن طيف العنصر مزية ( صفة )خاصة به كالبصمة للإنسان ولا يمكن لعنصرين أن يكون لهماالطيف الخطي نفسه . أتحقق: ما الفرق بين الطيف الناتج عن أشعة الشمس المرئية (ضوء الشمس)والطيف الناتج عن غاز عنصر ما عند عبور ضوء الشمس خلاله ؟؟؟ الجواب : يكون الطيف الناتج عن أشعة الشمس المرئية طيفا متصلايحتوي على كافة ألوان الطيف السبعة . أما الطيف الناتج عن غاز عنصر عند مرور ضوء الشمس خلاله يكون عبارة عن خطوط منفصلة عند أطوال موجية محددة ويسمى الطيف الخطي .
|
|
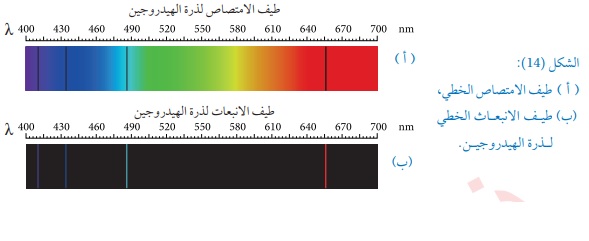
نموذج بور وطيف ذرة الهيدروجين: إن طيف ذرة الهيدروجين يعتبر أبسط أنواع الأطياف لأنها تحتوي على إلكترون واحد فقط والشكل (15)
يوضح الأطوال الموجية لطيف الانبعاث المرئي لذرة الهيدروجين . العالم بور نجح في حساب الأطوال الموجية لطيف ذرة الهيدروجين حيث يتم حساب الطاقة الناتجة من انتقال الإلكترون بين المدارات حسب المعادلة : حيث eشحنة الإلكترون وعند التعويض بدل التردد من المعادلة وقسمة المعادلة على المقدار نستطيع كتابة المعادلة على الصيغة التالية : حيث لقد نجح نموذج بور في تفسير الأطوال الموجية لذرة الهيدروجين إلا أنه فشل في تفسير أطياف الذرات عديدة الإلكترونات . أتحقق: هل نجح نموذج بور في التنبؤ بالأطوال الموجية لطيف انبعاث ذرة الهيدروجين ؟؟ الجواب : نعم نجح نموذج بور في ذلك لأن انتقال الإلكترون بين مستويات الطاقة يعطي طول موجي محدد والطاقة مكماة . أفكر : هل يمكن تفسير الأطياف الذرية باستخدام مفاهيم الفيزياء الكلاسيكية؟؟ أفسر إجابتي: الجواب: لم تنجح قوانين الفيزياء الكلاسيكية بقوانينها في تفسير الأطياف الذرية وذلك لأن الفيزياء الكلاسيكية تعتقد أن الطاقة المنبعثة تكون على شكل طيف متصل (متصلة )أي لا تحمل كما محددا من الطاقة. مثال 14: أجد طول موجة الفوتون المنبعث عند انتقال إلكترون ذرة الهيدروجين من مستوى الطاقة الثاني إلى مستوى الطاقة الأول. الحل:
مثال 15: أجد الأطوال الموجية للفوتونات المنبعثة عند انتقال إلكترون ذرة الهيدروجينمن مستوى الطاقة الثالث ,والرابع ,والخامس,والسادس إلى مستوى الطاقة الثاني . وأقارن الأطوال الموجية التي حصلت عليها بتلك الموجودة بالشكل (15),
وفي ضوء ذلك أناقش أفراد مجموعتي في صحة نموذج بور الحل: نكر حساب الطول الموجي عندما ينتقل الإلكترون من المستوى الرابع والخامس والسادس إلى المستوى الثاني ونحصل على القيم التالية للأطوال الموجية في الجدول التالي:
نلاحظ أن الأطوال الموجية تقع كلها ضمن الأطوال الموجية للطيف المرئي,وإن القيم المحسوبة من علاقة بور قريبة جدا من القيم التجريبية,مما يدل على صحة نموذج بور لذرة الهيدروجين. تمرين: انتقل إلكترون ذرة الهدروجين من مستوى الطاقة الرابع إلى المستوى الطاقة الأول حسب نموذج بور احسب طول موجة الفوتون المنبعث وتردده وطاقته وزخمه الخطي . الحل: اما التردد نحسبه من العلاقة: وطاقة الفوتون يمكن حسابها من العلاقة: ويمننا حساب الزخم الخطي للفوتون من العلاقة:
|
الطبيعة الموجيّة-الجُسيميّة المزدوجة Wave-Particle Duality
لقد تعلّمتُ أنّ بعض الظواهر المتعلقة بالضوء، مثل الحيود
والتداخل يمكن تفسيرها بافتراض أنّ الضوءَ موجاتٌ كهرمغناطيسية.
لكن توجد ظواهر أخرى، مثل: إشعاع الجسم الأسود، والظاهرة
الكهرضوئية، وظاهرة كومبتون، والأطياف الذريّة لا يمكن تفسيرها
إلا على افتراض أنّ الضوء يتكوّن من جُسيمات (فوتونات) تمتلك
زخمًا خطّيًّا يُحسب مقداره من العلاقة الآتية :
افترض العلماء أنّ للإشعاع الكهرمغناطيسي طبيعة موجيّة-جُسيميّة
مزدوجة Wave-particle duality of light . وعلى غرار الطبيعة الموجيّة-الجسيميّة
للإشعاع، اقترح العالم دي بروي de Broglie عام 1923 أنّ للأجسام الماديّة
طبيعة موجيّة. واستخدم العلاقة السابقة في حساب الطول الموجيّ لجسم
ما على النحو الآتي:
حيث λ: طول موجة دي بروي، ويُطلق عليها اسم الموجة المصاحِبة للجسم.
h: ثابت بلاك
p: مقدار الزخم الخطّي للجسم.
m: كتلة الجسم
v: سرعة الجسم
|
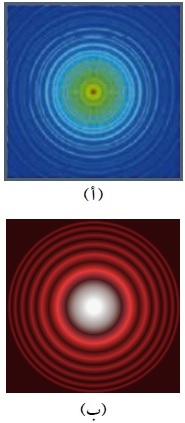
الموجات المصاحِبة للأجسام ليست موجات ميكانيكية أو كهرمغناطيسية، وهي ذات أهميّة كبيرة في مجال فيزياء الكمّ. وعندحساب طول موجة دي بروي المصاحِبة لجسم كبير (جاهري)، نجد أنّها صغيرة جدًّا بل أصغر بكثير من أبعاد الجسم. وفي المقابل، فإنّ طول موجة دي بروي المُصاحِبة لجُسيم صغير مثل الإلكترون قريب من قيمة المسافة الفاصلة بين الذرات في الموادّ الصُّلبة، لذلك تمكّن العالمان دافسون Davisson وجيرمر Germer بعد ثلاث سنوات من وضع دي بروي لفرضيته من الكشف بالتجربة عن الطبيعة الموجيّة للإلكترونات عند إسقاط حزمة من الإلكترونات المسرّعة على بلورة من النيكل، حيث المسافة بين ذرات النيكل مُقارِبة لطول موجة دي بروي المصاحِبة للإلكترونات. وقد أظهرت نتائج التجربة وجود نمط حيود للإلكترونات كما في الشكل المقابل ( أ) الذي يشبه نمط حيود الضوء المبيَّن في الشكل (ب).
الجواب: للجسيمات المادية طبيعة موجية-جسيمية مزدوجة، وأن الطول الموجي لجسيمة يعطى بالعلاقة: |
|
أ
المثال: 16
أجد طول موجة دي بروي المصاحِبة لـ ِ:
أ . إلكترون سرعته 1.00x106 m/s
ب. رصاصة كتلتها mb = 50.0 g تتحرك بسرعة .vb = 400 m/s
المُعطيات:
h = 6.63 × 10-34 J.s , me = 9.11 × 10-31 kg, ve = 1.00 × 106 m/s
mb = 50.0 × 10-3 kg, vb = 400 m/s
المطلوب: ? = λe = ?, λb
الحل: أ.
أُلاحظ أنّ طول موجة دي بروي المصاحِبة للإلكترون تقارِب المسافة
الفاصلة بين الذرات في البلورات، لذلك يمكن ملاحظة نمط الحيود
للإلكترونات كما في تجربة دافسون وجيرمر.
ب.
من الواضح أنّ طول موجة دي بروي المصاحبة للرصاصة صغير جدًّا
حتى مع المقارنة بالمسافات الفاصلة بين الذرات في البلورات، لذلك
لا يمكن مشاهدة نمط حيود للأجسام الجاهريّة.
المثال: 17
تسارع إلكترون من السكون بفرق جهد مقداره ( 2.7 V ).
أجد طول موجة دي بروي المصاحِبة له عند نهاية مدّة تسارُعه.
المُعطيات: vi = 0, h = 6.63 × 10-34 J.s,
me = 9.11 × 10-31 kg, ΔV = 2.7 V
المطلوب: ?= λe
الحلّ:
أجد أولاً مقدار السرعة النهائيّة للإلكترون من العلاقة الآتية:
ثمّ أجد طول موجة دي بروي المصاحِبة له:
تمرين:
1. طول موجة دي بروي لحزمة من الإلكترونات يساوي ( 2.24x10-10m ).
أجد فرق الجهد المستَخدم في تسريع الإلكترونات.
الحل:
2 . ضربت مريم كرة تنس كتلتها ( 60g ) وقطرها ( 6.5cm)، فتحرّكت
بسرعة ( 25m/s ).
أ . أجد طول موجة دي بروي المصاحِبة لها.
الحل:
ب. أقارن بين طول موجة دي بروي وقطر كرة التنس.
الحل: إن طول موجة دي بروي ( 𝜆 ) المصاحبة للكرة أصغر بكثير
من قطر كرة التنس، وهذا يفسر صعوبة تصميم تجربة
للكشف عن الأطوال الموجية المصاحبة للأجسام الجاهرية.