محاليلُ الأملاح Salts Solutions
تُعَدُّ الأملاحُ منَ المواد الأساسيّة المكوِّنة لجسم الإنسان، ويحصل عليها عن طريق الغذاء والماء.
وللأملاح دورٌ مهمٌّ في تنظيم الكثير من العمليات الحيويّة التي تحدث في الجسم؛ فأملاح الكالسيوم تدخل في تركيب العظام والأسنان، وأملاح الصوديوم تساعد على حفظ التوازن المائي داخل الخلية وخارجها، وتعمل على تنظيم ضغط الدم، كما تساعد أملاح البوتاسيوم على ضبط وظائف العضلات وتوسيع الأوعية الدمويّة لتسهيل انتقال الدم، وَتُستعمَلُ الأملاحُ في صناعة الكثير من الأدوية، ومستحضرات التجميل، وغيرها، ويبيِّنُ الشكلُ (9) بعضَ الأملاح المُستخدَمة في الصناعات المختلفة.
دورٌ مهمٌّ في تنظيم الكثير من العمليات الحيويّة التي تحدث في الجسم؛ فأملاح الكالسيوم تدخل في تركيب العظام والأسنان، وأملاح الصوديوم تساعد على حفظ التوازن المائي داخل الخلية وخارجها، وتعمل على تنظيم ضغط الدم، كما تساعد أملاح البوتاسيوم على ضبط وظائف العضلات وتوسيع الأوعية الدمويّة لتسهيل انتقال الدم، وَتُستعمَلُ الأملاحُ في صناعة الكثير من الأدوية، ومستحضرات التجميل، وغيرها، ويبيِّنُ الشكلُ (9) بعضَ الأملاح المُستخدَمة في الصناعات المختلفة.
فما المقصودُ بالأملاح؟ وما أهمُّ خصائصها؟ وكيف نحدد السلوك الحمضي أو القاعدي للملح؟
الخصائصُ الحِمضيّة والقاعديّة للأملاح: Acidic and basic properties of salts
فَسَّرَ مفهومُ برونستد – لوري سلوكَ كثير منَ الحُموض والقواعد وفقًا لقدرتها على منح البروتون أو استقباله،
كما فَسَّرَ الخصائص الحِمضيّة والقاعديّة للأملاح تبعًا لقدرة أيوناتها على منح البروتون أو استقباله في التفاعل، 
فالأملاحُ Salts مركّبات أيونيّة تنتج من تعادل محلول حِمض معَ محلول قاعدة،
وعند إذابتها في الماء تتفكك منتجةً أيوناتٍ موجبةً وأخرى سالبة،
وقد تتفاعل هذه الأيوناتُ معَ الماء وتنتج أيونات أو -OH في ما يُعرف بعمليّة التَّمَيُّه Hydrolysis.
وتتفاوت الأملاح في قدرتها على التفكك، وفي درسنا هذا سوف ندرسُ الأملاح على فرض أنها تتفكك كُلِّيًّا.
تختلف طبيعة الملح وسلوكه تبعًا لمصدر أيوناته منَ الحِمض والقاعدة وقدرتها على التفاعل معَ الماء،
فبعضُ الأملاح لا تَتَمَيَّهُ في الماء؛ لِذا لا تنتج أيونات +H3O أو -OH ؛ فهي ذات طبيعة متعادلة، مثل كلوريد الصوديوم NaCl،
وبعضُها الآخَرُ يَتَمَيَّهُ الماء، فينتج أيونات+H3O، فيكون له خصائصُ حِمضيّة، مثل كلوريد الأمونيوم NH4Cl،
وبعضُها الآخَرُ يَتَمَيَّهُ الماء، فينتج أيونات -OH وله خصائصُ قاعديّة، مثل فلوريد البوتاسيوم KF ،
انظر الشكل (10). الذي يُبين اختلاف لَون كاشفُ برومو ثيمول الأزرق في المحاليل الأملاح الثلاثةِ تبعاً لاختلاف خَصائِصَها.
وسنتعرَّفُ في ما يأتي خصائصَ بعض هذه الأملاح.
الأملاحُ المتعادلة: Netural Salts
تنتج الأملاحُ المتعادلة عند تعادل حِمض قوي معَ قاعدة قويّة.
فمثلًا، ينتج ملحُ بروميد الصوديوم NaBr من تعادل محلول الحِمض القوي HBr معَ محلول القاعدة القويّة NaOH،
كما في المعادلة الآتية:
بالتدقيق في صيغة الملح NaBr نجد أنه يتكوَّنُ من أيون البروميد -Br، وهو قاعدة مرافقة ضعيفة
للحِمض القوي الهيدروبروميك HBr، لا يمكنه استقبالُ البروتون في المحلول، فلا يتفاعل معَ الماء،
ولا يؤثر في تركيز أيونات -OH أو +H3O،
أمّا الأيون+Na فمصدرُهُ القاعدةُ القويّة هيدروكسيد الصوديوم NaOH، وليس له القدرةُ على التفاعل معَ الماء،
فلا يؤثر في تركيز أيونات+H3O أو-OH في المحلول، ومن ثَمَّ فإنَّ تراكيز أيونات+H3O وأيونات-OH تبقى ثابتة في الماء،
وبذلك يكون الرَّقْمُ الهيدروجيني لمحاليل الأملاح الناتجة من تفاعل حِمض قوي وقاعدة قويّة،
مثل الملح بروميد الصوديوم NaBr، يساوي 7، وتكون محاليلُها متعادلة.
الأملاحُ الحِمضيّة: Acidic Salts
تنتج الأملاحُ الحِمضيُة من تفاعل حِمض قوي معَ قاعدة ضعيفة.
فمثلًا، ينتج ملحُ كلوريد الأمونيومNH4Cl من تفاعل حِمض الهيدروكلوريك HCl معَ الأمونيا NH3،
كما في المعادلة الآتية: HCl(aq) + NH3(aq) NH4Cl(aq)
وعند تفكك الملح الحِمضي يكون الأيونُ السالب قاعدةً مرافقة لحِمض قوي فلا يتفاعل مع الماء،
بينما يسلك الأيونُ الموجب كحِمض مرافق قوي للقاعدة الضعيفة ويتفاعل معَ الماء وينتج أيونَ الهيدرونيوم +H3O.
فمثلًا، يذوب ملحُ كلوريد الأمونيوم NH4Cl في الماء كما في المعادلة الآتية:
يلاحظ أنَّ أيونَ الكلوريد -Cl قاعدةٌ مرافقة ضعيفة لحِمض الهيدروكلوريك القوي HCl
وليس له القدرة على استقبال البروتون في المحلول؛ أي أنه لا يتفاعل معَ الماء،
في حين أنَّ أيونَ الأمونيوم +NH4 حِمضٌ مرافق قوي نسبيًّا للقاعدة الضعيفة الأمونيا NH3،
يمكنه منحُ البروتون للماء في المحلول منتجًا أيونات الهيدرونيوم+H3O، كما في المعادلة الآتية:
|
إجابة سؤال أفكر: ما الحِمضُ والقاعدة اللذان ينتجُ من تفاعلهما ملحُ كربونات الليثيوم الهيدروجينية LiHCO3؟ |
|
يتكون الملحُ LiHCO3 من الأيون +Li الذي مصدره LiOH، والأيون -HCO3 الذي مصدره H2CO3 ، وبهذا فان الملح ينتج من تفاعل الحمض H2CO3 مع القاعدة LiOH |
NH4+ (aq) + H2O(l) NH3 (aq) + H3O+(aq)
وبذلك يزداد تركيزُ +H3O في المحلول، ويقلُّ الرَّقْمُ الهيدروجيني، ويكون محلول الملح حِمضيًّا.
الأملاحُ القاعديّة: Basic Salts
تنتج الأملاحُ القاعدية من تفاعل قاعدة قويّة معَ حِمض ضعيف،
وعند تفكك الملح القاعدي يكون الأيونُ الموجب الناتج ضعيفاً ومصدره قاعدة قوية، فلا يتفاعل معَ الماء، بينما يسلك الأيونُ السالب كقاعدة مرافقة قويّة للحِمض الضعيف ويتفاعل معَ الماء وينتج أيونَ الهيدروكسيد -OH.
فمثلًا، يذوب ملح نتريت البوتاسيوم KNO2 في الماء ويتفكك، كما في المعادلة الآتية:
يكون مصدرَ أيونات البوتاسيوم+K القاعدةُ القويّةُ هيدروكسيد البوتاسيوم KOH لذا فهي لا تتفاعل معَ الماء
ولا تؤثر في تركيز أيونات+H3O أو -OH في المحلول،
أمّا أيوناتُ النتريت-NO2 فهي قاعدة مرافقة قويّة لحِمض النيتروجين (IV) الضعيف HNO2 ؛
لِذا تتفاعل معَ الماء، كما في المعادلة الآتية:
NO2- (aq) + H2O(l) HNO2 (aq) + OH-(aq)
يتضح منَ المعادلة أنَّ تركيزَ أيونات الهيدروكسيد -OH يزدادُ في المحلول، وبذلك يزداد الرَّقْمُ الهيدروجينيpH،
ويكون محلول الملح قاعديًّا.
نستنتج ممّا سبق أنَّ بعضَ الأملاح تذوب في الماء وتتفكَّكُ إلى أيونات سالبة وأخرى موجبة وتنتشرُ بين 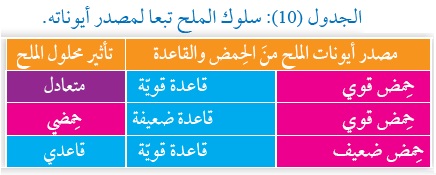
جُزيئات الماء
دون أن تتفاعل معها، مثل ملح كلوريد الصوديوم NaCl، وهذا ما يُعرف بعمليّة الذوبان Solubility،
أمّا في عمليّة التَّمَيُّهِ فإنَّ الأيوناتِ الناتجةَ من تفكك الملح تتفاعلُ معَ الماء وتغيِّرُ من تركيز أيونات-OH أو+H3O ،
ومن ثَمَّ تؤثر في الرَّقْم الهيدروجيني للمحلول الناتج،
وبهذا يكون لمحاليل الأملاح تأثير حِمضي أو قاعدي أو متعادل، ويعتمد ذلك على مصدر أيونات الملح منَ الحِمض والقاعدة. انظر الجدول (8).
أتحقق
1) أُوَضِّحُ الفرقَ بين الذوبان والتَّمَيُّه.
عند ذوبان الأملاح تذوب في الماء وتتفكَّكُ إلى أيونات سالبة وأخرى موجبة وتنتشرُ بين
جُزيئات الماء دون أن تتفاعل معها، بينما في عملية التميه فإنَّ الأيوناتِ الناتجةَ من تفكك الملح تتفاعلُ معَ الماء وتغيِّرُ من تركيز أيونات-OH أو+H3O ،
2) أُحَدِّدُ الخصائصَ الحِمضيّة والقاعديّة والمتعادلة لمحاليل الأملاح الآتية:
| N2H5NO3 | KNO3 | NaOCl | CH3NH2Cl | محلول الملح |
| حمضي | متعادل | قاعدي | حمضي | الخاصية |
3) أُفَسِّرُ التأثيرَ القاعدي لمحلول الملح NaOCl
يتفكك الملح NaOCl في الماء كما في المعادلة الآتية:
NaOCl Na+ + ClO-
الأيون +Na مصدره القاعدة القوية NaOH فهو ضعيف ولا يتفاعل مع الماء ( لا يتميه)
بينما الأيون -ClO فهو قاعدة مرافقة قوية نسبيا مصدره الحمض الضعيف HClO ، فيتفاعل مع الماء على النحو الآتي:
ClO- + H2O HClO + OH-
وبهذا يزداد تركيز -OH ويزداد الرقم الهيدروجيني ويكون تأثير محلول الملح قاعدياً.
تأثيرُ الأيون المشترك: Common Ion Effect
ما المقصود بالأيون المشترك ؟ وما الأثر الذي يحدثه في المحاليل التي يضاف اليها؟
توجد محاليلُ الحُموض الضعيفة ومحاليلُ القواعد الضعيفة في حالة اتزان ديناميكي،
ويمكن التأثير في موضع الاتزان -وفقًا لمبدأ لوتشاتيلييه- بعدّة طرائق،منها إضافة مادة إلى التفاعل تؤثر في موضع الاتزان.
فمثلًا، يتأيَّنُ حِمضُ الإيثانويك CH3COOH في الماء وفقًا للمعادلة الآتية:
CH3COOH(aq) + H2O(l) CH3COO-(aq) + H3O+(aq)
وتكون الأيوناتُ الناتجة(+CH3COO- , H3O) في حالة اتزان معَ جُزيئات الحِمض غير المتأيِّنة CH3COOH،
وعند إضافة ملح إيثانوات الصوديوم إلى المحلول يتفكك كُلِّيًّا، وفقَ المعادلة الآتية:
يَتَّضِحُ منَ المعادلتين السابقتين أنَّ الأيون -CH3COO يَنْتُجُ من كلٍّ منَ الحِمض CH3COOH والملح CH3COONa؛
فهو يدخل في تركيب كلٍّ منهما، ويسمّى الأيونَ المشترك Common Ion،
وعند إضافة الأيون -CH3COO إلى محلول الحِمض الضعيف CH3COOHيعمل على:
إزاحة موضع الاتزان نحو اليسار ، ويؤدي إلى تغيير تراكيز المواد في المحلول،
وهو ما يسمّى تأثيرَ الأيون المشترك Common Ion Effect.
الربط مع علوم الأرض والبيئة: معالجة المياه
المناطق التي توجد فيها الصخورالجيرية، تحتوي المياه فيها على نسبة عالية من كربونات الكالسيوم، ولتقليل هذه النسبة؛ يضاف ملح كربونات الصوديوم
الذي يتفكك كلياً ويزيد من تركيز أيونات الكربونات في الماء، فيندفع التفاعل في محلول كربونات الكالسيوم، بالاتجاه العكسي ويزداد بذلك تركيز كربونات الكالسيوم ويسبب ترسبها.
فما أثرُ إضافة أيون مشترك على تراكيز كلٍّ من أيونات+H3O وأيونات-OH في المحلول؟
الأثرُ القاعدي للأيون المشترك: The basic effect of Common ion
يوجد حِمضُ الهيدروفلوريك في حالة اتزان؛ حيث تكون الأيوناتُ الناتجة من تأيُّن الحِمض في حالة اتزان معَ جُزيئات الحِمض غيرِ المتأيِّن، كما في المعادلة الآتية:
HF(aq) + H2O(l) F-(aq) + H3O+(aq)
وعند إضافة ملح فلوريد الصوديوم NaF إلى محلول الحِمض يتفككُ، وفقَ المعادلة الآتية:
يَتَّضِحُ منَ المعادلتين السابقتين أنَّ هناك مصدرين للأيون-F ؛ أحدهما الحِمضHF، والآخر الملح NaF؛
وبذلك يكون-F الأيونَ المشترك في المحلول،
وإنَّ إضافة الملح NaF إلى محلول الحِمض الضعيف HF تؤدي إلى زيادة تركيز الأيون المشترك-F في المحلول،
ووفقًا لمبدأ لوتشاتلييه فإنَّ:
موضع الاتزان يُزاح إلى جهة اليسار (جهة المواد المتفاعلة)؛ مما يقلل من تأين الحِمض الضعيف HF ، كما أنه يقلِّلُ من تركيز أيونات +H3O ويزيد منَ الرَّقْم الهيدروجيني pH للمحلول؛
ويمكن حسابُ تركيز ايونات +H3O والرَّقْم الهيدروجيني pH للمحلول عند إضافة الملح، كما في الأمثلة الآتية:
المثال (24):
أحسبُ التغيُّرَ في الرَّقْم الهيدروجيني لمحلول الحِمض الضعيف CH3COOH، الذي تركيزُه0.1 M وَرَقْمُهُ الهيدروجينيpH =2.9 إذا أُضيف إلى لتر منه 0.2 mol من ملح إيثانوات الصوديوم CH3COONa. علمًا أنَّ
تحليل السؤال:
حجم المحلول= 1L
عدد مولات الملح CH3COONa = 0.01 mol
الرَّقْمُ الهيدروجيني قبلَ إضافة الملح: pH1= 2.9
الرَّقْمُ الهيدروجيني بعد إضافة الملح:
المطلوب: حساب التغيُّر في الرَّقْم الهيدروجيني pH∆
الحل:
أكتبُ معادلة تأيُّن الحِمض:
CH3COOH(aq) + H2O(l) CH3COO-(aq) + H3O+(aq)
عند إضافة الملح CH3COONa يتفكك، كما في المعادلة الآتية:
يَتَّضِحُ منَ المعادلتين السابقتين أنَّ الأيونَ المشترك-CH3COO ينتج من تأيُّن الحِمض CH3COOH وتفكك الملح CH3COONa.
ونظرًا إلى أنَّ ثابت تأيُّن الحِمض صغيرٌ جدًّا، فإنَّ تركيزَ أيونات-CH3COO الناتج من تأيُّن الحِمض يكون صغيرًا جدًّا ويمكن إهمالُه ويعدُ الملح المصدرَ الرئيس لهذه الأيونات، ومن ثَمَّ فإنَّ
تركيزَ الأيون المشتركCH3COO- يكون مساويًا لتركيز الملح CH3COONa في المحلول؛ أي أنَّ:
[CH3COO-] = [CH3COONa] = 0.2 M
أستخدمُ ثابتَ تأيُّن الحِمض Ka لحساب تركيز +H3O، كما يأتي:
أحسبُ الرَّقْمَ الهيدروجيني للمحلول بعد إضافة الملح pH2، كما يأتي:
pH2 = - log [H3O+]
أحسبُ التغيُّرَ في الرَّقْم الهيدروجيني باستخدام العلاقة الآتية:
∆pH= pH2 – pH1
∆pH = 5.07 – 2.9 = 2.17
وهذا يشيرُ إلى حدوث زيادة في الرَّقْم الهيدروجيني بمقدار 2.17 بسبب إضافة الأيون المشترك إلى محلول الحِمض.
المثال (25):
أحسبُ الرَّقْمَ الهيدروجيني لمحلول مكوَّن منَ الحِمض HNO2 تركيزُه 0.085 M والملح KNO2 تركيزُه 0.1 M علمًا أنَّ: , log 3.825 = 0.58
تحليل السؤال
المطلوب: حساب الرَّقْم الهيدروجيني لمحلول الحِمض والملح.
الحل:
أكتبُ معادلة كلٍّ منَ الحِمض والملح:
HNO2(aq) + H2O(l) NO2-(aq) + H3O+(aq)
لحساب الرَّقْم الهيدروجيني pH للمحلول، أحسبُ [+H3O] باستخدام Ka، كما يأتي:
أحسبُ الرَّقْم الهيدروجيني للمحلول، كما يأتي:
pH = - log [H3O+]
pH = - log
أتحقق:
أحسبُ التغيُّرَ في الرَّقْم الهيدروجيني لمحلول الحِمض H2SO3، الذي تركيزُه 0.2 M وَحَجْمُهُ 400 mL، إذا أُضيفَ إليه0.2 mol من الملح NaHSO3.
( Ka= 1.3x10-2 , log5.1=0.71 , log 5.2= 0.72 )
تحليل السؤال:
[H2SO3] = 0.2 M
حجم المحلول= 0.4 L
عدد مولات الملح NaHSO3 = 0.2 mol
الرقم الهيدروجيني قبل إضافة الملح: pH1= ??
الرقم الهيدروجيني بعد إضافة الملح: pH2= ??
الحل:
أكتب معادلة تأين الحمض:
H2SO3 (aq) + H2O(l) HSO3-(aq) + H3O+(aq)
أحسب الرقم الهيدروجيني(pH1) للحمض قبل إضافة الملح بتطبيق قانون ثابت التأين:
وحيث أن النقص في تركيز الحمض صغير جدا ًمقارنة بتركيز الحمض، يتم إهمال هذا النقص واعتبار تركيز الحمض ثابتاً ويساوي 0.2 M
ويكون
وبالتعويض في ثابت التأين نجد تركيز +H3O كما يلي:
أحسب الرقم الهيدروجيني قبل اضافة الملح كما يلي:
عند إضافة الملح NaHSO3 فإنه يتأين كما في المعادلة الآتية:
يتضح من المعادلتين السابقتين أن الأيون المشترك HSO3- ينتج من تأين الحمض H2SO3والملح NaHSO3، ونظراً لأن ثابت تأين الحمض صغير جداً، فان تركيز أيونات HSO3- الناتج من تأين الحمض يكون صغير جداً ويتم إهماله، واعتبار الملح المصدر الرئيس لهذه الأيونات، وبالتالي فإن تركيز الأيون المشترك HSO3- يكون مساوياً لتركيز الملح NaHSO3 في المحلول، أي أن:
[HSO3-] = [NaHSO3] = 0.5 M
أستخدم ثابت تأين الحمض Ka لحساب تركيز H3O+ كما يلي:
أحسب الرقم الهيدروجيني للمحلول بعد إضافة الملح pH2 كما يلي:
أحسب التغير في الرقم الهيدروجيني ∆pH باستخدام العلاقة الآتية:
∆pH= pH2 – pH1
∆pH = 2.28 – 1.29 = 0.99
الأثرُ الحِمضي للأيون المشترك: The Acidic effect of Common ion
تتأيَّنُ القواعدُ الضعيفة جُزئيًّا في الماء فتنتج أيونات الهيدروكسيد -OH وأيونات أخرى موجبة،
وتكون تراكيزُ الأيونات الناتجة في حالة اتزان معَ جُزيئات القاعدة غير المتأيِّنة في المحلول.
فمثلًا، تتأيَّنُ الأمونيا NH3، كما في المعادلة الآتية:
NH3(aq) + H2O(l) NH4+(aq) + OH-(aq)
وعند إضافة ملح، مثل كلوريد الأمونيوم NH4Cl، إلى محلول القاعدة يتأيَّنُ كُلِّيًّا، كما في المعادلة الآتية:
يَتَّضِحُ منَ المعادلتين السابقتين أنَّ هناك مصدرين للأيون+NH4 ؛ أحدهما القاعدة NH3، والآخر الملح NH4Cl؛
وبذلك يكون +NH4 الأيونَُ المشترك في المحلول،
وعند إضافة الملح NH4Cl إلى محلول القاعدة الضعيفة NH3 يزداد تركيز الأيون المشترك،
ووفقًا لمبدأ لوتشاتيليه فإنَّ موضع الاتزان يُزاح إلى جهة اليسار (جهة المواد المتفاعلة)؛
ما يقلل من تأين القاعدة الضعيفة NH3 ، وَيُقَلِّلُ في الوقت نفسه من تركيز أيونات-OH،
ومن ثَمَّ يزداد تركيزُ أيونات +H3O ويقل الرَّقْمُ الهيدروجيني pH للمحلول، ويكون تأثيرُ الأيون المشترك حِمضيًّا.
والأمثلةُ الآتية توضِّحُ كيفيّة حساب تركيز أيونات -OH و+H3O والرَّقْم الهيدروجيني pH لمحلول القاعدة الضعيفة عندما يُضافُ إليه أيونٌ مشترك.
المثال (26):
أحسبُ التغيُّرَ في الرَّقْم الهيدروجيني لمحلول الأمونيا NH3، الذي حجمُهُ 1 L وتركيزُهُ 0.1 M ورقمُهُ الهيدروجيني pH يساوي 11 ، إذا أُضيف إليه 0.2 mol من ملح كلوريد الأمونيوم NH4Cl. علمًا أنَّ ، log 1.1 = 0.04
تحليل السؤال:
المطلوب: حساب التغيُّر في الرَّقْم الهيدروجيني لمحلول القاعدة.
الحل:
أكتبُ معادلة تأيُّن كلٍّ منَ القاعدة والملح، كما يأتي:
NH3(aq) + H2O(l) NH4+(aq) + OH-(aq)
mm
أحسب تركيز الملح كما يأتي:
أستخدمُ ثابتَ تأيُّن القاعدة لحساب [-OH]، كما يأتي:
أحسبُ [+H3O] باستخدام ثابت تأيُّن الماء Kw، كما يأتي:
Kw = [H3O+] [OH-]
أحسبُ الرَّقْمَ الهيدروجيني pH للمحلول، كما يأتي:
ألاحظ تغير قيمة pH من 11 إلى 8.96 أي أنها نقصت بمقدار 2.04
المثال (27):
أحسبُ عددَ مولات الملح CH3NH3Br اللازم إضافتها إلى 400 mL من محلول القاعدة CH3NH2 تركيزُها 0.1 M ليصبح رَقْمُها الهيدروجيني 10.5.
علمًا أنَّ: (أهمل تغير الحجم)Kb= 4.4 X 10-4 ، log 3.2 = 0.5
تحليل السؤال:
pH = 10.5
log 3.2 = 0.5
المطلوب: حساب عدد مولات الملح CH3NH2Br.
الحل:
أكتبُ معادلة تأيُّن كلٍّ منَ القاعدة والملح، كما يأتي:
CH3NH2(aq) + H2O(l) CH3NH3+(aq) + OH-(aq)
CH3NH3Br (s) CH3NH3+(aq) + Br-(aq)
أستخدمُ pH لحساب تركيز +H3O:
[H3O+]= 10-pH= 10-10.5= 100.5 x 10-11 = 3.2x 10-11 M
أحسبُ تركيزَ -OH باستخدام ثابت تأيُّن الماء Kw:
أُطَبِّقُ ثابتَ تأيُّن القاعدة لحساب تركيز الملح المشترك:
أحسبُ عددَ مولات الملح CH3NH3Br، كما يأتي:
n = M . V = 0.142 M X 0.4 L= 0.57 mol
أتحقق:
أحسبُ الرَّقْمَ الهيدروجيني pH لمحلول القاعدة C5H5N الذي تركيزُه عند إضافة منَ الملح C5H5NHCl
إلى منَ المحلول. علمًا أنَّ Kb= 1.4 X 10-9 ، log 1.17 = 0.7
تحليل السؤال:
[C5H5N]= 0.2 M
Kb= 1.4 X 10-9
الحل:
أكتب معادلة تأين القاعدة و معادلة تفكك الملح كما يلي:
C5H5N (aq) + H2O(l) C5H5NH +(aq) + OH-(aq)
أطبق ثابت تأين القاعدة Kb لحساب تركيز OH-:
أحسب تركيز H3O+ باستخدام ثابت تأين الماء Kw :
أحسب الرقم الهيدروجيني كما يلي:
pH = -log [H3O+] = -log (
المحاليلُ المنظِّمة: Buffered Solutions
ما المقصود بالمحلول المنظم؟
تؤدي إضافة كميّة قليلة من حِمض قوي أو قاعدة قويّة إلى الماء إلى تغيير كبير في الرَّقْم الهيدروجيني للمحلول،
إلا أنَّ هناك بعضَ المحاليل لا يتأثر رَقْمُها الهيدروجينيُّ بشكل ملحوظ نتيجة هذه الإضافة تسمّى
المحاليلَ المنظِّمة وهي محاليلُ يمكنها مقاومة التغيُّر في الرَّقْم الهيدروجيني pH عند إضافة
كميّة قليلة من حِمض قوي أو قاعدة قويّة إليها.
فهي تتكوَّنُ من حِمض ضعيف وقاعدته المرافقة (حِمض ضعيف وملحه)
أو قاعدة ضعيفة وحِمضها المرافق (قاعدة ضعيفة وملحها)،
وَتُعَدُّ المحاليل المنظِّمة من أهمِّ تطبيقات الأيون المشترك، وهي تستخدم في مجالات صناعيّة واسعة،
مثل صناعة الأصباغ ومستحضرات التجميل والصناعات الدوائيّة وغيرها، كما تحتوي الأنظمة الحيويّة في أجسام الكائنات الحيّة على العديد منَ المحاليل المنظِّمة، من أهمِّها المحلولُ المنظِّم في الدم،الذي يتكوَّنُ من حِمض الكربونيك H2CO3 وقاعدته المرافقة -HCO3، ويعمل على الحفاظ على الرَّقْم الهيدروجيني للدم عند نحو 7.4 ،
فالدم يحملُ الموادَّ المختلفة ذات الطبيعة الحِمضيّة أو القاعديّة التي تدخل إلى الجسم دون أن يتغيِّرَ رَقْمَهُ الهيدروجيني.
وعليه، فسنتعرَّفُ في ما يأتي نوعين منَ المحاليل المنظِّمة وكيفيّة عملها.
المحاليلُ المنظِّمة الحِمضيّة: Acidic Buffered Solutions
يتكوَّنُ المحلولُ المنظِّم الحِمضي من حِمض ضعيف وقاعدته المرافقة.
فمثلًا، يحتوي محلولُ حِمض الميثانويك HCOOH، وملحه HCOONa، على نسبة عالية من جُزيئات الحِمض غير المتأيِّنة، وعلى نسبة عالية منَ القاعدة المرافقة -HCOO الناتجة من تأيُّن الملح، إضافة إلى نسبة منخفضة من أيونات +H3O .
وتوضِّحُ المعادلتان الآتيتان تأيُّنَ الحِمض و تفكك الملح:
HCOOH (aq) + H2O(l) HCOO- (aq) + H3O+(aq)
وعند إضافة كميّة قليلة من قاعدة قويّة، مثل NaOH، تتأيَّنُ، وتنتج أيونات-OH، التي يُستهلَكُ معظمُها عن طريق تفاعلها معَ الحِمض HCOOH، وتتكوَّنُ نتيجة لذلك القاعدةُ المرافقة -HCOO ؛ وبهذا فإنَّ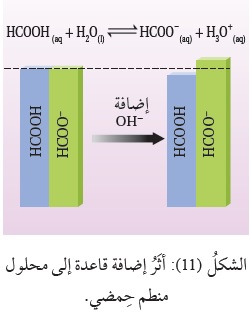
تركيزَ الحِمض سوف يقلُّ بمقدار تركيز أيونات -OH المضافة ( القاعدة المضافة)،
وفي الوقت نفسه يزدادُ تركيزُ الأيون المشترك -HCOO بالمقدار نفسه؛
وبذلك تتغيَّرُ النسبةُ بين تركيز الحِمض وقاعدته المرافقة بدرجة قليلة، أنظرُ الشكل (11)،
ويبقى تركيزُ +H3O في المحلول ثابتًا تقريبًا، ولا يحدث تغيُّرٌ ملحوظ في الرَّقْم الهيدروجيني pH للمحلول.
المثال (28):
أحسبُ الرَّقْمَ الهيدروجيني لمحلول يتكوَّنُ من حِمض الإيثانويك CH3COOH تركيزُهُ 0.5 M والملح إيثانوات الصوديوم CH3COONa تركيزُهُ 0.5 M، ثمَّ أُقارنُها بالرَّقْم الهيدروجيني للمحلول بعد إضافة 0.01 mol منَ القاعدة القويّة NaOH إلى 1 L منَ المحلول.(أهمل التغير في الحجم)
علماً أن 0.21 = log 1.7 = 0.23 , log 1.63
تحليل السؤال
[CH3COOH] = 0.5 M
[CH3COONa] = 0.5 M
[NaOH] = 0.01 M
حجم المحلول= 1L
المطلوب: مقارنة الرَّقْم الهيدروجيني للمحلول قبلَ إضافة NaOH وبعدها.
الحل:
CH3COOH(aq) + H2O(l) CH3COO-(aq) + H3O+(aq)
أحسبُ أوَّلا pH للمحلول قبلَ إضافة القاعدة NaOH، كما في الأيون المشترك:
عند إضافة القاعدة NaOH تتأيَّنُ كُلِّيًّا ويكونُ [-OH]= [NaOH] = 0.01 M
وتتفاعل معَ الحِمض CH3COOH ويقلُّ تركيزُهُ بمقدار تركيز -OH ليصبح:
[CH3COOH] = 0.5 - 0.01 = 0.49 M
ونتيجة لذلك تتكوَّنُ القاعدةُ المرافقة -CH3COO ويزدادُ تركيزُها بمقدار تركيز -OH ليصبح:
[CH3COO-] = 0.5 + 0.01 = 0.51 M
أستخدمُ ثابتَ تأيُّن الحِمض Ka لحساب تركيز +H3O والرَّقْم الهيدروجيني pH من جديد، كما يأتي:
يَتَّضِحُ منَ المثال أنَّ هناك زيادة قليلة جدًّا في الرَّقْم الهيدروجيني بمقدار 0.02 .
وعند إضافة كميّة قليلة من حِمض قوي، مثل HCl، إلى المحلول يتأيَّنُ، وتنتج أيونات +H3O، التي يُستهلَكُ معظمُها عن طريق تفاعلها معَ القاعدة المرافقة -CH3COOH لتكوين الحِمض CH3COO؛ وبذلك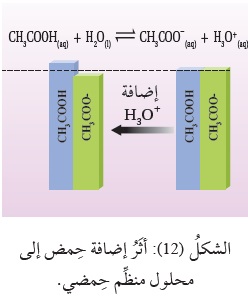
يقلُّ تركيزُ القاعدة المرافقة-CH3COO بمقدار أيونات +H3O المُضافة ( الحمض المضاف)،
ويزدادُ تركيزُ الحِمض CH3COOH بالمقدار نفسه،
وتتغيَّرُ النسبة بين تركيز الحِمض وقاعدته المرافقة بدرجة قليلة، أنظرُ الشكل (12)،
ويتغير تركيزُ +H3Oبنسبة صغيرة جِدًّا؛ وبهذا يحدث تغيُّرٌ صغير جِدًّا في الرَّقْم الهيدروجيني pHللمحلول.
ويمكن توضيحُ ذلك من خلال المثال الآتي:
المثال (29):
أحسبُ الرَّقْمَ الهيدروجيني للمحلول في المثال السابق عند إضافة 0.01 mol منَ الحِمض HCl إلى 1 L منَ المحلول، ثمَّ أُقارنُها بالرَّقْم الهيدروجيني للمحلول قبلَ الإضافة.(أهمل التغير في الحجم) علماً أن Ka= 1.7 x10-5 , 0.25 = log 1.77
تحليل السؤال:
حجم المحلول=
المطلوب: مقارنة الرَّقْم الهيدروجيني للمحلول قبلَ إضافة HCl وبعدها.
الحل:
CH3COOH(aq) + H2O(l) CH3COO-(aq) + H3O+(aq)
أحسبُ الرَّقْم الهيدروجيني pH بعد إضافة الحِمض HCl، ثمَّ أُقارنُها بالرَّقْم الهيدروجيني قبلَ الإضافة.
عند إضافة الحِمض HCl يتأيَّنُ كُلِّيًّا ويكون
يتفاعلُ الحِمضُ HCl معَ القاعدة المرافقة -CH3COO ويقلُّ تركيزُها بمقدار تركيز +H3O ليصبح:
[CH3COO-] = 0.5 - 0.01 = 0.49 M
ونتيجة لذلك يتكوَّنُ الحِمضُ CH3COOH ويزدادُ تركيزُهُ بمقدار تركيز +H3O ليصبح:
[CH3COOH] = 0.5 + 0.01 = 0.51 M
أستخدمُ ثابتَ تأيُّن الحِمض Ka لحساب تركيز +H3O والرَّقْم الهيدروجيني pH من جديد، كما يأتي:
أُلاحظُ أنَّ pH للمحلول قبل إضافة الحِمض HCl تساوي 4.77، أمّا بعد إضافة الحِمض HCl فأصبحت pH تساوي 4.75
ما يشيرُ إلى حدوث انخفاض قليل جدًّا في الرَّقْم الهيدروجيني بمقدار 0.02 .
أتحقق:
أ) أحسبُ الرَّقْمَ الهيدروجيني لمحلول منظِّم يتكوَّنُ من كلٍّ من حِمض البنزويك C6H5COOH وملح بنزوات الصوديوم C6H5COONa.(أهمل التغير في الحجم) علمًا أنَّ , log6.96= 0.84 , log6.3= 0.8
ب) أحسبُ الرَّقْمَ الهيدروجيني للمحلول السابق عند إضافة منَ الحِمض HBr إلى منَ المحلول.أهمل التغير في الحجم.
تحليل السؤال:
[C6H5COOH] = 0.2 M
[C6H5COONa] = 0.2 M
[HBr] = 0.01 M
حجم المحلول= 1 L
المطلوب: مقارنة الرقم الهيدروجيني للمحلول قبل إضافة HBr وبعده.
الحل:
C6H5COOH(aq) + H2O(l) C6H5COO-(aq) + H3O+(aq)
أحسب أولاً 1pH للمحلول قبل إضافة الحمض HBr كما في الأيون المشترك:
(2 عند إضافة الحمض HBr فانه تتأين كلياً ويكون [H3O+]= [HBr] = 0.01 M
ويتفاعل مع القاعدة المرافقة CH3COO- ويمنحها البروتون لتتحول الى الحمض CH3COOH
وبهذا يقل تركيزها بمقدار تركيز H3O+ المضاف ويصبح:
[CH3COO-] = 0.2 - 0.01 = 0.19 M
وبهذا يزداد تركيز الحمض CH3COOH بمقدار تركيز H3O+ المضاف ويصبح:
[CH3COOH] = 0.2 + 0.01= 0.21 M
أستخدم ثابت تأين الحمض Ka لحساب تركيز H3O+ والرقم الهيدروجينيpH من جديد، كما يلي:
المحاليلُ المنظِّمة القاعديّة: Basic Buffered Solutions
يتكوَّنُ المحلولُ المنظِّمُ القاعديُّ من قاعدة ضعيفة وحِمضها المرافق.
فمثلًا، محلولُ القاعدة NH3، وملحُها NH4Cl، يحتوي على نسبة عالية من جُزيئات القاعدة غير المتأيِّنة، وعلى نسبة عالية من أيونات الحِمض المرافق +NH4 الناتج من تأيُّن الملح،إضافة إلى نسبة منخفضة من أيونات-OH.
وتوضِّحُ المعادلتان الآتيتان تأيُّنَ القاعدة و تفكك الملح:
NH3(aq) + H2O(l) NH4+(aq) + OH-(aq)
وعند إضافة كميّة قليلة من قاعدة قويّة، مثل NaOH، تتأيَّن، وتنتج أيونات-OH، التي يُستهلَكُ معظمُهاعن طريق تفاعلها معَ الحِمض المرافق+NH4 لتكوين القاعدة NH3؛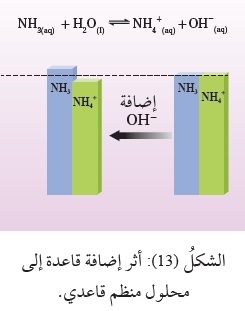
وبذلك يزدادُ تركيزُ القاعدة NH3 بمقدار أيونات -OH المُضافة (القاعدة المضافة)،
ويقلُّ تركيزُ الحِمض +NH4 بالمقدار نفسه،
وتتغيَّرُ نسبة تركيز القاعدة وحِمضها المرافق بدرجة قليلة، أنظرُ الشكل (13)،
ويبقى تركيزُ -OH في المحلول ثابتًا تقريبًا؛ وبهذا لا يحدث تغيُّرٌ كبيرٌ في الرَّقْم الهيدروجيني pH للمحلول.
المثال (30):
أحسبُ الرَّقْمَ الهيدروجيني لمحلول منظم يتكوَّنُ منَ الأمونيا NH3، التي تركيزُها 0.5 M، والملح NH4Cl، الذي تركيزُهُ 0.5 M، ثمَّ أُقارنُها بالرَّقْم الهيدروجيني للمحلول بعد إضافة 0.01 mol منَ القاعدة القويّة NaOH إلى 1 L منَ المحلول(أهمل التغير في الحجم)
علماً أن: 0.72 = log 5.5 = 0.74 , log 5.3 ،
تحليل السؤال:
حجم المحلول=
المطلوب: مقارنة الرَّقْم الهيدروجيني للمحلول قبل إضافة NaOH وبعدها.
الحل:
أكتبُ معادلة تأيُّن كلٍّ منَ القاعدة والملح، كما يأتي:
NH3(aq) + H2O(l) NH4+(aq) + OH-(aq)
أحسبُ [-OH] و pH للمحلول قبل إضافة القاعدة NaOH، كما يأتي:
أحسبُ [+H3O] باستخدام ثابت تأيُّن الماء Kw، كما يأتي:
Kw = [H3O+] [OH-]
أحسبُ الرَّقْم الهيدروجيني pH للمحلول، كما يأتي:
أحسبُ [-OH] و pH للمحلول قبل إضافة القاعدة NaOH، كما يأتي:
عند إضافة القاعدة NaOH تتأيَّنُ كُلِّيًّا ويكونُ
وتتفاعلُ معَ الحِمض المرافق+NH4 فيقلُّ تركيزُهُ بمقدار تركيز أيونات-OH ليصبح:
[NH4+] = 0.5 - 0.01 = 0.49 M
ونتيجة لذلك تتكوَّنُ القاعدة NH3 ويزداد تركيزُها بمقدار تركيز أيونات -OH ليصبح:
[NH3] = 0.5 + 0.01 = 0.51 M
أحسبُ [-OH] و pH للمحلول بعد إضافة القاعدة NaOH، كما يأتي:
أحسبُ [+H3O] باستخدام ثابت تأيُّن الماء Kw، كما يأتي:
أحسبُ الرَّقْم الهيدروجيني pH للمحلول، كما يأتي:
أُلاحظُ حدوثَ ارتفاع قليل جدًّا بمقدار (0.02) في قيمة pH للمحلول.
أمّا عند إضافة كميّة قليلة من حِمض قوي، مثل HCl، فإنه يتأيَّنُ، وتنتج أيونات+H3O، وَيُستهلَكُ معظمُها عن طريق تفاعلها معَ القاعدةNH3 لتكوين الحِمض+NH4؛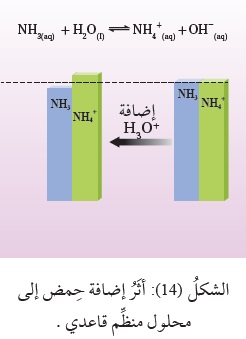
وبذلك يقلُّ تركيزُ القاعدة NH3 بمقدار تركيز أيونات +H3O المضافة (الحمض المضاف)
ويزدادُ تركيزُ الحِمض المرافق +NH4 بالمقدار نفسه،
وتتغيَّرُ نسبة تركيز القاعدة وحِمضها المرافق بدرجة قليلة، أنظرُ الشكل ( 14 )،
ويتغير تركيزُ كلٍّ من -OH و +H3O في المحلول بنسبة صغيرة جِدًّا؛ وبهذا يحدث تغيُّرٌ صغير
جِدًّا في الرَّقْم الهيدروجيني pH للمحلول.
المثال (31):
أحسبُ الرَّقْمَ الهيدروجيني للمحلول في المثال السابق عند إضافة 0.01 mol منَ الحِمض HCl إلى 1L منَ المحلول، ثمَّ أُقارنُها بالرَّقْم الهيدروجيني للمحلول قبلَ الإضافة. علماً أن 0.76 = log 5.8 . (أهمل التغير في الحجم).
تحليل السؤال:
المطلوب: حساب pH للمحلول NH3\NH4Cl عند إضافة حِمض HCl.
الحل:
عند إضافة الحِمض HCl يتأيَّنُ كُلِّيًّا ويكونُ
يتفاعلُ الحِمضُ HCl معَ القاعدة NH3 ويقلُّ تركيزُها بمقدار تركيز +H3O ليصبح:
[NH3] = 0.5 - 0.01 = 0.49 M
ونتيجة لذلك يتكوَّنُ الحِمضُ المرافق +NH4 ويزدادُ تركيزُهُ بمقدار تركيز +H3O ليصبح:
[NH4+] = 0.5 + 0.01= 0.51 M
أحسبُ [-OH] و pH للمحلول بعد إضافة القاعدة NaOH، كما يأتي:
أحسبُ [+H3O] باستخدام ثابت تأيُّن الماء Kw، كما يأتي:
أحسبُ الرَّقْم الهيدروجيني pH للمحلول، كما يأتي:
أُلاحظُ حدوثَ انخفاض قليل جدًّا بمقدار (0.02) في قيمة pH للمحلول، وهو لا يؤثر في خصائصه الكيميائيّة.
يَتَّضِحُ منَ الأمثلة السابقة أنَ:
المحلول المنظِّم يقاوم التغيُّرَ في الرَّقْم الهيدروجيني عندما تُضاف إليه كميّة قليلة من حِمض قوي أو قاعدة قويّة.
أتحقق:
1) أحسبُ الرَّقْم الهيدروجين لمحلول منظِّم يتكوَّنُ من القاعدة ميثيل أمين CH3NH2 تركيزها و الملح ميثيل كلوريد الأمونيوم CH3NH3Cl تركيزه علماً أن:(Kb = 4.4 × 10-4 , log 3.03 = 0.48)
2) أحسبُ الرَّقْم الهيدروجيني إذا أُضيف منَ الحِمض الهيدروبروميك HBr إلى منَ المحلول السابق. أهمل التغير في الحجم علماً أن: ( 0.58 = log 3.8)
1) تحليل السؤال:
[CH3NH2] = 0.15 M
[CH3NH3Cl] = 0.2 M
n(HBr) = 0.01 mol
حجم المحلول= 0.5 L
[HBr] = 0.02 M
الحل:
أكتب معادلة تأين القاعدة و ومعادلة تفكك الملح كما يلي:
CH3NH2 (aq) + H2O(l) CH3NH3+(aq) + OH-(aq)
أ) أحسب [OH-] و pH للمحلول المنظم كما يلي:
أحسب [H3O+] باستخدام ثابت تأين الماء Kw كما يلي:
أحسب الرقم الهيدروجيني pH للمحلول كما يلي:
pH = -log [H3O+] =
(2 عند إضافة الحمض HBr فإنه يتأين كلياً ويكون
[HBr]= [H3O+] = 0.02 M
يتفاعل الحمض HBr مع القاعدة CH3NH2 ويقل تركيزها بمقدار تركيز H3O+ليصبح:
[CH3NH2] = 0.15 - 0.02 = 0.13 M
ونتيجة لذلك يتكون الحمض المرافق CH3NH3+ ويزداد تركيزه بمقدار تركيز H3O+ ليصبح:
[CH3NH3+] = 0.2 + 0.02= 0.22 M
أحسب [OH-] و pH للمحلول بعد إضافة الحمض كما يلي:
أحسب [H3O+] باستخدام ثابت تأين الماء Kw كما يلي:
أحسب الرقم الهيدروجيني pH للمحلول كما يلي:
pH = -log [H3O+] =
الإثراءُ والتوسُّع
المحلولُ المنظِّم في الدم
يحتوي الدمُ على عدد منَ المحاليل المنظِّمة، تحافظ على قِيَمِ الرَّقْم الهيدروجيني بين (7.35 - 7.45)، وهذا نطاقٌ ضيِّق تحدثُ فيه جميع التغيُّرات الكيميائيّة الحيويّة في الجسم، وفي حال زيادة الرَّقْم الهيدروجيني أعلى من7.8 أو انخفاضه إلى أقلَّ من 6.8 يختلُّ النظامُ الحيوي في الجسم، وقد يؤدي ذلك إلى الوفاة.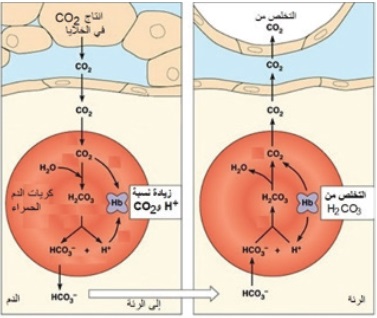
لذلك يقوم الجسم بضبط قيمة pH عن طريق عمليات حيوية مختلفة.
يُعَدُّ محلولُ حِمض الكربونيك وقاعدته المرافقة (-H2CO3\HCO3) أحدَ أهمِّ المحاليل المنظِّمة في الدم،
والمعادلة الآتية تمثلُ المحلولَ المنظِّم في الدم:
H2CO3(aq) + H2O(l) HCO3-(aq) + H3O+(aq)
تؤدي زيادة الأنشطة التي يمارسها الشخص إلى زيادة معدل التنفُّس اللاهوائي في الخلايا وزيادة إنتاج ثاني أكسيد الكربون CO2، الذي يندفع إلى الدم ويتفاعل معَ الماء ويؤدي إلى زيادة تركيز H2CO3.
CO2 (g) + H2O(l) H2CO3(aq)
وعند زيادة تركيزُ أيونات H3O+في الدم يعمل المحلول المنظِّم على التخلُّص من تلك الزيادة، وذلك عن طريق إزاحة موضع الاتزان إلى جهة اليسار نحو تكوين حِمض الكربونيك 3H2CO، فيزداد تركيزُه في الدم، ويقل بذلك تركيزُ -HCO3، ويقل تركيزُ أيونات +H3O؛ ما يحفِّزُ الكُلى على إنتاج أيونات -HCO3
لتعويض النقص في تركيزها، وتعمل الرئة على امتصاص الزيادة في تركيز حِمض الكربونيك في الدم؛ حيث يتفكَّكُ حِمض الكربونيك في الرئة إلى ثاني أكسيد الكربون CO2 وبخار الماء، ويجري التخلُّصُ منهما عن طريق التنفس. وتستمرُّ إزاحة موضع الاتزان مرّةً نحو اليسار وأخرى نحو اليمين؛ ممّا يساعد على بقاء تركيز أيونات + H3O ثابتًا نسبيًّا، ويحافظ على مدى ثابت منَ الرَّقْم الهيدروجيني في الدم. HCO3 زيادة أو نقصانًا، أما الرئة فتعمل على ضبط تركيز ثاني وبهذا؛ فإنَّ الكُلى تعمل على ضبط تركيز أيونات - أكسيد الكربون في الخلايا وتركيز حِمض الكربونيك في الدم.