- تعريفه : هو تحلل مركب واحد بالحرارة منتجًا مادتين أو أكثر وقد تكون النواتج عناصر أو مركبات.
- من الأمثلة على هذا النوع من التفاعلات الكيميائية:
1) تحلل كربونات النحاس بالحرارة منتجة أكسيد النحاس وغاز ثاني أكسيد الكربون ويعبر عن تفاعلها بالمعادلة الأتية :
2) تحلل نترات الأمونيوم بالحرارة منتجة أكسيد ثنائي النيتروجين وبخار الماء ويعبر عن تفاعلها بالمعادلة الأتية:
3) تحلل دايكرومات الأمونيوم (Cr2O72(NH4)( بالحرارة منتجة أكسيد الكروم (Cr2O3) وغاز النيتروجين (N2)
وبخار الماء (H2O) ، ويمكن التعبير عنه بالمعادلة الكيميائية الموزونة الأتية :
- حيث تتسبب الغازات الناتجة فوارانًا يشبه البركان كما في الصورة الأتية :

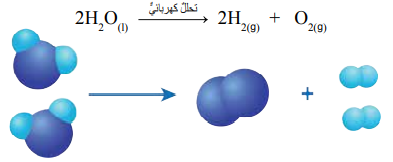
4) قد تعتمد بعض تفاعلات التحلل على إستخدام التيار الكهربائي بدلًا من الحرارة، فمثلًا يتحلل الماء تحللاً كهربائيًا إلى عنصري الهيدروجين والأكسجين كما يأتي :
- التجربة (2) : ( تفاعل التحلل)
- المواد والأدوات المستخدمة :
1) هيدروكسيد النحاس (Cu(OH)2) 2) جفنة تسخين 3) لهب بنسن 4) ملعقة 5) منصب ثلاثي
- خطوات العمل :
1) أضع ملعقة من هيدروكسيد النحاس في الجفنة
2) أسخن الجفنة على اللهب لمدة خمس دقائق، ثم اترك الجفنة حتى تبرد
3) ألاحظ التغير الذي حدث على هيدروكسيد النحاس، ثم أسجل ملاحظاتي
- التحليل والإستنتاج :
1) أصف التغير الذي حدث على المادة المتفاعلة قبل التسخين وبعده
2) أكتب معادلة كيميائية موزونة للتفاعل
- الملاحظات على التجربة :
1) نلاحظ تغير اللون الأزرق إلى اللون الأسود
2) المعادلة الكيميائية الموزونة التي تمثل التفاعل الحاصل :
- بماذا يختلف تفاعل الإتحاد عن تفاعل التحلل الحراري :
- تفاعل الإتحاد : هو تفاعل بين مادتين أو أكثر لإنتاج مادة واحدة جديدة
- تفاعل التحلل : هو عبارة عن مادة واحدة تتحلل منتجة مادتين أو أكثر
- تعريفه : هو تفاعل يحل فيه عنصر نشط محل عنصر أخر أقل نشاطًا منه في محاليل أحد أملاحه
- من الأمثلة على هذا النوع من التفاعلات الكيميائية :
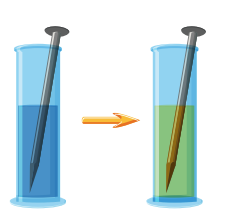
1) عند وضع مسمار من الحديد في محلول كبريتات النحاس II) فإن عنصر الحديد يحل محل أيونات النحاس في المحلول وينتج عن ذلك محلول كبريتات الحديد وتترسب ذرات النحاس كما هو موضح بالصورة الأتية :
- ويعبر عن هذا التفاعل بالمعادلة الكيميائية الموزونة الأتية :
2) تفاعل عنصر النحاس مع محلول نترات الفضة لينتج نترات النحاس وتترسب ذرات الفضة كما في المعادلة الأتية :
3) تترسب ذرات النيكل (Ni) عند وضع قطعة من عنصر الخارصين (Zn) في محلول من كبريتات النيكل (NiSO4) ،وذلك لأن الخارصين أنشط من عنصر النيكل ، لذلك تحل ذرات الخارصين محل أيونات النيكل ، فتترسب ذرات النيكل وتنتج كبريتات الخارصين ،ويعبر عن هذا التفاعل من خلال المعادة الكيميائية الأتية :
- التجربة (3) : ( تفاعل الإحلال الأحادي )
- المواد والأدوات المستخدمة :
1) كبريتات النحاس(II) (CuSO4) 2) ماء مقطر 3) كأس زجاجية بسعة ml250 4) ملعقة 5) صفيحة خارصين (Zn)
- خطوات العمل :
1) أضع ملعقة من كبريتات النحاس (II) في الكأس الزجاجية وأضيف إليها 20ml من الماء المقطر ثم أحرك الخليط جيدًا حتى يذوب تمامًا
2) ألاحظ التغير الذي حدث لصفيحة الخارصين والمحلول وأسجل ملاحظاتي
- التحليل والإستنتاج :
1) ماذا حدث للون صفيحة الخارصين ولون المحلول في الكأس الزجاجية
2) أكتب معادلة كيميائية موزونة للتفاعل
- الملاحظات على التجربة :
1) إختفاء تدريجي للون المحلول الأزرق ويظهر اللون البني المحمر ، نتيجة ترسب ذرات النحاس على صفيحة الخارصين والمحلول
2) المعادلة الكيميائية الموزونة التي تمثل التفاعل الحاصل :