|
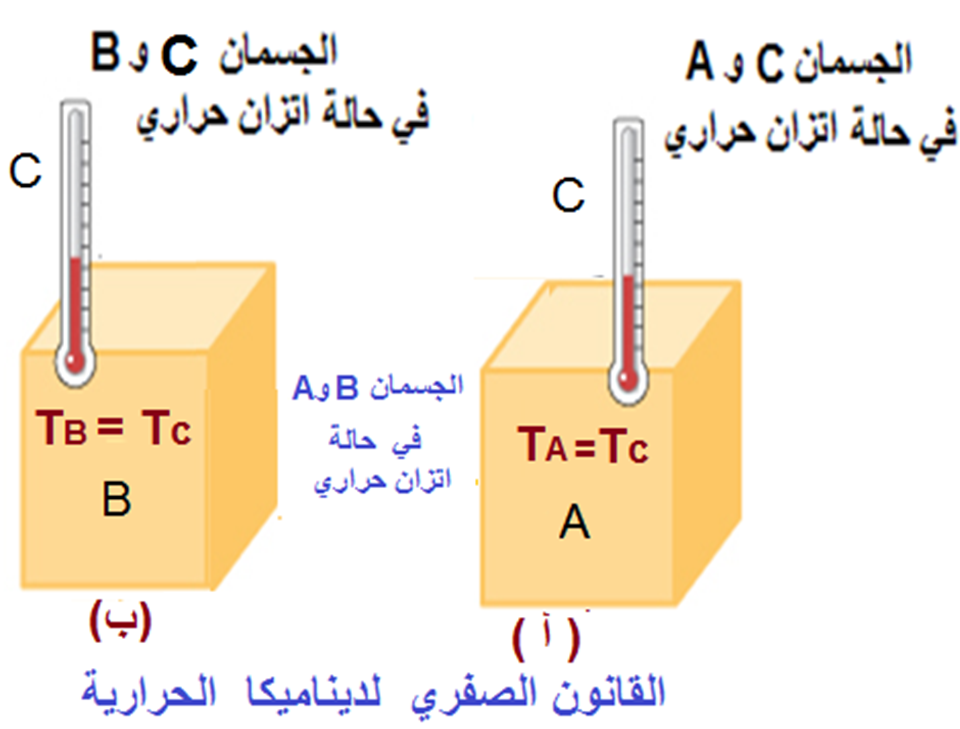
الديناميكا الحرارة القانون الصفري في الديناميكا الحرارية The Zeroth Law of Thermodynamics عند حدوث اتصال حراري بين جسمين أو نظامين مختلفين في درجتي حرارتيهما؛ فإن الطاقة تنتقل على شكل حرارة من الجسم الأعلى درجة حرارة إلى الجسم الأدنىدرجة حرارة، حتى يصبح لهما درجة الحرارة نفسها،وعندها يصبحان في حالة اتزان حراري؛ إذ يتساوى معدلا انتقال الطاقة بين الجسمين؛ أي يكون مجموع الطاقة المنتقلة بينهما صفرا خلال الفترة الزمنية نفسها. يوضح الشكل ثلاثة أجسام: A و B و C. ألاحظ أنه لا يوجد اتصال حراري بين الجسمين A و B. ويمثل الجسم C فيهما مقياس درجة الحرارة. وأرغب في تحديد هل الجسمان A و B في حالة اتزان حراري مع بعضهما أم لا؟ من أجل ذلك، أضع الجسم C في حالة اتصال حراري مع الجسم A حتى يصلا إلى الاتزان الحراري، وأدون درجة الحرارة TC عند الاتزان، كما هو موضح في الشكل.حيث TA = TC . ثم أبعد الجسم C عن الجسم A وأضعه في حالة اتصال حراري مع الجسم B، كما هو موضح في الشكل، ثم أدون درجة الحرارة TC عند وصول النظام المكون من الجسمين إلى الاتزان الحراري، حيث TB = T`C. إذا كانت درجتا الحرارةTC = T`C فأستنتج أن الجسمين A و B في حالة اتزان حراري؛ أي إن TA = TB ، وذلك بإهمال الطاقة المنتقلة بينكل من الجسمين A و B ومقياس درجة الحرارة (الجسم C) بوصفها صغيرة جدا ولا تؤثر في القياسات. تسمى النتيجة السابقة - التي يمكن تسميتها المسلمة - القانون الصفري في الديناميكا الحرارية (قانون الاتزان) The Zeroth law of thermodynamics الذي ينص على ما يأتي: إذا وجد جسمان A و B منفصلان، وكل منهما في حالة اتزان حراري مع جسم ثالث C؛ فإن الجسمين A و Bسيكونان في حالة اتزانحراري مع بعضهما عند اتصالهما حراريا وقد سمي هذا الاسم لأن العلماء أدركوا بعد وضعهم القانونين الأول والثاني في الديناميكا الحرارية، أن هذه المسلمة يجب صياغتها أولا على شكل قانون. تكمن أهمية القانون الصفري في تقديمه تعريفا لدرجة الحرارة، فحسب هذا القانون تعرف درجة الحرارةبأنها خاصية الجسم (النظام) التي تحدد إذا كان الجسم في حالة اتزان حراري مع أجسام أخرى. فإذا كان جسمان في حالة اتزان حراري مع بعضهما فيكون لهما درجة الحرارة نفسها، أما إذا كانت درجتا حرارتيهما مختلفتين، فلا يكونان في حالة اتزان حراري مع بعضهما. |
|
||||
|
القانون الأوّل في الديناميكا الحرارية The First Law of Thermodynamics يعنى القانون الأول في الديناميكا الحرارية بوصف الأنظمة التي يكون فيها تغير في الطاقة الداخلية، وتنقل الطاقة فيها عن طريق الحرارةأو الشغل أو الاثنين معا؛ لذا يلزمني تعرف الطاقة الداخلية، والعلاقة بين الشغل والحرارة، والعمليات الحرارية ،Thermodynamic processesللتوصل إلى هذا القانون وفهمه. في منتصف القرن التاسع عشر، أظهرت تجارب نفذها العالم الإنجليزي جيمس جول وآخرون، علاقة وطيدة بين نقل الطاقة عن طريق الحرارة في العمليات الحرارية، ونقلها عن طريق الشغل في العمليات الميكانيكية؛ إذ يمكن تحويل الطاقة الميكانيكية إلى طاقة داخلية. الطاقة الداخلية Internal Energy النظام جميعهاالطاقة الداخلية Internal energy ، وهي ترتبط بمكونات النظام المجهرية، ورمزها U، وتقاس بوحدة الجول (J) حسب النظام الدولي للوحدات.الطاقة الحركية هي جزء من الطاقة الداخلية للنظام وترتبط بالطاقة الحركية لجزيئاته، والناتجة عن حركتها الانتقالية والدورانية والاهتزازية،ولا ترتبط بحركة النظام الانتقالية؛ فمثلا، الطاقة الداخلية لكرة قدم تحلق في الهواء ترتبط بالطاقة الحركية للجزيئات المكونة لها ولجسيمات الهواء داخلها ولا علاقة لها بحركة الكرة. تعتمد الطاقة الداخلية للمواد الصلبة والسائلة على كل من: درجة الحرارة، وكمية المادة، وتركيبها الكيميائي. أما في الغازات فإن الطاقةالداخلية لها تعتمد على ضغط الغاز إضافة إلى العوامل السابقة. فكلما زاد الضغط المطبق على الغاز تقل المسافة بين جزيئاته، فتزداد طاقتها الكامنة نتيجة زيادة القوى بينها. إن الطاقة الميكانيكية لنظام لا تكون محفوظة عند تأثير قوى غير محافظة فيه وبذلها شغلا عليه، حيث يفقد جزء من الطاقة الميكانيكية على شكل شغل للتغلب على قوى الاحتكاك وأشكال أخرى من الطاقة. وإذا افترضت أن التغيرات في الطاقة الميكانيكية قد غيرت الطاقةالداخلية فقط، فتكون الطاقة محفوظة عند أخذ التغيرات في الطاقة الداخلية مع التغيرات في الطاقة الميكانيكية في الحسبان؛ أي إن: ΔPE + ΔKE + ΔU = 0 العلاقات بين الحرارة والشغل والطاقة الداخلية Relationships between Heat, Work and Internal Energy عندما تزداد الطاقة الداخلية لجسم، فهذا قد يعني ازدياد مقدار سرعة حركة جسيماته، فيزداد متوسط طاقتها الحركية، أو يزدادمتوسط الطاقة الكامنة لهذه الجسيمات، أو ازدياد كلاهما معا. العلاقة بين الحرارة والطاقة الداخلية تزداد الطاقة الداخلية لجسم أو نظام عند اكتسابه طاقة. فمثلا، يمكنني تدفئة يدي بتزويدهما بالطاقة عن طريق تقريبهما من مصدرحراري، إذ تنتقل الطاقة من المصدر إلى يدي عن طريق الإشعاع الحراري، نتيجة الفرق في درجة الحرارة بين يدي والمحيط الخارجي،كما هو موضح في الشكل. وتزيد الطاقة المكتسبة من الطاقة الداخلية في يدي وأشعر بدفئهما، ما يعني ارتفاع درجة حرارتهما. أتذكر من الدرس السابق أن: تزويد جسم بالطاقة لا يؤدي إلى رفع درجة حرارته دائما، وذلك عند تغير حالته الفيزيائية.وتقل الطاقة الداخلية لجسم أو نظام عند فقده طاقة؛ إذ تفقد الأجسام طاقة إذا كانت درجة المحيط الخارجي أقل من درجة حرارتها.
كما يمكن زيادة الطاقة الداخلية لجسم أو نظام ببذل شغل عليه. فمثلا، يمكنني تدفئة يدي عن طريق بذل شغل عليهما بدلكهما معا؛إذ يلزمني بذل شغل للمحافظة على حركة يدي إحداهما بالنسبة إلى الأُخرى للتغلب على قوة الاحتكاك الحركي بينهما، أنظر إلى الشكل.وهذا يزيد من الطاقة الداخلية في يدي، ما يرفع درجة حرارتهما. كما يمكن تقليل الطاقة الداخلية لجسم أو نظام عن طريق بذله شغل.أسأل: كيف يبذل الجسم شغلا؟ أحيانا أرى أسطوانة تحتوي على غاز مسال، ويوجد جليد على جدارها الخارجي، كما هو موضح في الشكل.ويتشكل الجليد حتى عندما تكون درجة حرارة الهواء خارج الأسطوانة أعلى من درجة تجمد الماء. وأفسر ذلك بأن الغاز داخل الأسطوانة يضغط بحيث يتحول جزء منه إلى سائل. وعند فتح الصمام الموجود في أعلى الأسطوانة، يتمدد الغاز الموجود فوق السائل، ما يقللالضغط المؤثر في سطح السائل فيتبخر. وهذا البخار يبذل شغلا في أثناء تمدده على الغاز الذي فوقه، فتتناقص الطاقة الداخلية فيأثناء بذله الشغل حسب قانون حفظ الطاقة، فتنخفض درجة حرارته ودرجة حرارة السائل والأسطوانة، ما يؤدي إلى تشكل الجليد علىالسطح الخارجي للأسطوانة. |
|
||||
|
العلاقة بين الشغل والحرارة
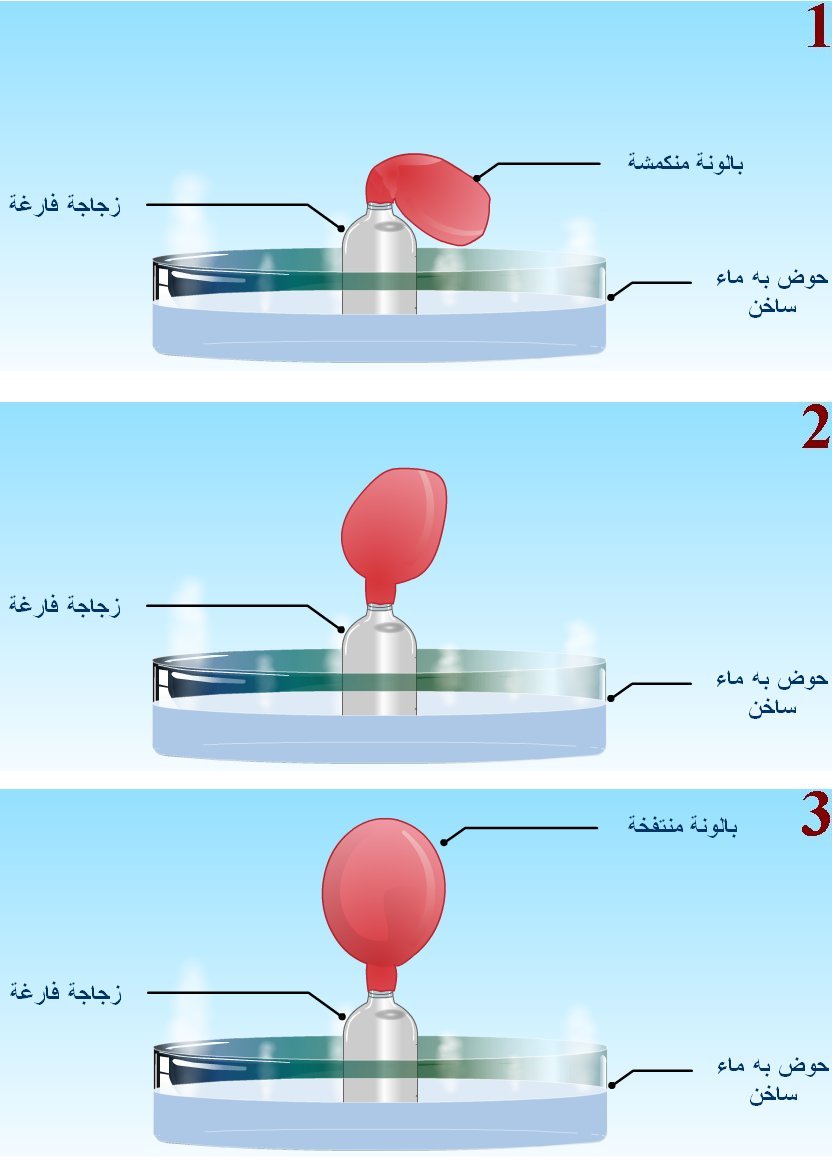
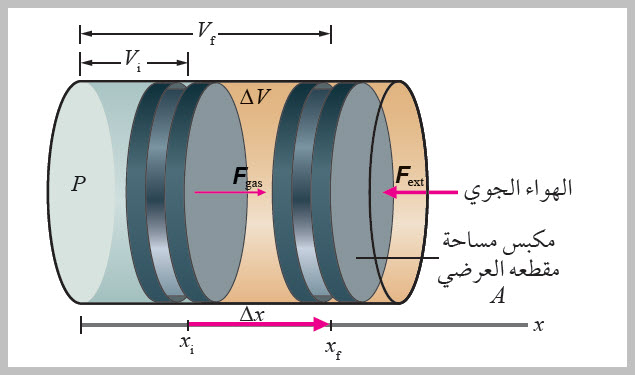
الطاقة بين الأجسام بطريقة ميكانيكية. وألاحظ أن سحب مسمار بسرعة من قطعة خشب يجعله ساخنًا؛ إذ يبذل شغل لسحبه من قطعة الخشب، وتؤثر فيه قوة احتكاك من الخشب، ويتحول معظم الطاقة المبذولة (الشغل) للتغلب على قوة الاحتكاك هذه إلى طاقة داخلية للمسمار، ويؤدي ازدياد طاقته الداخلية إلى ارتفاعدرجة حرارته، وينتقل جزء من الطاقة الحرارية للمسمار إلى قطعة الخشب، فترتفع درجة حرارة الخشب أيضا. أي إنه يمكن تحويل الشغل إلى طاقة داخلية. ويمكن للطاقة الداخلية لجسم أن تزداد بطرائق أخرى مثل طرقه لتغيير شكله، كما يحدث عند ثني قطعة فلزية. كذلك يمكن للحرارة أن تؤدي إلى بذل شغل؛ فقد لاحظت في الشكلالمجاور أن جزيئات السائل التي على السطح تكتسب طاقة منه فتتبخر، وتبذل جزيئات الغاز المتبخرةشغلا على الغاز الذي يعلوها في أثناء تمدده فتنخفض طاقته الداخلية ودرجة حرارته. فعند تثبيت بالونبفوهة دورق زجاجي يحتوي على ماء، ووضعه على مصدر حراري، كما هو موضح في الشكل ينتفخ البالون عند غليان الماء؛ إذ تؤدي الطاقة المنتقلة من المصدر الحراري إلىزيادة الطاقة الداخلية للماء حتى يصلإلى درجة الغليان ويتبخر، فيزداد حجم البخار باستمرار التسخين ويتمدد داخل البالون، ما يتسبب في انتفاخ البالون؛ إذ يؤثر البخار بقوة في الجدار الداخلي للبالون تدفعه بعكس قوة الضغط الجوي، أي إن البخار يبذلشغلا على الهواء الجوي الموجود خارج البالون في أثناء تمدده، وتقل طاقته الداخلية. إن الشغل والحرارة متشابهان، فكلاهما يعبر عن الطاقة التي يفقدها الجسم أو يكسبها. أي إنهما يشيران إلى الطاقة المنتقلة من الجسم أو إليه، ما يغير في طاقته الداخلية. .فالأجسام لا تملك حرارة أو شغل، بل تملك طاقة داخلية. الشغل المبذول عند تغير حجم الغاز Work Done when Gas Volume Changes في الديناميكا الحرارية، توصف حالة النظام باستخدام متغيرات مثل: الضغط P، والحجم V، ودرجة الحرارة T، والطاقة الداخلية U؛ إذ تنتمي هذه الكميات إلى فئة تسمى متغيرات الحالة State variables ، ويمكن تحديد ِ قيمها لأي ترتيب معين للنظام. (بالنسبة إلى الأنظمة الميكانيكية، تشمل متغيرات الحالة: الطاقة الحركية KE ، والطاقة الكامنة PE ). ولا يمكن تحديد حالة النظام إلا إذا كان في حالة اتزان حراري داخلي. وفي حالة الغاز المحصور في وعاء أو أسطوانة، يتطلب الاتزان الحراري الداخلي له أن يكون لكل جزء منه الضغط نفسه ودرجة الحرارة نفسها. درست أن الحرارة هي انتقال للطاقة من جسم إلى آخر، وهنا سأدرس آلية أخرى لنقل الطاقة في أنظمة الديناميكيا الحرارية وهي الشغل. والشغل المبذول على نظام قابل للتغير في حجمه، وهو الغاز. يبين الشكل أسطوانة مملوءة بغاز عند ضغط ثابت (P)، مغلقة بمكبس مساحة مقطعه العرضي ( A) قابل للحركة لتغيير حجم الغاز (V)، وأفترض عدم وجود قوة احتكاك بين المكبس والجدار الداخلي للأسطوانة. بداية، يكون المكبس في حالة اتزان سكوني لأن ضغط الغاز داخل الأسطوانة مساو للضغط الجوي، وعند تسخين الغاز تزداد الطاقة الحركية لجزيئاته، فتؤثر بقوة إضافية في المكبس، الذي يستجيب لذلك بالحركة نحو اليمين. |
|
||||
|
يؤثر الغاز المحصور بقوة Fgas في المكبس الذي يتحرك إزاحة مقدارها ( Δx ) نحو اليمين باتجاه قوة الغاز وبعكس اتجاه القوة الخارجية( Fext قوة ناتجة عن الضغط الجوي) المؤثرة فيه؛ فيزداد حجم الغاز، وتكون الزاوية ( θ) بين اتجاهي القوة الخارجية المؤثرة في الغاز والإزاحة تساوي ( 180˚ ). ولضمان ثبات ضغط الغاز في أثناء تمدده؛ أفترض أن إزاحة المكبس صغيرة فيكون التغير في حجم الغاز صغيرا، وبذلك تكون القوتان Fgas و Fext متساويتين في المقدار ومتعاكستين في الاتجاه، فيتحرك المكبس نحو اليمين بسرعة ثابتة. وأحسب الشغل المبذول على الغاز ( W) بضرب مقدار القوة الخارجية في إزاحة المكبس في جيب تمام الزاوية المحصورة بين اتجاهي القوة والإزاحة. للتبسيط، سأستخدم Fext= F ، وعليه يعطى الشغل الذي تبذله القوة الخارجية على الغاز بالعلاقة: W = FΔx cos 180˚ = -FΔ x ، فإنني أعوض مقدار القوة ( F = PA ) في العلاقة السابقة؛ فأحصل على ما يأتي: W = -PA Δx ألاحظ أن التغير في حجم الغاز داخل الأسطوانة يعطى بالعلاقة ΔV = A Δx ؛ لذا، يمكنني كتابة معادلة حساب الشغل المبذول على الغاز بدلالة التغير في حجم الغاز عند ضغط ثابت كما يأتي: W = -P ΔV فتكون ΔV < 0 ؛ لذا، فإن الشغل المبذول عليه W > 0 . أما الشغل الذي يبذله الغاز على محيطه الخارجي ( Wgas ) فيكون مساويا لسالب الشغل الذي يبذله المحيط الخارجي على الغاز؛ أي إن Wgas = -W = P ΔV |
|||||
|
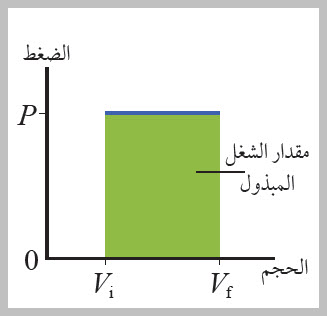
يوضح الشكل منحنى (الضغط - الحجم) لغاز محصور. حسب معادلة حساب الشغل السابقة، أستنتج أن سالب مقدار المساحة المحصورة بين منحنى (الضغط - الحجم) ومحور الحجم تساوي عدديا مقدار الشغل المبذول على الغاز. أيضا، يمكنني استخدام منحنى (الضغط - الحجم) لتحديد إذا كان الشغل يبذله الغاز أو يبذل عليه. |
 |
||||
|
أفترض وجود نظام يتكون من غاز في أسطوانة محكمة الإغلاق بمكبس قابل للحركة بحرية، إن الضغط الابتدائي للغاز المحصور (Pi)، وحجمه الابتدائي ( Vi )، |
|||||
|
عندما أدفع مكبس الأسطوانة إلى الداخل، يقل حجم الغاز ويزداد ضغطه (ما لم يجر تبريده)، كما هو موضح في الشكل. وهذا يعني أن النقطة علىمنحنى (الضغط - الحجم) التي تمثل حالة الغاز ستتحرك إلى اليسار حيث قيم ( V) أصغر.
|
أما عندما يتمدد الغاز فسيدفع المكبس للخارج، كما هو موضح في الشكل، فيزداد حجم الغاز ويقل ضغطه (ما لم يجر تسخينه)، وأي حركة إلى اليمين على منحنى (الضغط - الحجم) توضح أن الغاز يبذل شغلا. |
||||
 |
 |
||||
|
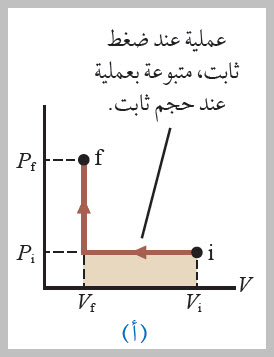
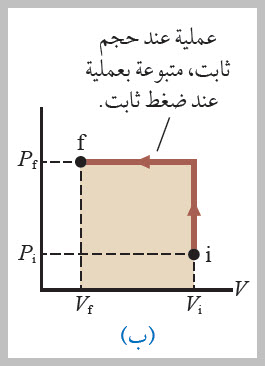
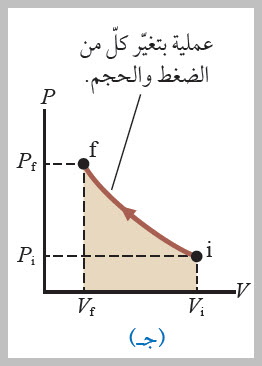
الشغل المبذول عند ضغط غاز يعتمد على المسار وعموما، إذا عرف ضغط غاز وحجمه عند كل مرحلة من مراحل عملية انضغاطه، فيمكن رسم حالة الغاز عند كل منها على منحنى(الضغط - الحجم)، كما هو موضح في الشكل . وألاحظ من الشكل أن الشغل المبذول في عملية ضغط غاز في أسطوانة يعتمد على المسار الذي يسلكه الغاز بين الحالتين: الابتدائية، والنهائية. ولتوضيح ذلك، أنظر إلى المسارات المختلفة التي يمكن سلوكها بين الحالتين: ( i) و ( f) في الحالات الآتية: |
|||||
|
1- في العملية الموضحة في الشكل (أ)، يقلل حجم الغاز أولا من( Vi ) إلى ( Vf ) عند ضغط ثابت ( Pi )، ثم يسخن الغاز عند حجم ثابت (Vf)، فيزداد ضغطه من (Pi) إلى ( Pf ). إن الشغل المبذول على الغاز على طول هذا المسار يساوي ( Pi ΔV -). |
|
||||
|
2- في العملية الموضحة في الشكل (ب)، فتجري زيادة ضغط الغاز من ( Pi ) إلى ( Pf ) عند حجم ثابت(Vi)، ثم تقليل حجم الغاز من ( Vi ) إلى ( Vf ) عند ضغط ثابت ( Pf ). إن الشغل المبذول على الغازعلى امتداد هذا المسار يساوي ( Pf ΔV -). ويكون مقدار الشغل في هذه العملية أكبر من مقدارهفي العملية السابقة؛ لأن المكبس حرك خلال الإزاحة نفسها بقوة أكبر. |
|
||||
|
3- في العملية الموضحة في الشكل (ج)، يتغير كل من (P) و (V)باستمرار؛ لذا، فإن مقدار الشغل المبذول على الغاز في هذهالعملية يقع بين مقداري الشغل اللذين جر ى الحصول عليهافي العمليتين السابقتين.ويتطلب حساب الشغل في هذه العملية، معرفة الاقتران (P (V ؛ الذي يبين تغير الضغط بدلالة الحجم، ومعرفة بحساب التكامل. |
|
||||
|
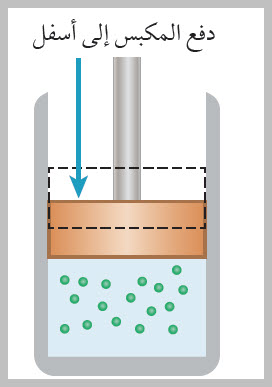
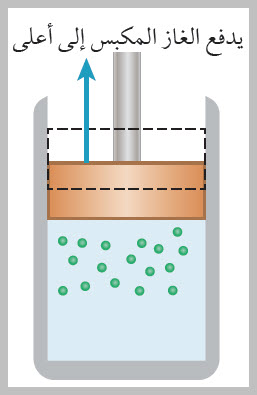
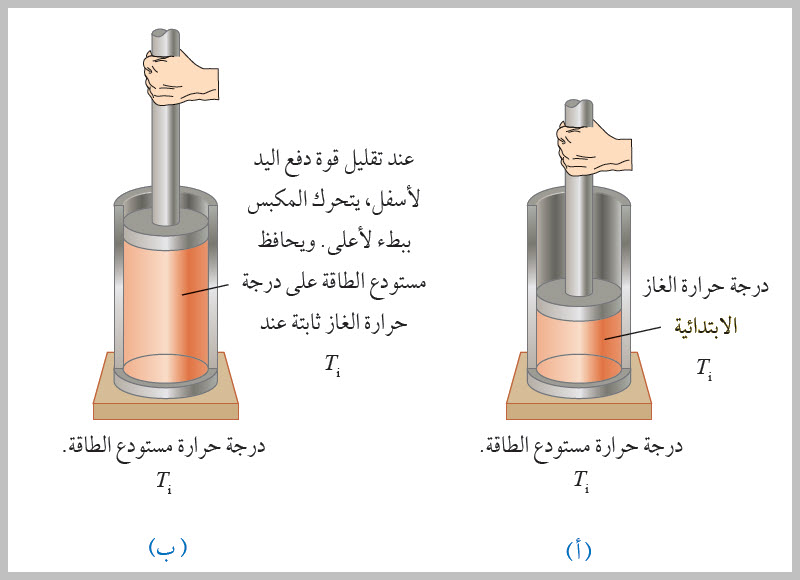
الطاقة المتبادلة مع نظام تعتمد على المسار يعتمد مقدار الطاقة ( Q) التي يكتسبها نظام أو يفقدها أيضا، على المسار الذي يسلكه النظام بين حالتيه: الابتدائية والنهائية. الحالة الأولى: يوضح الشكل غازا مثاليا محصورا داخل أسطوانة، ويكون للغاز في الشكل مقادير الحجم الابتدائي ودرجة الحرارة والضغط نفسها. في الشكل (أ)، الغاز معزول حرار يا عن المحيط الخارجي باستثناء الجزء السفلي منه، الذي يكون في حالة اتصال حراري مع مستودع طاقة Energy reservoir ، وهو مصدر طاقة كبير لدرجة أن نقل كمية محددة من الطاقة من المستودع أو إليه لا يغير درجة حرارته. وألاحظ أن مكبس الأسطوانة مثبت في موقعه الابتدائي باليد (قوة خارجية). عند تقليل مقدار القوة الخارجية المؤثرة في المكبس تدريجيا بمقدار صغير. يرتفع المكبس ببطء شديد إلى أعلى، ويزداد حجم الغاز، ويصبح حجمه النهائي ( Vf ) كما هو موضح في الشكل (ب)؛ إذ يبذل الغاز شغلا على المكبس في أثناء حركته إلى أعلى. وفي أثناء هذا التمدد تنتقل طاقة كافية (حرارة) من مستودع الطاقة إلى الغاز للمحافظة علىثبات درجة حرارته (Ti).
|
 |
||||
|
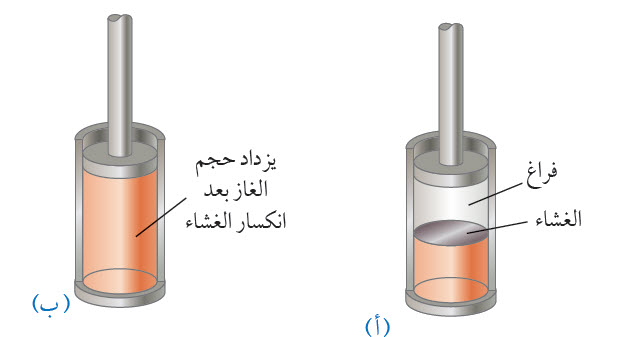
الحالة الثانية: يوضح الشكل غازا مثاليا محصورا داخل أسطوانة، ويكون للغاز في الشكلين مقادير الحجم الابتدائي ودرجة الحرارة والضغط نفسها. يوضح الشكل (أ) نظاما معزولا حرار يا تماما؛ إذ يملأ الغاز نصف الأسطوانة السفلي، ونصفها العلوي فراغ، ويفصل بينهما غشاء رقيق. عند إزالة/كسر الغشاء، يتمدد الغاز بسرعة في الفراغ ويصبح حجمه النهائي ( Vf )، وضغطه النهائي ( Pf ). ويوضح الشكل (ب) هذه الحالة النهائية للغاز. وألاحظ في هذه العملية أن الغاز لا يبذل شغلا؛ لأنه لا يؤثر بقوة؛ إذ لا تلزم قوة للتمدد في الفراغ، ولا تنتقل طاقة على شكل حرارة عبر الجدران المعزولة حراريا. تظهر التجارب أن درجة حرارة الغاز المثالي لا تتغير في العملية الموضحة في الحالتين أعلاه؛ لذا، فإن الحالتين الابتدائية والنهائية للغاز المثالي في الحالة الأولى مماثلة تماما للحالتين الابتدائية والنهائية في الحالة الثانية لكن المسارين مختلفان. في الحالة الأولى، يبذل الغاز شغلا على المكبس، وتنتقل الطاقة ببطء إلى الغاز على شكل حرارة. في الحالة الثانية، لا تنتقل طاقة على شكل حرارة، ومقدار الشغل المبذول صفر. أي إن نقل الطاقة على شكل حرارة يعتمد على عملية الديناميكا الحرارية التي تحدث في النظام، كما هي الحال في حالة الشغل المبذول. أستنتج مما سبق، أنه لا تحدد الحرارة (الطاقة المنتقلة) أو الشغل المبذول عن طريق نقطتي بداية ونهاية العملية الديناميكية الحرارية؛ لأن كل منهما يعتمد على المسار المتبع بين الحالتين الابتدائية والنهائية في منحنى (الضغط-الحجم). |
 |
||||
|
غاز محصور في أسطوانة حجمه ( )، وضغطه ( )، ومكبس الأسطوانة مهمل أحسب مقدار ما يأتي: الحل أ . تمدد الغاز تحت ضغط ثابت، والشغل الذي يبذله الغاز يساوي سالب الشغل الذي يبذله المحيط
|
|||||
|
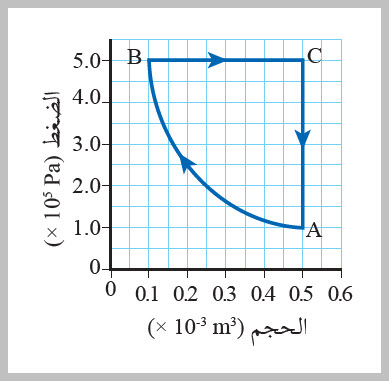
يوضح الشكل منحنى (الضغط-الحجم) لعينة من غاز محصور في أثناء مروره بدورة تغيرات ABCA . أجيب عما يأتي: أ . أي العمليات يبذل فيها شغل على الغاز؟ ب. أي العمليات يتغير فيها ضغط الغاز، ولا يوجد شغل مبذول من الغاز أو عليه؟ ج. هل يبذل الغاز شغلا أم يبذل عليه في العملية من B إلى C ؟ د . أحسب الشغل المبذول على الغاز في العملية من B إلى C. الحل أ .يبذل شغل على الغاز عندما يتغير منحنى (الضغط-الحجم) عبر المسار من A إلى B. ب. في منحنى (الضغط - الحجم)، لا يبذل شغل على الغاز ولا يبذل الغاز شغلا عندما لا يوجد تغير في حجمه؛ إذ يكون منحنى (الضغط-الحجم) رأسيا؛ ويوضح الجزء الرأسي من المنحنى ( C إلى A) أن الضغط يتناقص. ج. يبذل الغاز شغلا خلال هذا الجزء من المنحنى؛ لأن المنحنى يتجه نحو اليمين إذ يتمدد الغاز. د. تمدد الغاز تحت ضغط ثابت من B إلى C لذا أستخدم العلاقة الآتية لحساب الشغل المبذول عليه من المحيط الخارجي.
|
 |
||||
|
كتلة ثابتة من غاز النيتروجين حجمها ( 2.5x10-2m3 )، تمددت تحت ضغط ثابت مقداره ( 1.01x105Pa ) بحيث أصبح حجمها ( 2.8x10-2m3 ). أحسب مقدار ما يأتي: أ . الشغل الذي يبذله الغاز في أثناء تمدده. ب. قوة ضغط الغاز المؤثرة في المكبس في أثناء تمدد الغاز إذا تحرك المكبس إزاحة مقدارها (5.6cm ) الحل: أ- الشغل الذي بذله الغاز تحت ضغط ثابت يساوي سالب الشغل الذي يبذل المحيط:
ب. قوة ضغط الغاز تحسب من علاقة الشغل:
|
|||||
|
مثال محلول: يوضح الشكل المقابل منحنى (الضغط-الحجم) لعينة من غاز محصور في أسطوانة مغلقة في إحدى نهايتيها بمكبس حر الحركة، في أثناء مرور الغاز بدورة تغيرات ABC . ُ أجيب عما يأتي: أ . أي العمليات ُ يبذل فيها شغل على الغاز؟ ب. أي العمليات يبذل فيها الغاز شغلا؟ ج. أي العمليات لا يبذل فيها الغاز شغلا ولا ُ يبذل عليه شغلا؟ الحل: أ. العملية التي يبذل فيها شغل على الغاز هي ( B ) إلى ( C ) ( نقصان الحجم ) 2. العملية التي يبذل فيها الغاز شغلاً هي عند تمدده ( في المرحل من ِA إلى B ) 3. العملية التي لايبذل الغاز شغل ولا يُبذل عليه هو عند ثبات الحجم من A إلى C |
 |
||||
|
تجارب العالِم جول Joule’s Experiments واكتشف أن الشغل والطاقة متكافئان، وهذا سبب تسمية وحدتي قياسهما باسمه. أظهرت تجاربه أن الحرارة طاقة وليست مائعا، وأن الشغل الميكانيكي يمكن تحويله إلى طاقة حرارية. أي أنه يمكن زيادة الطاقة الداخلية لنظام عن طريق تسخينه أو بذل شغل ميكانيكي عليه. أدى هذا إلىالتوصل إلى القانون الأول في الديناميكا الحرارية The first law of thermodynamics ، الذي ينص على أن: لتغير في الطاقة الداخلية لنظاميساوي الطاقة المتبادلة مع النظام مضافا إليها الشغل المبذول . ΔU = Q + W ويعد هذا القانون نتاج تطبيق قانون حفظ الطاقة، وهو يربط بين التغير في الطاقة الداخلية للنظام، والطاقة المتبادلة معه على شكل حرارةوشغل ميكانيكي. وهو حالة خاصة من قانون حفظ الطاقة؛ إذ يصف العمليات التي تتغير فيها الطاقة الداخلية لنظام، وتكون فيها عمليات نقل الطاقة عن طريق الحرارة والشغل فقط. وعند استخدام هذه المعادلة، يجب مراعاة:
النظام الدولي للوحدات.
تسمى المحركات التي تحول الطاقة الحرارية إلى شغل ميكانيكي المحركات الحرارية Heat engines . ومنها: محركات الاحتراق الداخلي في المركبات، والمحركات التوربينية في الطائرات، والمحركات التوربينية البخارية في محطات الطاقة.تزود هذه المحركات بالطاقة (حرارة) لتحويلها إلى شغل. أما المضخات الحرارية Heat pumps فيبذل فيها شغل على نظام من أجل نقل الطاقة من منطقة أبرد إلى منطقة أسخن؛ أي نقلها بعكس اتجاه انتقالها التلقائي. ومن أمثلتها الثلاجات ومكيفات الهواء. كل هذه الأنظمة تحقق القانون الأول في الديناميكا الحرارية.
|
|||||
|
عمليات الديناميكا الحرارية Thermodynamics Processes حدوث تغير في هذه الكميات الفيزيائية الثلاث في كل عملية حرارية. وقد تتغير الطاقة الداخلية لنظام في عملية ما عند حدوث تبادل حراري مع المحيط الخارجي من دون بذل شغل عليه. وفي معظم العمليات الحرارية يحدث التفاعل بين النظام ومحيطه الخارجي على شكل حرارة وشغل. وإذا كان النظام معزولا Isolated system ؛ فإنه لا يتبادل طاقة مع المحيط الخارجي ( Q = 0 )، والشغل المبذول عليه يساوي صفرا ( W = 0 )؛ لذا، لا تتغير الطاقة الداخلية للنظام؛ Ui = Uf . وقبل تطبيق القانون الأول في الديناميكا الحرارية على أنظمة محددة لا بد من تعرف بعض العمليات الحرارية المثالية. |
|||||
 |
_1650229395.gif) |
||||
|
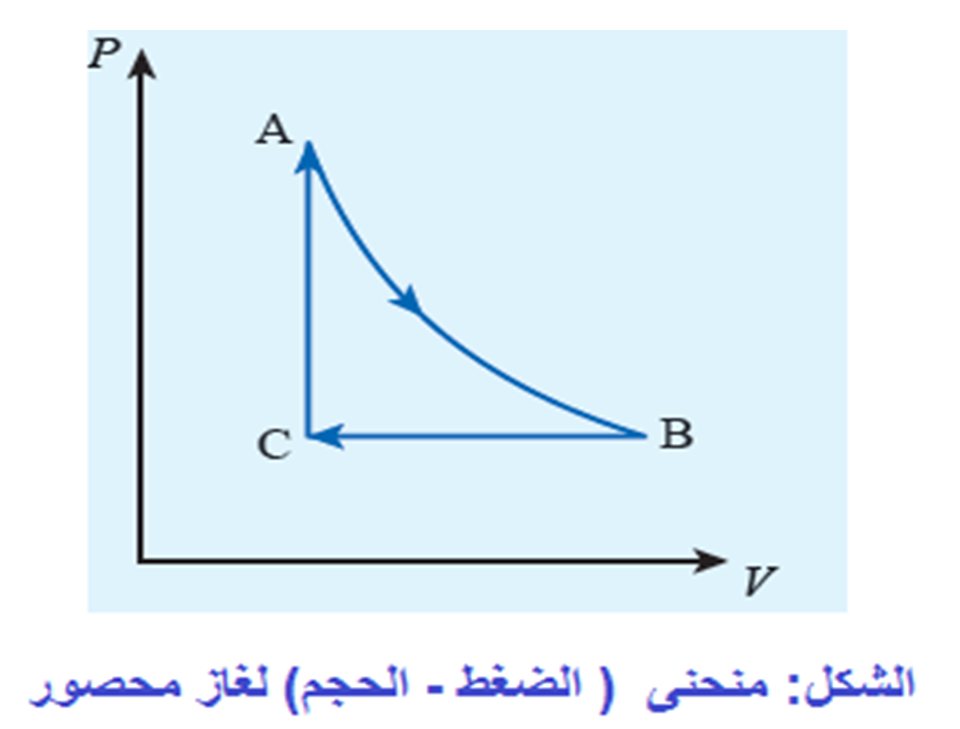
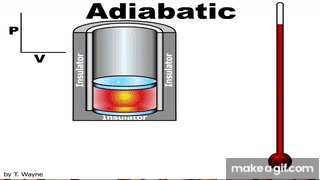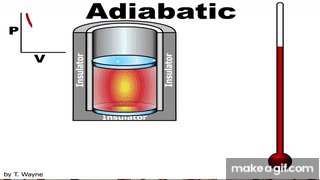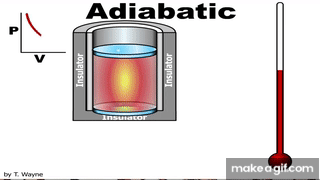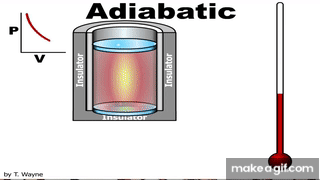
العملية الكاظمة Adiabatic process للطاقة بين النظام ومحيطه على شكل حرارة؛ أي إن Q = 0 . ويمكن تحقيقهذه العملية باستخدام نظام معزول حراريا، أو بتنفيذ العمليةبسرعةبحيث لا يوجد وقت كاف لحدوث تبادل للطاقة على شكل حرارة مع المحيط الخارجي، أطبق القانون الأول في الديناميكا الحرارية على عملية كاظمة لأحصل على المعادلة: حرارية كاظمة، يكون W > 0 ، و ΔU > 0 ، فتزداد درجة حرارة الغاز. أما إذا تمدد الغازفي عملية حرارية كاظمة فستنخفضدرجة حرارته، ومثال ذلك النفخ السريع لبالون باستخدام أسطوانة مملوءة بالهواء أو غاز. للعمليات الحرارية الكاظمة أهمية كبيرة في التطبيقات الهندسية، ومنها: تمدد الغازات الساخنة في محرك الاحتراق الداخلي، وتسييل الغازات (تحويلهاإلى الحالة السائلة) في نظام التبريد، وشوط ضغط الوقودفي محرك الديزل. |
العملية عند ضغط ثابت Isobaric process الضغط. ويمكن تحقيق شروط العملية الحرارية عند ضغط ثابت في العملية الموضحة في الشكل بجعل المكبس حر الحركة، بحيث يكون دائما في حالة اتزان؛ أي إن قوة ضغط الغاز المؤثرة في المكبس إلى أعلى تساوي وزن المكبس وقوة ضغط الهواء الجوي المؤثرة فيه إلى أسفل. ومن الأمثلة على العمليات الحرارية عند ضغط ثابت، متبوعة بعملية عندحجم ثابت. وشغل المحيط الخارجي (القوة الخارجية) المبذول على غاز عند ضغطه يساوي عدديا المساحة المحصورة بين منحنى (الضغط - الحجم) ومحور الحجم. وكذلك عملية عند حجم ثابت، متبوعة بعملية عند ضغط ثابت. عادة، لا يساوي مقدار كل من الحرارة والشغل المبذول على الغاز صفرا في مثل هذه العملية؛ لذا، يستخدم القانون الأول في الديناميكا الحرارية في صورته العامة. ويعطى مقدار الشغل المبذول على الغاز في هذه العملية بالعلاقة: W = -PΔV = -P(Vf - Vi) حيث يكون ضغط الغاز ( P) ثابتا في أثناء هذه العملية |
||||
 |
|
||||
|
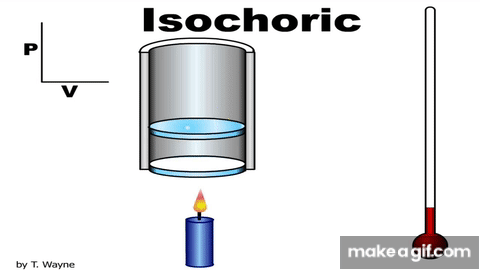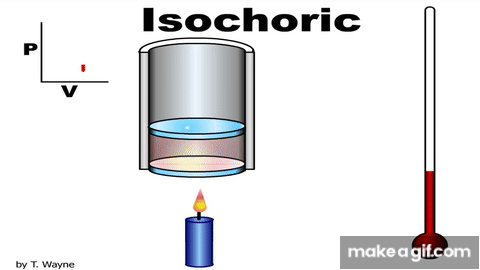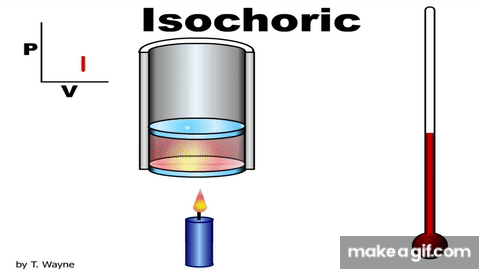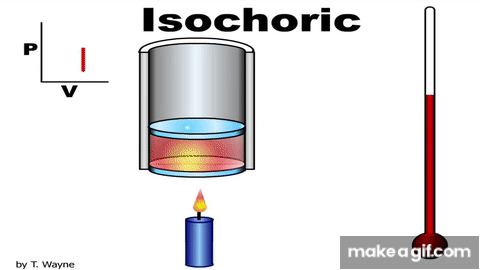
Isovolumetric processالعملية عند حجم ثابت ثبات الحجم.إن تثبيت المكبس عند موق معين، يضمن حدوث هذه العملية.ومن الأمثلة على العمليات عند حجم ثابت متبوعة بعملية عندضغط ثابت. وعند ضغط ثابت، العملية عند حجمثابت. وشغل المحيط الخارجي (القوة الخارجية) المبذول على غاز عند ضغطه يساوي عدديا المساحةالمحصورة بين منحنى(الضغط - الحجم) ومحور الحجم. يتغير حجم الغاز في هذه العملية؛ لذا، فإن الشغل المبذول يساوي صفرا؛ W = -PΔV . وأستخدم القانون الأول في الديناميكا الحرارية للتوصل إلى أن: ΔU = Q تبين هذه العلاقة أنه إذا أضفت طاقة إلى نظام ذي حجم ثابت، فإن الطاقة المنتقلة تبقى في النظام على شكل زيادة في طاقته الداخلية. |
العملية عند درجة حرارة ثابتة Isothermal process درجة الحرارة. ويمكن تنفيذ هذه العملية عن طريق غمر أسطوانة في حمام ماء وجليد،أو عن طريق وضع الأسطوانة في حالة اتصال حراري مع مستودع طاقة ذي درجة حرارة ثابتة. ونظرا إلى أن درجة الحرارة لا تتغير في العملية عند درجة حرارة ثابتة لغاز مثالي؛ فإن: ΔU = 0 . وأستنتج من القانون الأول في الديناميكا الحرارية أن الطاقة المنتقلة ( Q) يجب أن تساوي سالب الشغل المبذول على الغاز في العملية عند درجة حرارة ثابتة؛ أي إن Q = -W . إذ إن أي طاقة تدخل إلى النظام على شكل حرارة تنتقل إلى خارج النظام على شكل شغل؛ لذا، لا تتغير الطاقة الداخلية للنظام في هذه العملية. |
||||
|
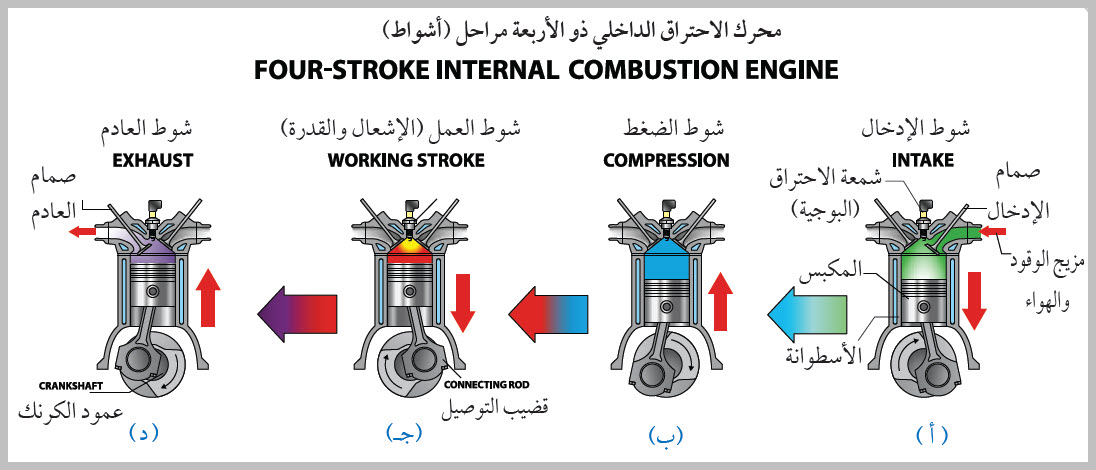
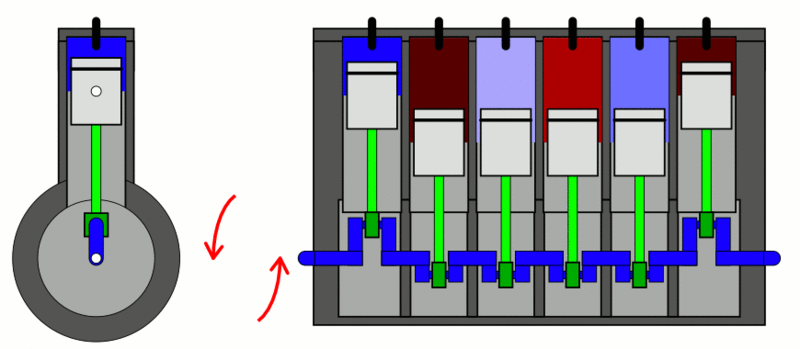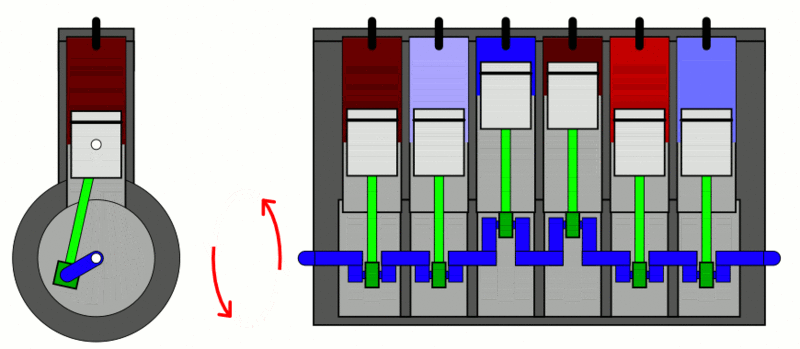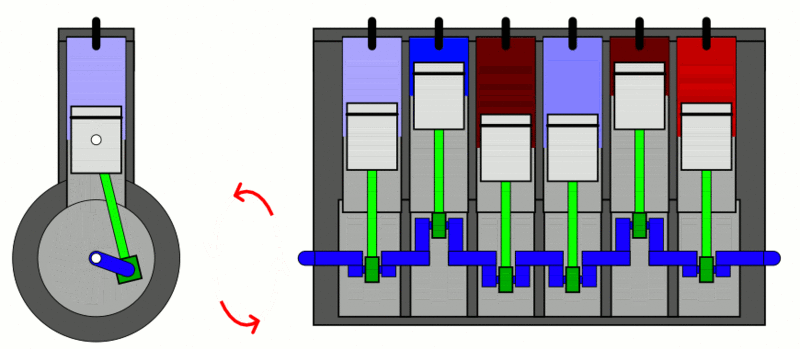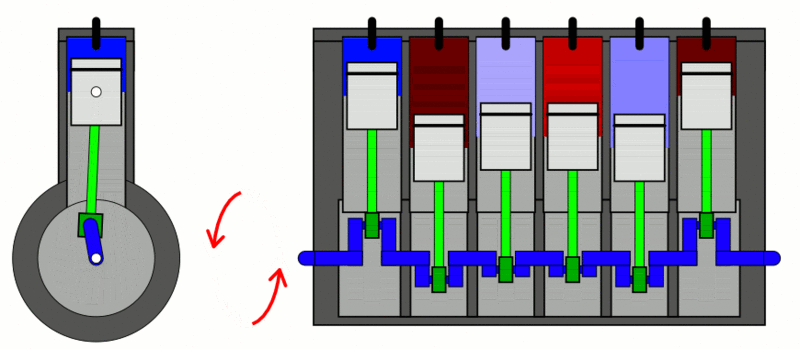
تطبيق: محرّك الاحتراق الداخلي Internal combustion engine
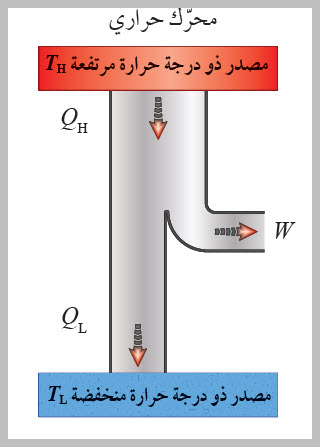
الحرارة إلى شغل ميكانيكي. كما ُيعد أيضا مثالا على العمليات الدورية Cyclic process ؛ وهي العملية التي يعود فيها النظام في مرحلته النهائية إلى الحالة الابتدائية نفسها عند بدء العملية من دون تغير الطاقة الداخلية للنظام؛ أي إن ΔU = 0 في العملية الدورية. وتبذل المحركات الحرارية الشغل عن طريق اكتساب الحرارة ( QH ) من مصدر حراري ذي درجة حرارة مرتفعة (TH)، وتحول جزء منها إلى شغل ميكانيكي مفيد، وتصرف جزء منها إلى مستودع حراري ذي درجة حرارة منخفضة ( TL ). أنظر إلى الشكل الذي يوضح رسما تخطيطيا لمحرك حراري، ويكون مقدار مجموع الشغل المبذول مساوًيا الفرق بين الطاقة المكتسبة من المصدر الحراري والطاقة المصرفة إلى المستودع الحراري؛ أي إن: . (W = QH - QL) شوط الإدخال؛ إذ يدخل مزيج من بخار البنزين والهواء عن طريق صمام الدخول إلى الأسطوانة بوساطة حركة المكبس إلى أسفل. شوط الضغط؛ إذ يبذل المكبس شغلا في عملية حرارية كاظمة عند ضغطه مزيج البنزين والهواء في الأسطوانة، شوط العمل (الإشعال والقدرة)؛ إذ تطلق شمعة الاحتراق شرارة عند لحظة الانضغاط القصوى فيحترق مزيج البنزين والهواء ويحدث الانفجار داخل الأسطوانة، ويؤدي تحول الطاقة الكيميائية المختزنة في النظام إلى طاقة حرارية إلى زيادة طاقته الداخلية وارتفاع درجة حرارته، فتتمدد الغازات ذات الضغط المرتفع الناتجة من الاحتراق، وتدفع بسرعة كبيرة مكبس الأسطوانة إلى الخارج باذلة شغلا على المحيط الخارجي، وتدور عمود الكرنك الذي يعمل على تحويل الحركة الخطية للمكابس إلى حركة دورانية للإطارت والمحاور المتصلة بها. ولا يستفاد من كامل الطاقة الحرارية الناتجة من الاحتراق في بذل شغل مفيد؛ إذ ينتقل جزء منها عبر جدران الأسطوانة، وينتقل جزء آخر أكبر مع الغازات الساخنة التي تطرد عن طريق عادم المركبة، ثم يدخل مزيج جديد من الوقود والهواء عبر صمام الدخول إلى الأسطوانة، وتتكرر هذه الدورة مئات المرات في الدقيقة، وتتحول الطاقة الحرارية الناتجة من احتراق الوقود إلى طاقة ميكانيكية؛ فتتحرك المركبة. |
 |
||||
|
يبذل غاز في ثلاجة شغلا مقداره ( 140 J ) في أثناء تمدده، فتنخفض طاقته الداخلية بمقدار ( 115 J ). أحسب مقدار الطاقة التي جرى تبادلها مع الغاز على شكل حرارة. الشغل المبذول على الغاز يساوي سالب الشغل الذي يبذله الغاز: أي إن W = - 140 J . والطاقة الداخلية انخفضت فيكون التغير فيها سالبا. |
|||||
|
أدخل مزيج من البنزين والهواء إلى أسطوانة محرك احتراق داخلي. إذا حرك مكبس الأسطوانة إلى الحل بداية، أحسب الشغل المبذول على الغاز في أثناء ضغطه، مع مراعاة أّنها عملية عند ضغط ثابت. بما أن إشارة ( Q) سالبة؛ فإن النظام فقد طاقة.
|
|||||
|
كتلة ثابتة من غاز محصور في أسطوانة معزولة حرار يا ومغلقة بمكبس حر الحركة. ازداد حجم الغاز من (2.1x10-3m3 ) إلى ( 2.4x10-3m3 ) عند ضغط ثابت مقداره ( 1.38x105Pa ).أحسب مقدار ما يأتي: أ . الشغل الذي بذله الغاز في أثناء تمدده. ب. التغير في الطاقة الداخلية للغاز. الحل :أ. أحسب بداية الشغل المبذول على الغاز من المحيط الخارجي في أثناء تمدد الغاز عند ضغط ثابت . Wgas=-W = 41.4 J :ب. النظام معزول حراريا عن المحيط الخارجي؛ لذا، لا يكتسب طاقة على شكل حرارة ولا يفقدها؛ أي إن Q = 0 . ثم أحسب مقدار التغير في الطاقة الداخلية للنظام؛ باستخدام القانون الأول في الديناميكا الحرارية. |
|||||
|
حل تمرين صفحة( 159 ) 1. تنخفض الطاقة الداخلية لغاز في إحدى أسطوانات محرك احتراق داخلي بمقدار ( 200J )، عند بذله شغلا مقداره ( 50ـ). ُ أجيب عما يأتي: أ. أحسب مقدار الطاقة التي جر ى تبادلها مع الغاز على شكل حرارة. ب. أحلل: هل ُ زود الغاز بهذه الطاقة أم فقدها؟ الحل: أ. الشغل المبذول على الغاز يساوي سالب الشغل الذي يبذله الغاز: أي أن والداخلية انخفضت فيكون التغير فيها سالباً . ب. فقط الغاز طاقة لأن ( Q ) سالبة.
2. أسطوانة مملوءة بغاز حجمه ( 3L )، ومغمورة في حمام مائي فيه ماء وجليد بدرجة ( 0oC). سحبت هدى مكبس الأسطوانة للخارج ببطء بحيث أصبح حجم الغاز ( 10L ) وضغطه ( 2.25x105Pa )، وبذل الغاز شغ ً لا مقداره ( 2.7x103J). أجيب عما يأتي: ب. ما مقدار الطاقة التي جر ى تبادلها مع الغاز على شكل حرارة؟ ج. إذا ضغطت هد مكبس الأسطوانة إلى الداخل ببطء لإرجاع الغاز إلى حجمه الابتدائي بعملية عند ضغط ثابت ( 2.25x105J ) ؛ فما مقدار الشغل المبذول على الغاز؟ الحل: أ. تمت العملية عند درجة حرارة ثابتة ( 0oC ) عندها يكون التغير في الطاقة الداخلية يساوي صفر( ) ب. بداية: الشغل المبذول على الغاز :
بالتالي: مقدار الطاقة التي جرى تبادلها مع الغاز على شكل حرارة:
بما أن Q موجبة فإن النظام اكتسب طاقة حرارية. ج. بما أن العملية تمت عند ضغط ثابت، فإن الشغل المبذول على الغاز يكون:
|
|||||
|
القانون الثاني في الديناميكا الحرارية The Second Law of Thermodynamics يبين القانون الأول في الديناميكا الحرارية أن التغير في الطاقة الداخلية لنظام يمكن أن يحدث نتيجة انتقال الطاقة عن طريق الحرارةأو الشغل أو كليهما، وهو لا يمانع تحول الطاقة المكتسبة كاملة إلى شغل. فمثلا، لا يمانع القانون الأول في الديناميكا الحرارية تصميم محرك حراري (آلة تعمل بطريقة دورية) يكتسب الطاقة عن طريق الحرارة، ويطرد كمية مساوية من الطاقة عن طريق بذله شغلا. إضافة إلى ذلك، فقد درست أن القانون الأول في الديناميكا الحرارية يعد تعبيرا عن حفظ الطاقة، وهو لا يميز بين العمليات التي تحدث تلقائيا، والعمليات التي لا تحدث تلقائيا؛ إذ إن أنواعا معينة فقط من عمليات تحويل الطاقة وعمليات نقلها تحدث في الطبيعة، على الرغم من وجود عمليات كثيرة تكون الطاقة محفوظة فيها ولكنها لا تحدث في الطبيعة. أما القانون الثاني في الديناميكا الحرارية فيشير إلى أنه يستحيل تصميم محرك حراري يكتسب الطاقة عن طريق الحرارة، ويطرد كمية مساوية من الطاقة عن طريق بذله شغلا، كما أنه يحدد العمليات التي تحدث تلقائيا، والعمليات التي لا تحدث تلقائيا. ومن الأمثلة على العمليات التي لا تتناقض مع القانون الأول في الديناميكا الحرارية إذا حدثت في أي من الاتجاهين، ولكنّها تحدث تلقائيا في الطبيعة في اتجاه واحد فقط: أنه عندما أضع جسمين مخلتفين في درجة الحرارة في حالة اتصال حراري معا؛ فإن صافي الطاقة المنتقلة على شكل حرارة يكون دائما من الجسم الأعلى درجة حرارة إلى الجسم الأدنى درجة حرارة، ولن يحدث العكس تلقائيا، على الرغم من تحقق قانون حفظ الطاقة فيها لو حدثت. وتسمى عملية غير عكسية؛ وهي العملية التي تحدث بشكل طبيعي في اتجاه واحد فقط، وحدوثها في الاتجاهين يتناقض مع القانون الثاني في الديناميكا الحرارية. إذن: يوضح القانون الثاني في الديناميكا الحرارية العمليات التي تحدث تلقائيا في الطبيعة والعمليات التي لا يمكن أن تحدث تلقائيا، وقد صاغ العالم كلاوسياس Clausius هذه العبارة كما يأتي: تنتقل الطاقة تلقائيا من الجسم الأعلى درجة حرارة إلى الجسم الأدنى درجة حرارة، ولا يمكن أن تنتقل تلقائيا في الاتجاه المعاكس . كما تكمن أهمية القانون الثاني في الديناميكا الحرارية، في إشارته إلى محدودية كفاءة المحركات الحرارية، أعرَّف كفاءة ( Efficiency (e محرك حراري بأنها تساوي النسبة المئوية لصافي الشغل الذي يبذله المحرك خلال دورة واحدة (W = QH - QL) إلى الطاقة المدخلة إليه من المصدر الحراري ذي درجة الحرارة المرتفعة ( QH ) خلال الدورة نفسها: تكون كفاءتها دائما أقل من % 100 . فمثلا، كفاءة محرك البنزين تقارب % 20 ، بينما تتراوح كفاءة محركات الديزل من % 35 إلى % 40 . أيضا، توضح المعادلة السابقة أن كفاءة المحرك الحراري تساوي 100% فقط إذا كانت QL = 0 ؛أي إنه لا توجد طاقة تطرد إلى مستودع الطاقة البارد، ويكون المحرك الحراري مثاليا في هذه الحالة، وهذا غير ممكنفي الواقع. ويمكن صياغة القانون الثاني في الديناميكا الحرارية حسب نموذج كلفن بلانك كما يأتي: من المستحيل بناء محرك حراري يعمل بطريقة دورية، يكون تأثيره الوحيد اكتساب الطاقة من مستودعطاقة، وتحويلها كاملة إلى شغل . أستنتج مما سبق، أنه في أثناء تشغيل محرك حراري، لا يمكن أن يكون W مساويا ل QH ، وأن بعض الطاقة QL يجب طرحه إلى المحيط الخارجي. |
|||||




 مثال محلول
مثال محلول