التحليل الكهربائي Electrolysis
تنتج الخلايا الجلفانيّةُ تيارًا كهربائيًّا بسبب حدوث تفاعل تأكسد واختزال تلقائي فيها،
وَيُستفادُ منها كمصدر للطاقة في تشغيل العديد منَ الأجهزة الكهربائيّة،
بينما هناك تفاعلاتُ تأكسد واختزال لا تحدث بشكل تلقائي، ويتطلَّبُ حدوثُها تزويدَها بطاقة كهربائيّة من مصدر خارجي،
عندها تُسَمّى الخليّةُ المستخدمةُ خليّةَ تحليل كهربائي .
وَتُسَمّى عمليّةُ إمرار تيار كهربائي في مصهور أو محلول مادَّةٍ كهرليّة؛ ممّا يؤدّي إلى حدوث تفاعل تأكسد واختزال، عمليّةَ التحليل الكهربائي ،
ويكون جهد هذه الخليّة سالبًا. ولعمليّة التحليل الكهربائي أهميّةٌ كبيرة؛ فمن خلالها تُشحَنُ البطّاريات،
وَتُستعمَلُ في استخلاص العديد منَ الفِلِزّات النشطة من مصاهيرها، كالصوديوم والألمنيوم، وَتُستخدَمُ في تنقية الفِلِزّات والطِّلاء الكهربائي لبعضها،
سواء لحمايتها منَ التآكل أو لإكسابها مظهرًا جميلً، كما في الشكل ( 14 ).
فَمِمَّ تتكوَّنُ خليّة التحليل الكهربائي؟ وما آليّةُ عملها؟
وهل تختلفُ نواتج التحليل الكهربائي لمصهور المادَّة عن محلولها؟
هذا ما سيجري تَعَرُّفُهُ في هذا الدرس.
التحليل الكهربائي لمصهور مادَّة كهرليّة Electrolysis of Molten Eelectrolyte
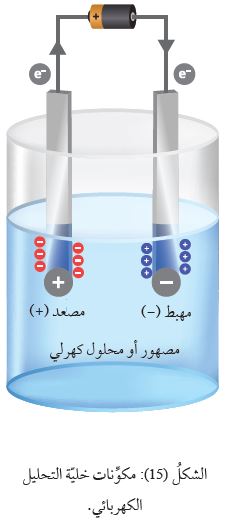
تتكوَّنُ خليّةُ التحليل الكهربائي من وعاء يحتوي على مصهور مادَّة أيونيّة، وأقطاب خاملة منَ الجرافيت أو البلاتين، وبطّاريّة وأسلاك توصيل؛
حيث يُوصَلُ أحدُ الأقطاب بقطب البطّاريّة السالب، وَيُسَمّى المِهبط،
بينما يَتَّصِلُ القطبُ الآخر بقطبها الموجب، وَيُسَمّى المِصعد، كما في الشكل ( 15 ).
يحتوي مصهورُ المادَّة الأيونيّة على أيونات موجبة وسالبة، وعند إمرار تيار كهربائي فيه تتحرَّكُ الأيوناتُ باتجاه الأقطاب المخالفة لها في الشحنة؛
حيث تتحرَّكُ الأيوناتُ الموجبة باتجاه القطب السالب (المِهبط) وتُختَزَل،
أمّا الأيوناتُ السالبة فتتحرَّكُ باتجاه القطب الموجب (المِصعد) وتتأكسد،
ومن ثَمَّ فإنَّ التفاعل الذي يحدث في الخليّة غير تلقائي؛ لِذا يجب أن يكون جهدُ البطّاريّة المُستخدَمَةِ لإحداثه أكبرَ من جهد الخليّة.
التحليل الكهربائي لمصهور NaCl
يحتوي مصهورُ NaCl على أيونات +Na و -Cl ،كما هو موضح في المعادلة الآتية:
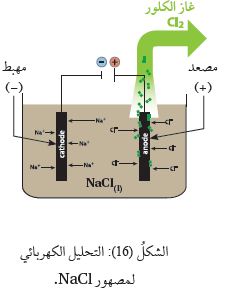
ويبيِّنُ الشكلُ (16) خليّة التحليل الكهربائي لمصهور NaCl ؛
حيث يُلاحظُ أنه عند إغلاق الدارة الكهربائيّة ومرور تيّار كهربائي عبرَ الأسلاك تتحرَّكُ أيوناتُ الصوديوم +Na باتجاه المِهبط،
وتحدث لها عمليّة اختزال، وتتكوَّنُ ذرّاتُ الصوديوم، كما في المعادلة الآتية:
نصف تفاعل الاختزال /مِهبط: (Na+(aq) + e- → Na(l
أمّا أيوناتُ الكلوريد -Cl فتتحرَّكُ باتجاه المِصعد؛ حيث تتأكسد مكوِّنَةً غازَ الكلور، كما في المعادلة الآتية:
نصف تفاعل التأكسد/ مِصعد: -2Cl-(l) → Cl2(g) + 2e
ويمكنُ حسابُ جهد الخليّة المعياري بالرُّجوع إلى الجدول ( 2)، ومعرفة قِيَمِ جهود الاختزال المعياريّة، كالآتي:
Na+(aq) + e- Na(l) E°Na = - 2.71 V
Cl2(g) + 2e- 2Cl-(aq) E°Cl2 = 1.36 V
ثمَّ أحسبُ جهدَ الخليّة المعياري:
E°cell = E°Na(cathode) - E°Cl2(anode)
E°cell = -2.71 – 1.36 = -4.07 V
يُلاحظُ أنَّ جهدَ الخليّة المعياري للتفاعل سالب؛ ما يعني أنَّ التفاعلَ غيرُ تلقائي،
وأنه يحدثُ بسبب تزويد الخليّة بفرق جهد كهربائي منَ البطّاريّة يزيد على جهد الخليّة المعياري؛ أي أكبر من ( 4.07V).
وَتُستخدَمُ عمليّةُ تحليل مصهور NaCl كهربائيًّا لاستخلاص الصوديوم صناعيًّا،
كما تُستخلَصُ معظمُ الفِلِزّات النشطة، كالليثيوم والبوتاسيوم غالبًا، من مصاهير كلوريداتها بتحليلها كهربائيًّا.
أتحقَّق:
أُجيبُ عنِ الأسئلة الآتية المتعلِّقة بالتحليل الكهربائي لمصهور CaBr2 .
1- أكتبُ نصفَ تفاعل التأكسد ونصفَ تفاعل الاختزال في خليّة التحليل الكهربائي.
2 - أستنتجُ نواتجَ التحليل الكهربائي للمصهور.
3 - أتوقعُ جهدَ البطّاريّة اللازمَ لإحداث تفاعل التحليل الكهربائي للمصهور.
إجابة سؤال أتحقَّق:
1- معادلة الإنصهار: (l)-CaBr2(s) Ca2+(l) + 2Br
نصف تفاعل التأكسد: -2Br- → Br2 + 2e
نصف تفاعل الاختزال : Ca2+ + 2e- → Ca
2- نواتج التحليل الكهربائي: تكون الكالسيوم Ca عند المهبط، وتكون البروم Br2 عند المصعد.
3- E°cell = E°Ca(cathode) - E°Br2(anode)
E°cell = -2.76 – 1.07 = -3.83 V
جهد البطارية اللازم يزيد عن ( 3.83V )
التحليلُ الكهربائي لمحلول مادَّة كهرليّة Electrolysis of an Electrolyte Solution
يحتوي المحلولُ المائي للمادَّة الأيونيّة على الأيونات الموجبة والسالبة الناتجة عن تفكُّكها وعلى جُزيئات الماء؛
لذلك عند تحليل محلول مائي لمركَّب أيوني كهربائيًّا يُؤخَذُ بالحسبان حدوثُ تأكسدٍ للأيونات السالبة في المحلول أو لجُزيئات الماء،
وكذلك يمكن أن يحدث اختزالٌ للأيونات الموجبة أو لجُزيئات الماء في المحلول؛
لذلك قد تختلف نواتجُ عمليّة التحليل الكهربائي لمصهور مركَّب أيوني عنها لمحلوله،
فكيف يُتَنَبَّأُ بنواتج التحليل الكهربائي لمحاليل المركَّبات الأيونية؟
التحليلُ الكهربائي لمحلول يوديد البوتاسيوم KI
يتفكَّكُ يوديد البوتاسيوم في الماء، حَسَبَ المعادلة: KI(s) K+(aq) + I-(aq)
وعند تحليل محلول KI كهربائيًّا يُحتَمَلُ اختزالُ أيونات +K أو جُزيئات الماء عند المِهبط.
وبالرُّجوع إلى جهود الاختزال المعياريّة لكل منَ البوتاسيوم والماء:
K+(aq) + e- K(s) E°K = -2.92 V
2H2O(l) + 2e- H2(g) + 2OH-(aq) E°H2O = -0.83 V
يُلاحظُ أنَّ جهدَ اختزال الماء أعلى من جهد اختزال البوتاسيوم؛ أي أنَّ الماء أسهلُ اختزالً من أيونات البوتاسيوم +K؛ لذلك يُختزَلُ الماءُ،
حَسَبَ المعادلة:
2H2O(l) + 2e- → H2(g) + 2OH-(aq)
أمّا عند المِصعد فَيُحتَمَلُ تأكسدُ أيونات اليوديد -I أو جُزيئات الماء.
وبالرُّجوع إلى الجدول( 2) وكتابة أنصاف تفاعلات الاختزال المطلوبة وجهود الاختزال المعياريّة لكلٍّ منها:
O2(g) + 4H+(aq) + 4e- 2H2O(l) E° = 1.23 V
I2(s) + 2e- 2I-(aq) E° = 0.54 V
ألاحظ أن التفاعل العكسي في المعادلة الأولى يمثل تأكسد الماء، ويمثلُ في المعادلة الثانية تأكسد أيون اليوديد - I،
وبمعرفة أن جهدَ التأكسد المعياريّ = ( E°reduction -) لنصف التفاعل،
ومقارنة جهود التأكسد لكل منها أجد أنَّ جهدَ تأكسد الماء يساوي ( 1.23V-)،
أما جهدَ تأكسد اليود فيساوي( 0.54V-) أي أنَّ جهدَ تأكسد اليود أعلى من جهد تأكسد الماء؛
وبالتالي فإنَّه أسهلُ تأكسدًا منَ الماء؛ لِذا تتأكسدُ أيوناتُ اليوديد - I وينتجُ اليود I2 عند المِصعد.
نصف تفاعل التأكسد: -2I-(aq) → I2(s) + 2e
أمّا التفاعلُ الكُلي، فهو مجموعُ نصفَي تفاعل التأكسد والاختزال:
نصف تفاعل الاختزال: -2H2O(l) + 2e- → H2(g) + 2OH
التفاعل الكيميائي الكُلي: (2H2O(l) + 2I-(aq) → H2(g) + 2OH-(aq) + I2(aq
ويتفقُ ذلك معَ النتائج العمليّة لتحليل محلول KI كهربائيًّا؛
إذ يُلاحظُ تَكَوُّنُ اليود عند المِصعد وتصاعدُ غاز الهيدروجين عند المِهبط وَتَكَوُّنٌ محلول هيدروكسيد البوتاسيوم KOH ،
أنظرُ الشكل ( 17 ).
ويمكنُ حسابُ جهد الخليّة المعياري كالآتي:
E°cell = E°H2O(cathode) - E°I2(anode)
E°cell = -0.83 – 0.54 = - 1.37 V
أمّا جهدُ البطّاريّة اللازم لإحداث التفاعل، فيزيد على ( 1.37V).
التحليلُ الكهربائي لمحلول بروميد النحاس CuBr2
يتفكَّكُ بروميد النحاس في الماء، حَسَبَ المعادلة: CuBr2(s) Cu2+(aq) + 2Br-(aq)
وعند تحليل محلول CuBr2 كهربائيًّا يُحتَمَلُ اختزالُ أيونات +Cu2 أو جُزيئات الماء عند المِهبط.
وبالرُّجوع إلى جهود الاختزال المعياريّة لكلٍّ منَ النحاس والماء:
Cu2+(aq) + 2e- → Cu(s) E° = 0.34 V
2H2O(l) + 2e- → H2(g) + 2OH-(aq) E° = -0.83 V
يُلاحظُ أنَّ جهدَ اختزال النحاس أعلى منه للماء؛ لذلك تكونُ أيوناتُ النحاس +Cu2 أسهلَ اختزالً عند المِهبط؛
حيث يُلاحظ تَكَوُّنُ النحاس، أنظرُ الشكل ( 18 ).
أّما عند المِصعد فَيُحتَمَلُ تأكسدُ أيونات البروميد - Br أو جُزيئات الماء.
وبالرُّجوع إلى جدول ( 2) وكتابة أنصاف تفاعلات الاختزال المطلوبة وجهودالاختزال المعياريّة لكلٍّ منها: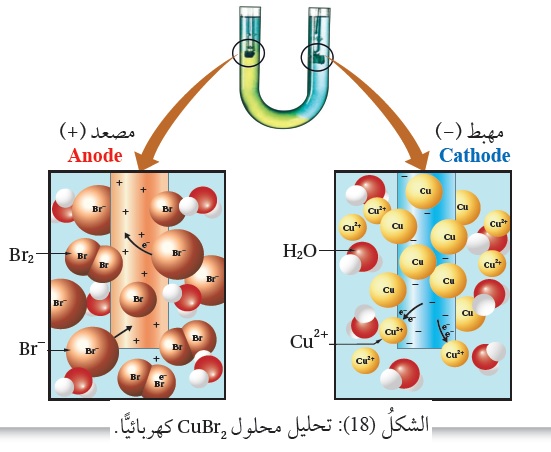
O2(g) + 4H+(aq) + 4e- 2H2O(l) E° = 1.23 V
Br2(l) + 2e- 2Br-(aq) E° = 1.07 V
ألاحظ أن التفاعل العكسي في المعادلة الأولى يمثل تأكسد الماء،
ويمثِّلُ في الثانية تأكسد أيون البروميد - Br ،
وعند مقارنة جهود التأكسد لكل من الماء والبروم أجد أنَّ جهدَ تأكسد الماء يساوي ( 1.23V- )،
أما جهدَ تأكسد البروم فيساوي (1.07V-) ، ألاحظ أنَّ جهدَ تأكسد البروم أعلى منه للماء،
ومن ثَمَّ فإنَّ أيونات البروميد -Br أسهلُ تأكسدًا؛ حيث يُلاحظُ تَكَوُّنُ البروم عند المِصعد حسب المعادلة:
نصف تفاعل التأكسد: -2Br-(aq) → Br2(l) + 2e
أمّا التفاعلُ الكلي، فهو مجموعُ نصفي تفاعل التأكسد والاختزال:
نصف تفاعل الاختزال: (Cu2+(aq) + 2e- → Cu(s
أمّا التفاعل الكيميائي الكُلي فهو: (Cu2+(aq) + 2Br-(aq) → Cu(s) +Br2(l
ويتفقُ ذلك معَ النواتج العمليّة لتحليل محلول CuBr2 كهربائيًّا؛
إذ يُلاحظُ تَكَوُّنُ البروم عند المِصعد وتكون النحاس عند المِهبط.
ويمكنُ حسابُ جهد الخليّة المعياري للتفاعل الكُلي كالآتي:
E°cell = E°cu(cathode) - E°Br2(anode)
E°cell = 0.34 – 1.07 = - 0.73 V
أي أنَّ جهدَ البطّاريّة اللازم لإحداث التفاعل يزيدُ على ( 0.37V ).
التحليلُ الكهربائي لمحلول كبريتات الصوديوم Na2SO4
تتفكَّكُ كبريتاتُ الصوديوم في الماء، حَسَبَ المعادلة:
Na2SO4(s) 2Na+(aq) + SO42-(aq)
وعند تحليل محلوله كهربائيًّا يُحتَمَلُ اختِزالُ أيونات الصوديوم +Na أو جُزيئات الماء عند المِهبط.
وبالرُّجوع إلى جهود الاختزال المعياريّة لكلٍّ منها:
Na+(aq) + e- → Na(s) E° = -2.71 V
2H2O(l) + 2e- → H2(g) + 2OH-(aq) E° = -0.83 V
يُلاحظُ أنَّ جهدَ اختزال الماء أعلى منه لأيونات الصوديوم؛ لذلك يكون أسهلَ اختزالً عند المِهبط؛
حيث يتكوَّنُ غازُ الهيدروجين وأيوناتُ الهيدروكسيد -OH .
أمّا عند المِصعد، فَيُحتَمَلُ تأكسدُ أيونات الكبريتات -SO42 أو جُزيئات الماء،
وقد لوحظَ عمليًّا تصاعدُ غاز الأكسجين عند المِصعد؛ ما يدلُّ على تأكسد جُزيئات الماء، حَسَبَ المعادلة:
نصف تفاعل التأكسد: -2H2O(l) → O2(g) + 4H+(aq) + 4e
أمّا التفاعلُ الكيميائي الكلي، فمجموع نصف تفاعل التأكسد ونصف تفاعل الاختزال وهو:
(2H2O(l) → 2H2(g) + O2(g
أي أنَّ ما حدث عند تحليل محلول كبريتات الصوديوم كهربائيًّا هو تحليل الماء كهربائيًّا؛
حيث تأكسدت جُزيئاتُ الماء واختُزِلَت مُكَوِّنَةً غازي الأكسجين والهيدروجين.
يُلاحظُ من دراسة الأمثلة السابقة لتحليل محاليل المركَّبات الأيونّية كهربائيًّا أنَّ الأيونات الموجبة وجُزيئات الماء يُحتَمَلُ أن تُختَزَلَ عند المِهبط،
وأنَّ الأيونات السالبة وجُزيئات الماء يُحتَمَلُ أن تتأكسدَ عند المِصعد،
وأنَّ التفاعلَ الذي يحدثُ يعتمدُ بشكل عام على جهود الاختزال المعياريّة لكلٍّ منهما،
كما أنَّ سلوك أيون معيَّن هو نفسُه خلالَ عمليّة التحليل الكهربائي بغضِّ النظر عن مصدره،
وأنَّ هناك بعض الأيونات متعدِّدة الذرات, مثل،(-SO42- ,NO3 )، لا تتأثرُ عند تحليل محاليلها كهربائيًّا.
إجابة سؤال أفكر: أفسر: دور كبريتات الصوديوم في عملية التحليل الكهربائي للماء.
الماء النقي غير موصل للتيار الكهربائي نظ ا ر للتركيز المنخفض جدا لأيونات +H و -OH فيه، لذلك
تستخدم كبريتات الصوديوم لتكوين محلول كهرلي يسمح بمرور التيار الكهربائي، وبالتالي إحداث
تفاعلي تأكسد واختزال غير تلقائيين تتنافس فيها الأيونات الموجبة وجزيئات الماء على الاختزال،
والأيونات السالبة وجزيئات الماء على التأكسد.
إجابة سؤال أفكر: أُفَسِّرُ، مستعينًا بالمعادلاتCuSO4عند تحليل محلول كهربائيًّا يَتَحَوَّلُ تدريجيًّا إلى محلول H2SO4.
إجابة السؤال: يتفكك CuSO4 في المحلول كما في المعادلة :
CuSO4(aq) → Cu2+ (aq) + SO42-(aq)
أيون -SO42 لا يتأكسد إنما يتأكسد الماء حسب المعادلة:
-2H2O(l) → O2(g) + 4H+(aq) + 4e
ينتج عن تأكسده الماء غاز الأكسجين وأيونات الهيدروجين +H فيزداد تركيز أيونات الهيدروجين في المحلول،
أما أيونات النحاس +Cu2 فإنها تختزل وتترسب عند المهبط لذلك يقل تركيزها في المحلول،
وبالتالي يتحول المحلول تدريجيا إلى محلولH2SO4
أتحقَّق:
أكتبُ تفاعلي المِصعد والمِهبط اللذين يحدثان عند تحليل محلول NiBr2 كهربائيًّا باستخدام أقطاب منَ الجرافيت.
إجابة سؤال أتحقق:
تفاعل المهبط: Ni2+(aq) + 2e- → Ni(s)
تفاعل المصعد: -2Br-(aq) → Br2(l) + 2e
التطبيقاتُ العمليّة للتحليل الكهربائي Application of Electrolysis
تعملُ خلايا التحليل الكهربائي على تحويل الطاقة الكهربائيّة إلى طاقة كيميائيّة من خلال استخدام تيّار كهربائي
يُجبِرُ تفاعلي تأكسد واختزال غير تلقائيين على الحدوث.
ولهذه الخلايا تطبيقاتٌ مهمّة في الصناعة، من مثل استخلاص الفِلِزّات النشطة من مصاهير خاماتها،
وتنقية الفِلِزّات لاستخدامها في المجالات التي تحتاج إلى فِلِزّات نقيّة بدرجة كبيرة. وَسُتُناقَشُ أمثلةٌ على كلٍّ منها.
استخلاصُ الألمنيوم Aluminum Extraction
يُعَدُّ الألمنيوم من أكثر الفِلِزّات انتشارًا في القشرة الأرضيّة، وهو منَ الفِلِزّات النشطة،
ويستخلص من خام البوكسيت Al2O3.2H2O بطريقة هول-هيروليت؛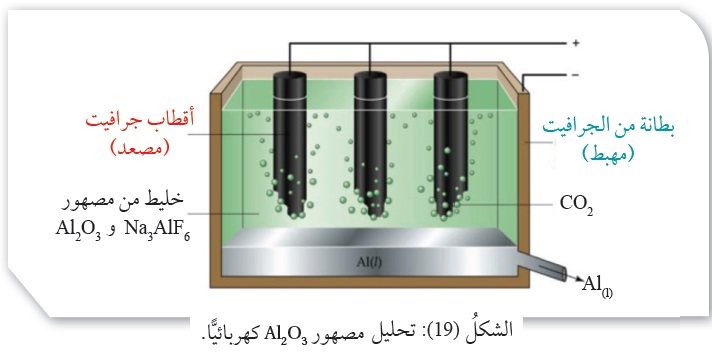
حيث يُعالَجُ الخامُ لتخليصه منَ الشوائب، ثمَّ يُسَخَّنُ لتحويله إلى أكسيد الألمنيوم
Al2O3 وَيُذابُ في مصهور الكريوليت Na3AlF6 فَتَنخَفِضُ درجةُ انصهاره نحوَ 1000°C .
وَتُسَمّى خليّةُ التحليل الكهربائي لمصهور Al2O3 خليّةَ هول- هيروليت،
وتتكوَّنُ منَ الداخل من طبقة منَ الجرافيت تمثلُ المِهبط، وسلسلةٍ من أقطاب
الجرافيت تُغمَسُ في المصهور تمثلُ المِصعد، أنظرُ الشكل ( 19 ).
وعند إجراء عمليّة التحليل الكهربائي يحدثُ اختزالٌ لأيونات الألمنيوم عند المِهبط،
ويتكوَّنُ الألمنيوم الذي يتجمَّعُ أسفلَ الخليّة؛ حيث يُسحَبُ من مَخرج خاصّ.
معادلة تفاعل المِهبط/ اختزال: (Al3+(l) + 3e- → Al(l
أمّا عند المِصعد، فتتأكسدُ أيوناتُ الأكسجين -O2 مُكَوِّنَةً غازَ الأكسجين، حَسَبَ المعادلة:
معادلة تفاعل المِصعد/ التأكسد: -2O2-(l) → O2(g) + 4e
ويتفاعلُ الأكسجينُ الناتج معَ أقطاب الجرافيت مُكَوِّنًا ثاني أكسيد الكربون، حَسبَ المعادلة :
(C(s) + O2(g) → CO2(g
ممّا يؤدي إلى تآكلها، فيجري تغييرُها بشكل دوري.
ويمكنُ تلخيصُ التفاعل الكُلي، الذي يحدثُ في الخليّة، بالمعادلة الآتية:
2Al2O3(l) + 3C(s) → 4Al(l) + 3CO2(g)
ونظرًا إلى أنَّ عمليّة استخلاص الألمنيوم تَستَهلِكُ كميّاتٍ هائلةً منَ الطاقة،
تُقام مصانعُ إنتاجه قريبًا من محطّات الطاقة الكهربائيّة لتوفير كُلفة نقل الطاقة،
كما يُرَكَّزُ بشكل كبير على عمليّة إعادة تدويره؛ إذ تبلغُ كميّةُ الطاقة اللازمة لإعادة التدوير نحوَ % 5 منَ الطاقة اللازمة لاستخلاصه من خام البوكسيت.
تنقيةُ الفِلِزّات Purification of Metals
تحتاج بعضُ استخدامات الفِلِزّات إلى أن تكون نقيّةً تمامًا. فمثلا، يجب أن يكون النحاسُ المُستخدَمُ في التمديدات الكهربائيّة نقيًّا؛
لِذا تُستخدَمُ عمليّةُ التحليل الكهربائي في تنقية الفِلِزّات، مثل النحاس، بعد عمليات استخلاصه من خاماته؛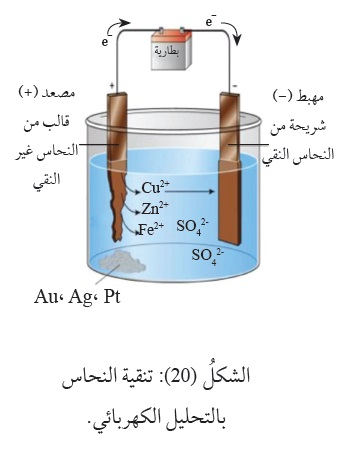
إذ يحتوي على شوائبَ،مثل الخارصين والحديد والذهب والفضّة والبلاتين. وحتى تتم تنقيته ،
يُشَكَّلُ النُّحاس غيرُ النَّقي على شكل قوالبَ تمثلُ المِصعد في خليّة التحليل الكهربائي،
وَيُوصَلُ المِهبطُ .بشريحة رقيقة منَ النحاس النقي،
ثمَّ يُغمَرانِ في محلول كبريتات النحاس CuSO4 وعند تمرير تيّار كهربائي في الخليّة تحدثُ التفاعلات الآتية:
تفاعل المِصعد/ تأكسد: -Cu(s) → Cu2+(aq) + 2e
تفاعل المِهبط/ اختزال: (Cu2+(aq) + 2e- → Cu(s
ومعَ استمرار تأكسد النحاس واختزاله تنتقلُ ذرّاتُهُ من المِصعد إلى المِهبط، أنظرُ الشكلُ ( 20 )،
وتتأكسد ذرّات الفِلِزّات (الشوائب) التي لها جهدُ اختزال أقلُّ منَ النحاس، كالخارصين والحديد، مُكَوِّنَةً أيونات +Zn2 و +Fe2 على الترتيب،
وتبقى هذه الأيونات ذائبة في المحلول، أمّا الذهب والفضّة والبلاتين فإنَّ جهدَ اختزالها أعلى منَ جهد الخلية المستخدم؛
لذلك لا تتأكسد ذرّاتُها، وتتجمَّعُ في قاع الخليّة، وتكونُ درجةُ نقاوة النحاس الناتج نحوَ % 99.9
الربطُ معَ الحياة شحنُ البطارية:
تَجمَعُ البطّارياتُ القابلةُ لإعادة الشحن بين كيمياء كلٍّ منَ الخلايا الجلفانيّة وخلايا التحليل الكهربائي. فعند استخدام الأجهزة المحتوية
عليها، مثل الهاتف الخلوي أو السيّارة الكهربائيّة، تُحَوَّلُ الطاقةُ الكيميائيّة إلى كهربائيّة؛ أي تعملُ كخليّة جلفانيّة، أما عند شحن البطاريّة فإنها تعملُ
كخليّة تحليل كهربائي تُحَوَّلُ الطاقةَ الكهربائيّة التي تزوَّدُ بها إلى كيميائيّة؛ حيث ينعكسُ اتجاهُ حركة الإلكترونات فيها، ويحدثُ التفاعلُ العكسيُّ
للتفاعل المنتج للتيار الكهربائيَّ في البطاريّة.
أتحقَّق:
1- أُفَسِّر. لا تُختَزَلُ أيوناتُ +Fe2 و +Zn2 ، التي توجد ذرّاتُها على شكل شوائبَ معَ النحاس، خلالَ عمليّة تنقيته بالتحليل الكهربائي.
2- أُفَسِّرُ، مستعينًا بمعادلات كيميائية، استبدالَ أقطاب الجرافيت المُستخدَمَةِ في خليّة هول - هيروليت بشكل دوري.
- أكتبُ معادلة التفاعل الكُلي الذي يحدثُ في بطّاريّة الرصاص الحِمضية خلالَ شحنها.
إجابة سؤال أتحقق:
1- لأن جهداختزال كل من الحديد (0.44V- ) والخارصين(0.76V-) أقل بكثير من جهد اختزال النحاس (0.34V )لذلك
يكون جهد البطارية المستخدمة في خلية تنقية النحاس أقل من جهد البطارية اللازم لاختزال أيونات +Fe2 أو +Zn2 ، لذلك لا تختزل.
2 - تشكل أقطاب الجرافيت المصعد في خلية هول-هيروليت حيث تتأكسد أيونات الأكسجين-O2 مكونة غاز الأكسجين،
يتفاعل الغاز مع أقطاب الجرافيت مكونا CO2 حسب المعادلات:
-O2- → O2 + 4e
C + O2 → CO2
مما يؤدي إلى تآكلها وبالتالي تغييرها بشكل دوري.
3. التفاعل الكلي خلال عملية شحن بطارية الرصاص الحمضية:
الإثراء والتوسع: تُستخدَمُ البطّارياتُ لتزويد أجهزة مختلفة بالطاقة؛ تشملُ السياراتِ والهواتفَ وأجهزةَ الحاسوب وغيرَها، وعندما تنفدُ
البطّاريّة أو تتلفُ تُرمى )يُستغنى عنها(، ويؤدّي ذلك إلى تراكم كميّات كبيرة منَ النُّفايات الخطرة؛ إذ تحتوي البطّارياتُ على موادَّ كيميائيّةٍ سامة
وفِلِزّات ثقيلة، ينتجُ عن تراكمها ودفنها مخاطرُ بيئيّة؛ فقد تسبِّبُ تلوُّثَ المياه والتربة، ومن هنا جاءت فكرةُ إعادة تدوير البطّاريات.
تدويرُ البطّاريات يعني معالجةَ نفاياتها؛ بهدف التقليل منها بِوَصفِها نفايات صُلبة، وإعادة استخدام مكوِّناتها مرَّةً أخرى.
إعادةُ تدوير بطّاريّة الرصاص الحِمضيّة
تُعَدُّ بطّاريات الرصاص الحِمضيّة من أقدم أنواع البطّاريات القابلة لإعادة الشحن في العالَم، ولإعادة تدويرها أهميّةٌ
كبيرة في صناعة الرصاص في الوقت الحاضر؛ حيث يمثلُ الرصاصُ المُعاد استخدامُهُ نحوَ % 47 من إجمالي الرصاص
المُستخدَم عالميًّا.
وتشملُ عمليّةُ إعادة تدوير بطّاريات الرصاص الحِمضيّة المُستخدَمة مراحل عدَّةٍ، هي:
التجميع: يُقصد به تجميعُ بطّاريات الرصاص المُستخدَمة، وغالبًا ما يكون ذلك لدى باعة البطّاريات، حيث تجمعها الشركاتُ التي تُعيدُ تدويرَها.
التكسير: تُفَكَّكُ البطّاريّةُ في منشأة إعادة التدوير، وَتُسحَقُ مكوِّناتُها باستخدام أدوات خاصّة، فتتحوَّلُ إلى شظايا.
الفرز: تتضمَّنُ هذه العمليّةُ فصلَ أجزاء بطّاريّة الرصاص الحِمضيّة بفرز المكوِّنات البلاستيكيّة والورقيّة عنِ الرصاص والفِلِزّات الثقيلة،
وسحب السائل الموجود فيها، يتبع ذلك سير كلِّ مادَّة في رحلة تدوير خاصّة بها؛ إذ تُغسَلُ القطعُ البلاستيكيّة وَتُجَفَّفُ ثمَّ تُرسَلُ إلى وحدة تدوير البلاستيك، حيث تُصهَرُ وَتُشَكَّلُ آليًّا على شكل كُرات من مادَّة البولي بروبلين، وتُستخدَمُ مرَّةً أخرى لإنتاج صناديق بطّاريات الرصاص الحِمضيّة، ويمكنُ استخدامُها في صناعة منتجات أخرى. أمّا ألواحُ الرصاصِ وأكسيدُهُ ومركَّباتُهُ الأخرى فَتُصهَرُ معًا في أفران الصَّهر، ثمَّ تُصَبُّ في قوالبَ وَتُزالُ الشوائبُ المعروفةُ باسم الخَبَث من فوق سطح مصهور الرصاص، وَتُترَكُ السبائكُ لتبردَ وتتصلَّب، ثمَّ تُرسَلُ إلى الشركات المُصَنِّعَةِ للبطّاريات، حيث تُستَخدَمُ في إنتاج ألواح جديدة منَ الرصاص وأكسيده. أمّا حِمض الكبريتيك، وهو المُكَوِّنُ السائلُ في البطّاريّة؛ فيجري التعاملُ مَعَهُ بطريقتين، أولاهما: مفاعلة الحِمض
معَ مركَّب كيميائي قاعدي؛ فينتج الملح والماء، ثمَّ يجري تجميعُ المياه الناتجة ومعالجتُها ضمن مواصفات محددة والتخلّصُ من الماء في شبكة الصرف الصحي، أمّا الطريقة الثانيةُ؛ فيجري فيها تحويلُ الحِمض إلىكبريتات الصوديوم Na2SO4 ، ثمَّ استخدامُهُ في صناعة منظِّفات الغسيل والزجاج والمنسوجات.