الخصائص الجامعة للمحاليل
1- الانخفاض في الضغط البخاري 2- الارتفاع في درجة الغليان 3- الانخفاض في درجة التجمد 4- الضغط الأسموزي
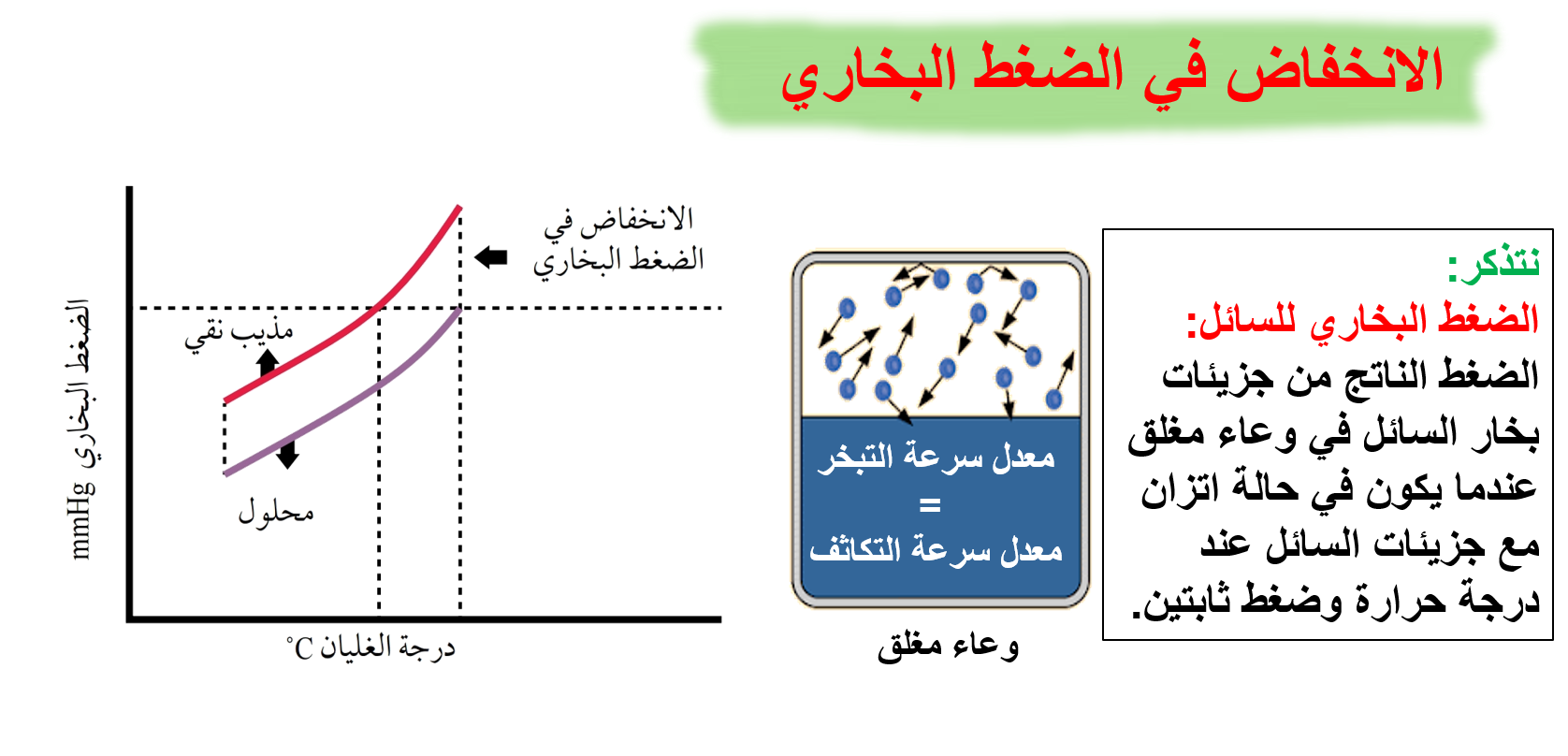

تحتل جزيئات المذاب جزءًا من سطح المذيب (الماء) فيقل عدد جزيئات المذيب عند السطح ويقل تبخرها، إضافة لنشوء تجاذب بين بعض جسيمات المذيب والمذاب وهذا يقلل أيضًا من عدد جسيمات المذيب التي بإمكانها أن تفلت من السطح لتتحوّل إلى الحالة الغازية.
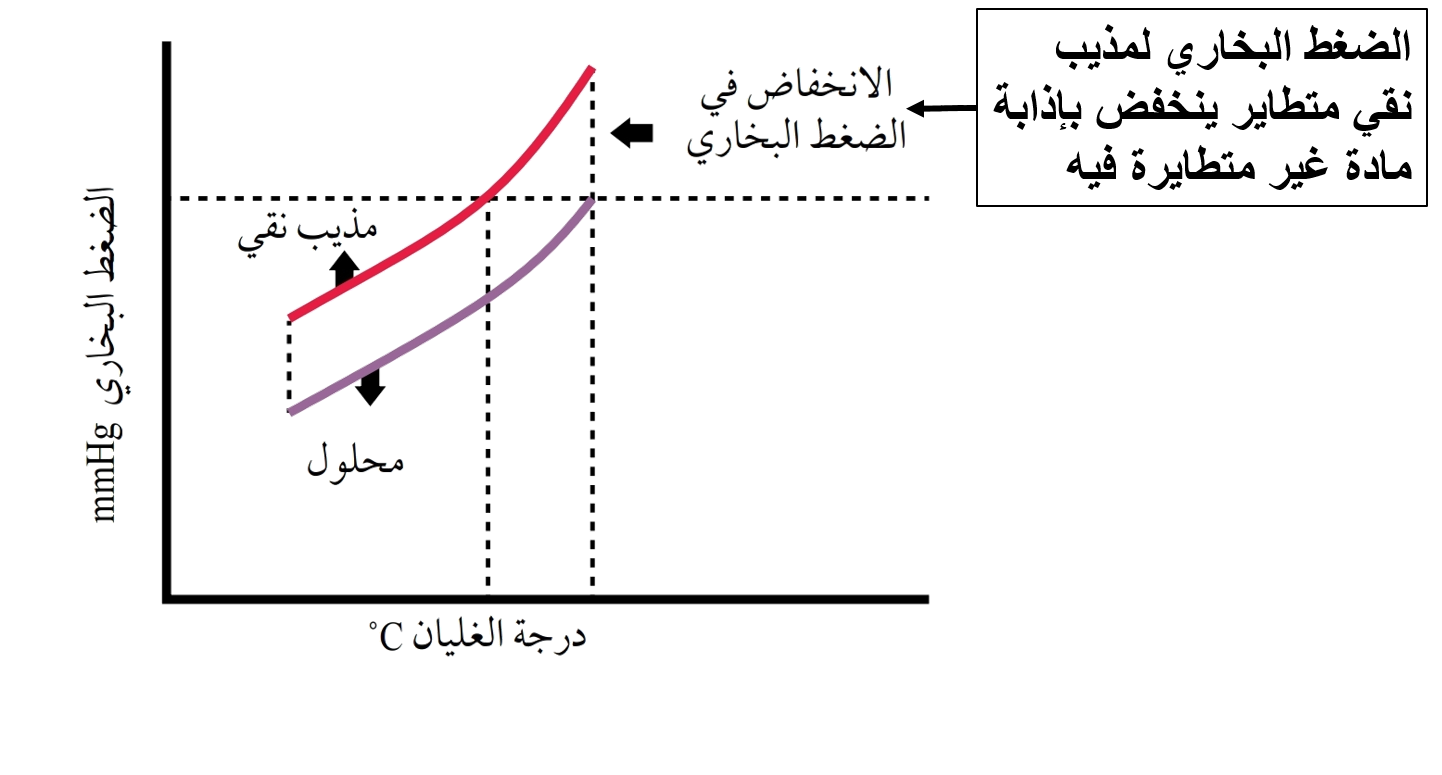
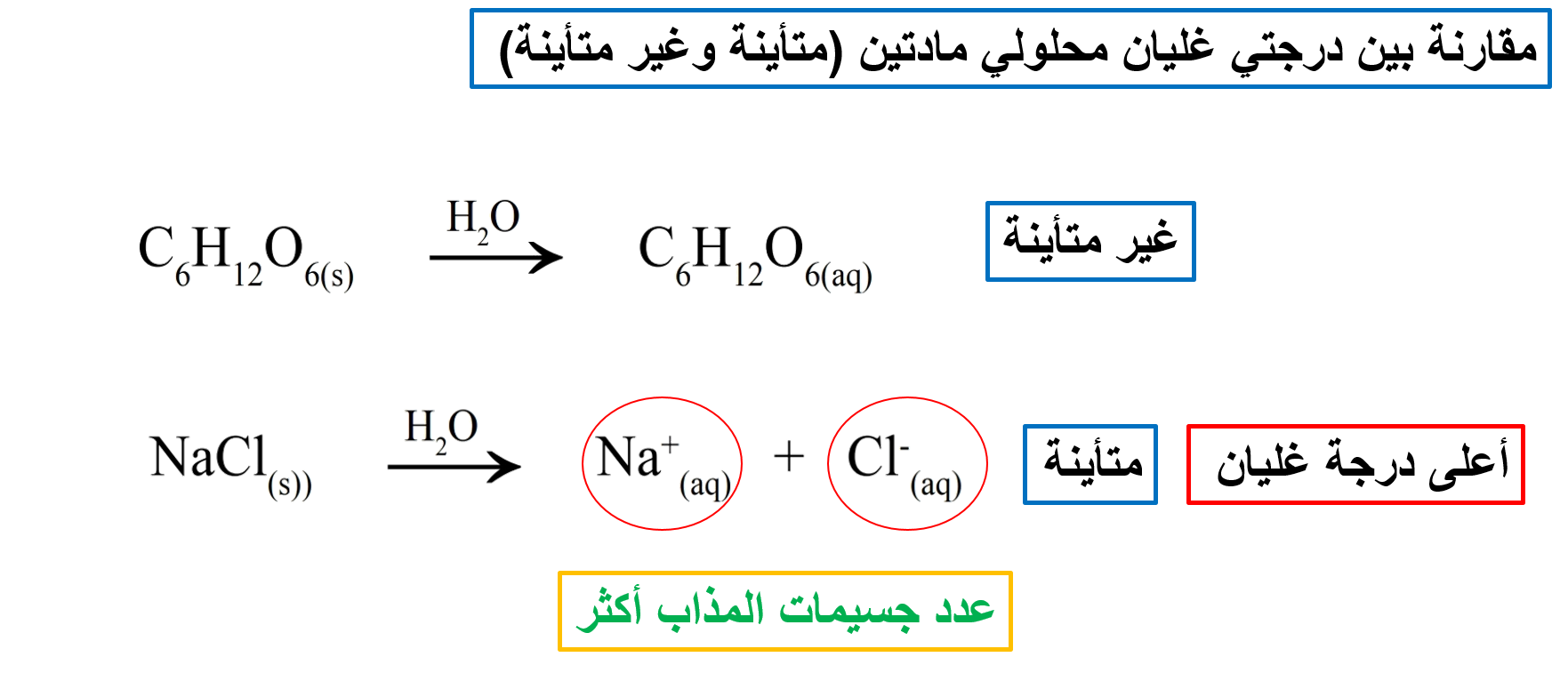
عند إذابة مادة غير متأينة وغير متطايرة في الماء يبدأ المحلول بالغليان على درجة حرارة أعلى من 100oC ، وهذا يدل على أن درجة غليان المحلول أعلى من درجة غليان المذيب النقي.
فكيف يتم تفسير ذلك؟
إن إضافة كمية من المذاب ستجعل عددًا من جزيئاته تحتل جزءًا من مساحة سطح المذيب، مما يقلل من جسيمات المذيب على السطح، إضافة إلى نشوء تجاذب بين بعض جسيمات المذيب والمذاب، وهذا أيضًا يقلل من عدد جسيمات المذيب التي يمكنها أن تفلت من السطح لتتحول إلى الحالة الغازية. وبالتالي يقل الضغط البخاري للمحلول، مما يتطلب زيادة درجة الحرارة، فتزداد درجة الغليان.
«الفرق بين درجة غليان المذيب النقي والمحلول»
ويرمز إليه بالرمز (Tb△)
ويتناسب طرديًا مع النسبة بين عدد جسيمات المذاب وجسيمات المذيب في المحلول.
vويعبّر عن الارتفاع في درجة الغليان بالصيغة الرياضية:

(Kb) = مقدار الارتفاع في درجة غليان المذيب عند إذابة 1mol من المذاب في Kg من المذيب النقي
لماذا تم استخدام التركيز المولاليّ؟
لأنه يعتمد على النسبة بين عدد جسيمات المذاب والمذيب، وليس على النسبة بين عدد جسيمات المذاب في حجم معين من المحلول.
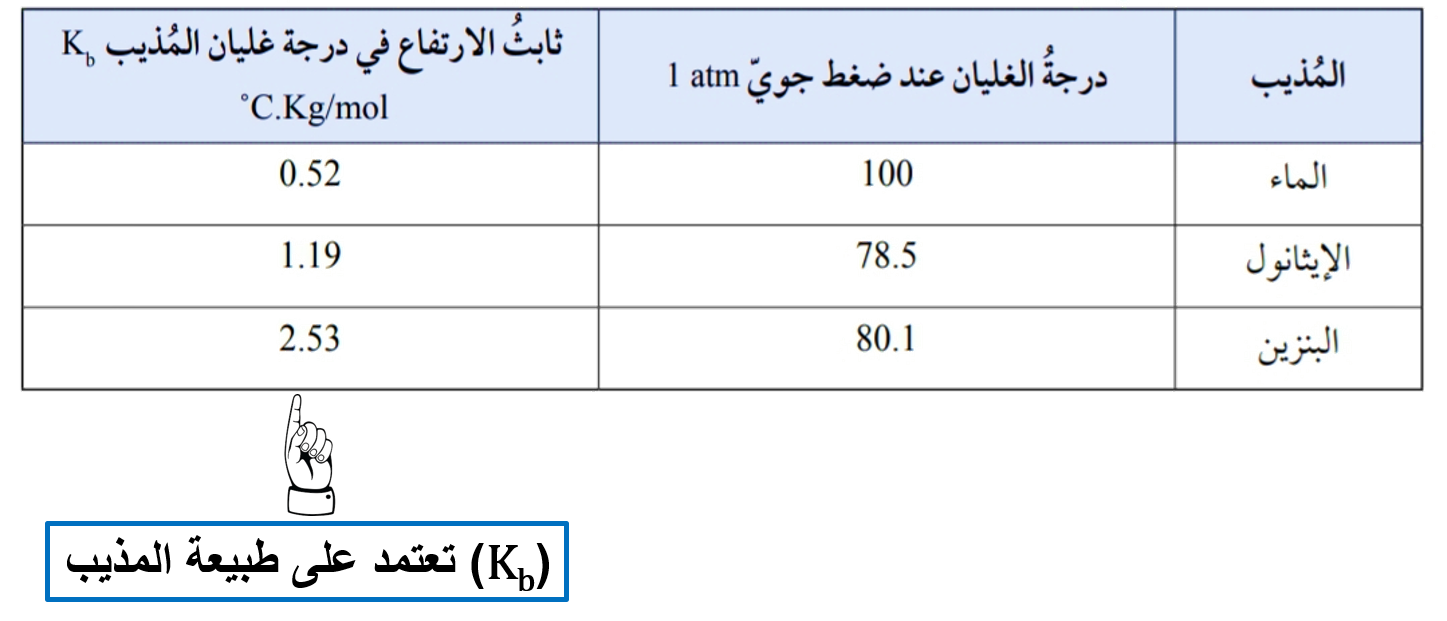
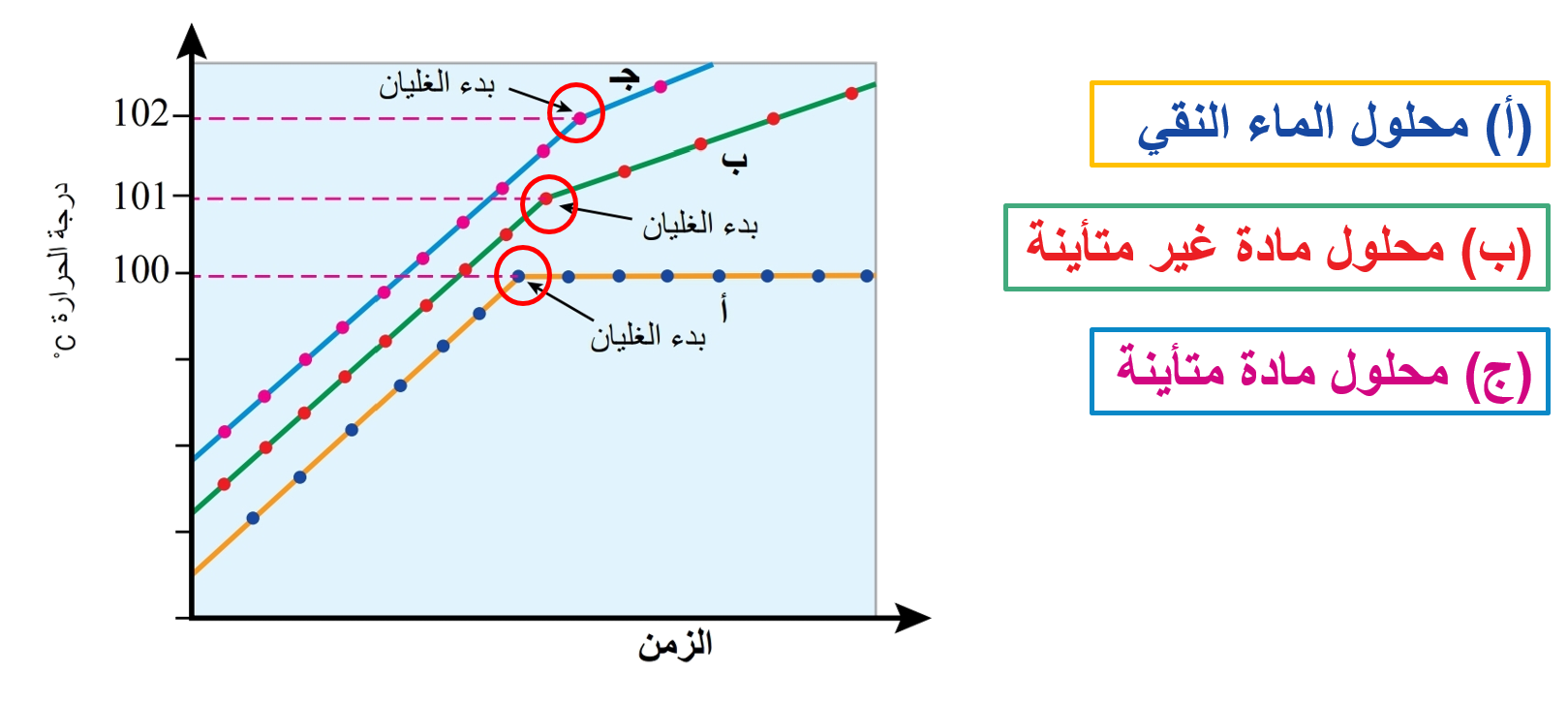
♦ إن درجة غليان المحلول لا تثبت في أثناء الغليان، بل تستمر في الارتفاع. فكيف يتم تفسير ذلك؟
يمكن تفسير هذا الارتفاع بأن عملية التبخر تؤدي إلى نقص كمية المذيب في المحلول، فيزداد تركيزه بمرور الوقت، ويقل بذلك عدد جسيمات المذيب القادرة على الإفلات من سطح السائل، كما يقل الضغط البخاري فتزداد درجة الغليان.

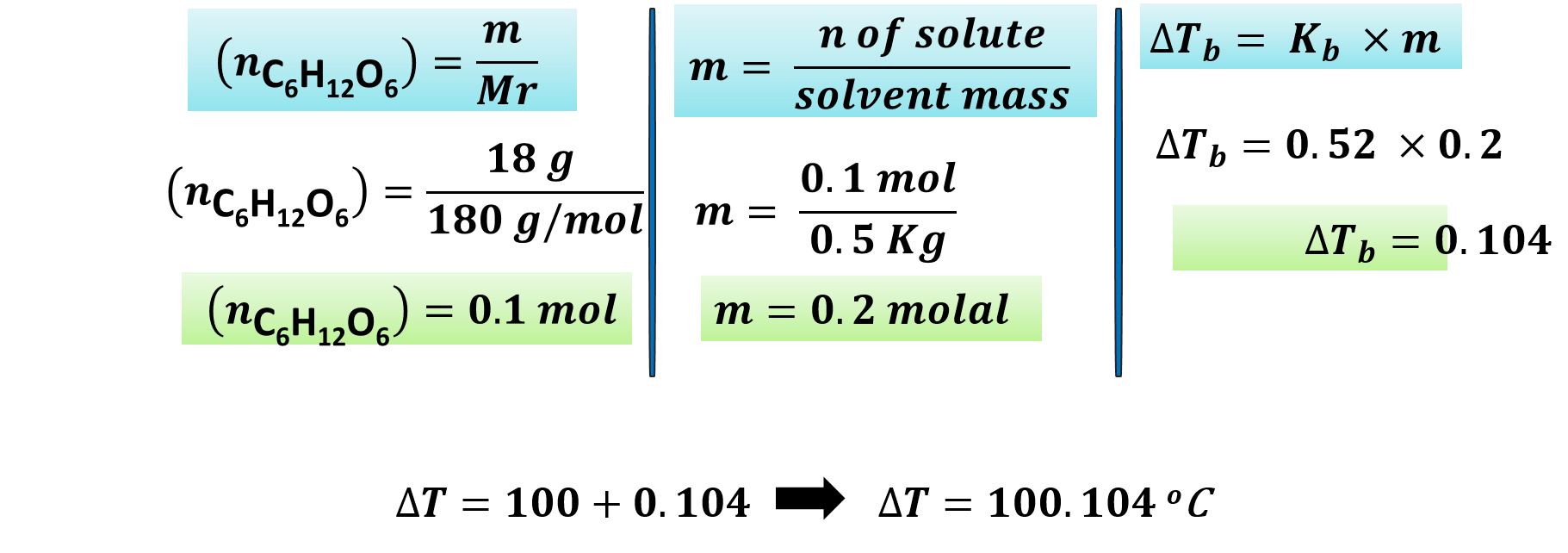
مثال: إذا علمت أن 18g من السكر C6H12O6 أذيب في 500g من الماء النقي، فاحسب درجة غليان المحلول الناتج. «علمًا أن ثابت الارتفاع في درجة غليان الماء 0.52oC.Kg/mol والكتلة المولية للسكر المذاب = 180g/mol»
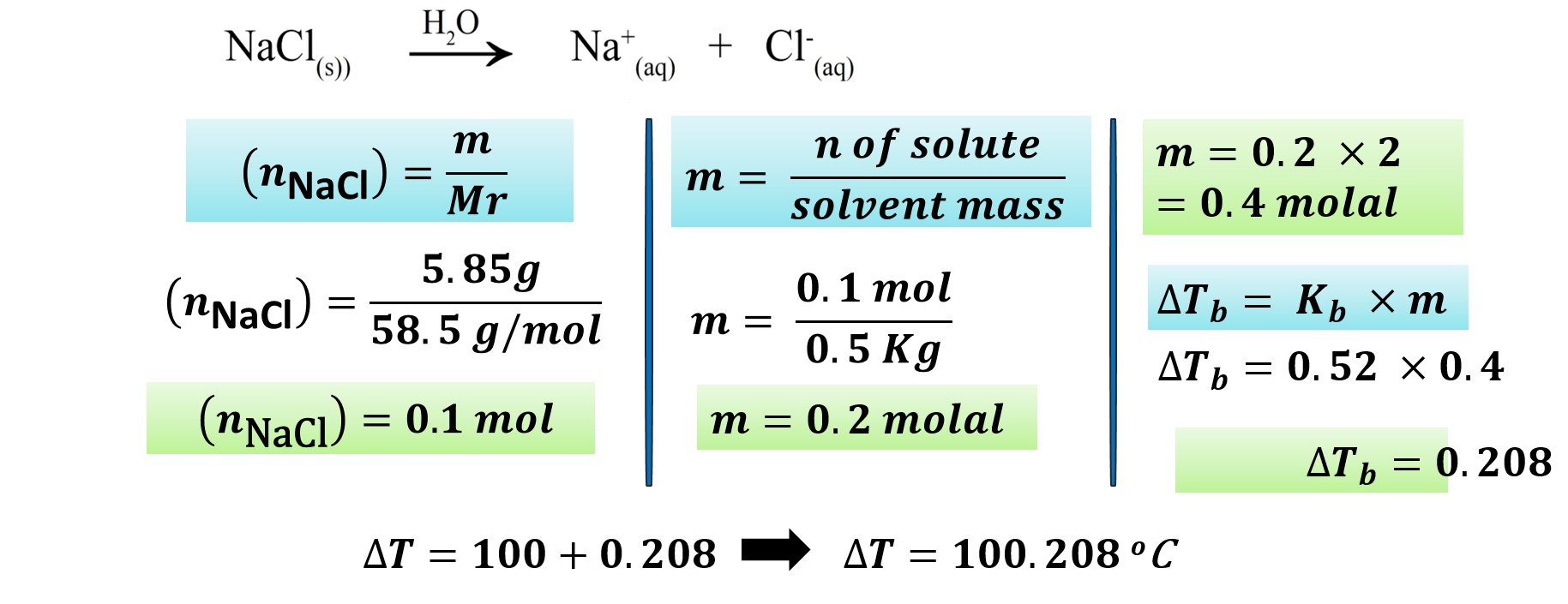
مثال: إذا علمت أن 5.85g من NaCl أذيب في 0.5Kg من الماء النقي، فاحسب درجة غليان المحلول الناتج. «علمًا أن ثابت الارتفاع في درجة غليان الماء 0.52oC.Kg/mol والكتلة المولية للملح المذاب = 58.5g/mol»
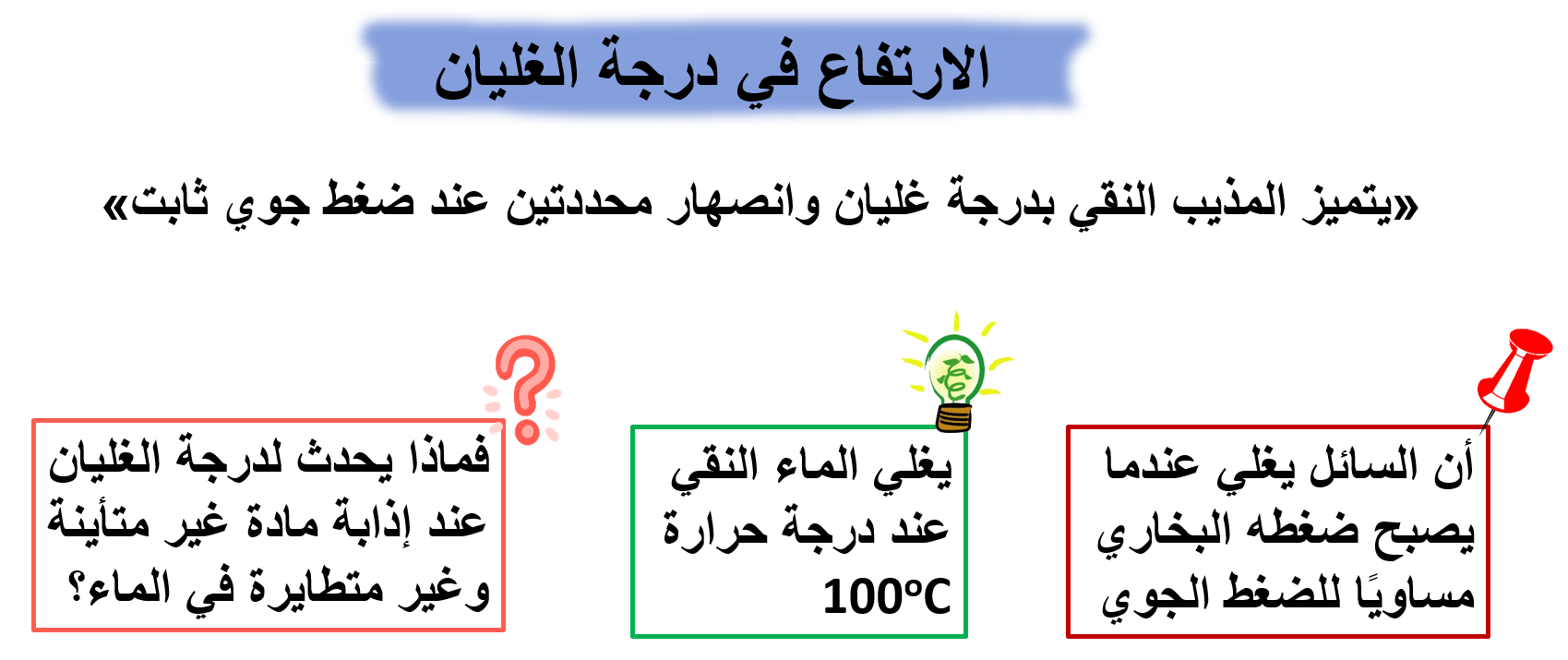
أفكر: ما أثرُ الضغط الجويّ في درجة غليان المحلول؟
الاجابة: عندما يصبح الضغط الجوي مساويا للضغط البخارى للسائل يغلى المحلول.
أفكر: لماذا يُعَبَّرُ عن الارتفاع في درجة الغليان بدلالةِ المولاليّة وليس المولاريّة؟
الإجابة: لان المولالية تتأثر بدرجة حرارة المحلول.
أتحقَّق: أحسُبُ مقدارَ الارتفاع في درجة غليان محلول تكوّنَ بإذابة 12g من حِمض الميثانويك Mr = 46 g/mol) HCOOH ) في 2Kg منَ الإيثانول. علمًا أنّ ثابتَ الارتفاع في درجة غليان الإيثانول 1.19oC.Kg/mol
الحل:
1- حساب عدد مولات المذاب:
2- حساب التركيز المولالي:
3- حساب الارتفاع في درجة الغليان:
4- حساب درجة غليان المحلول:
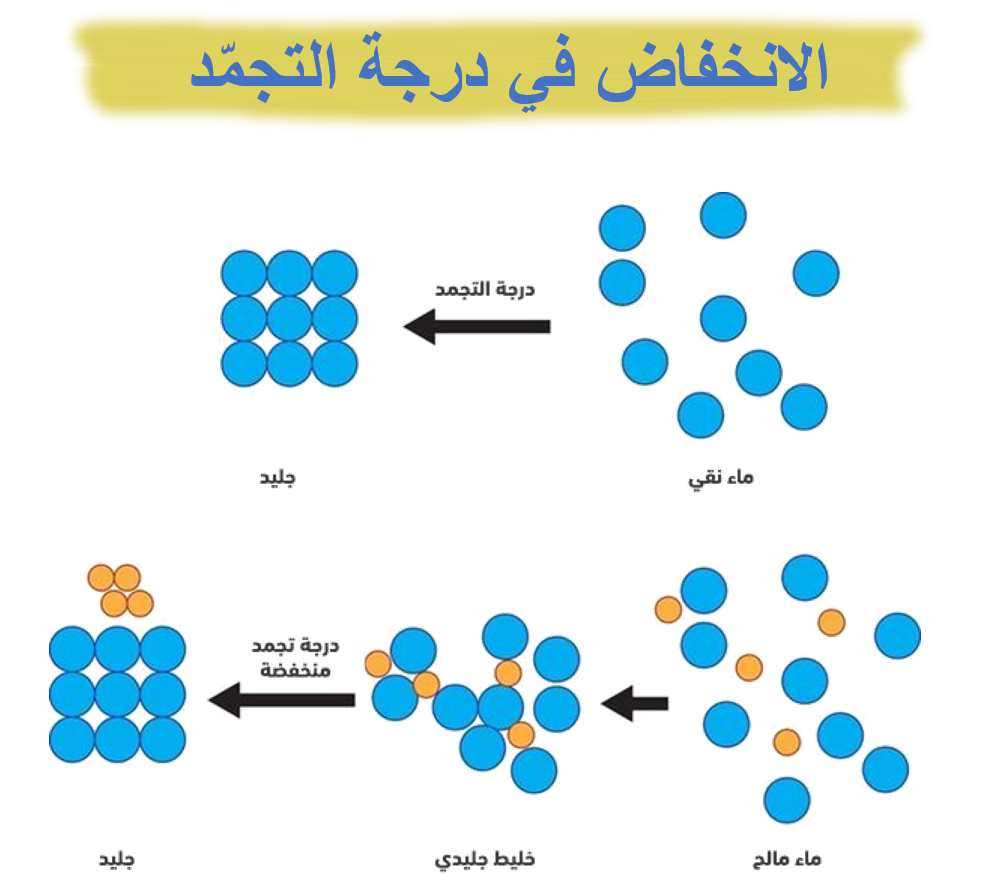
«الفرق بين درجة تجمّد المذيب النقي والمحلول»
ويرمز إليه بالرمز (Tf△)
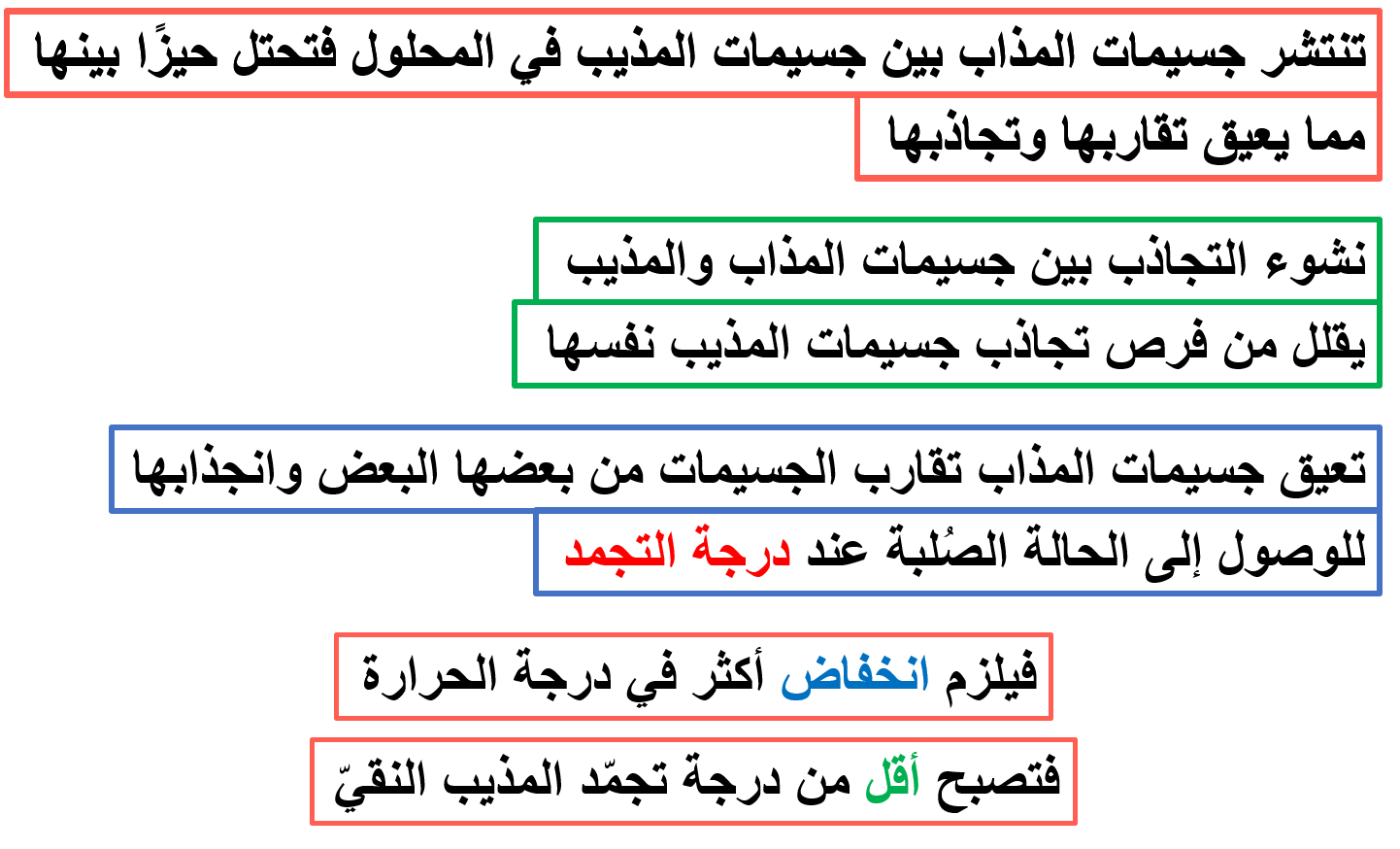
ويتناسب طرديًا مع التركيز المولاليّ للمحلول
vويعبّر عن الانخفاض في درجة التجمّد بالصيغة الرياضية:

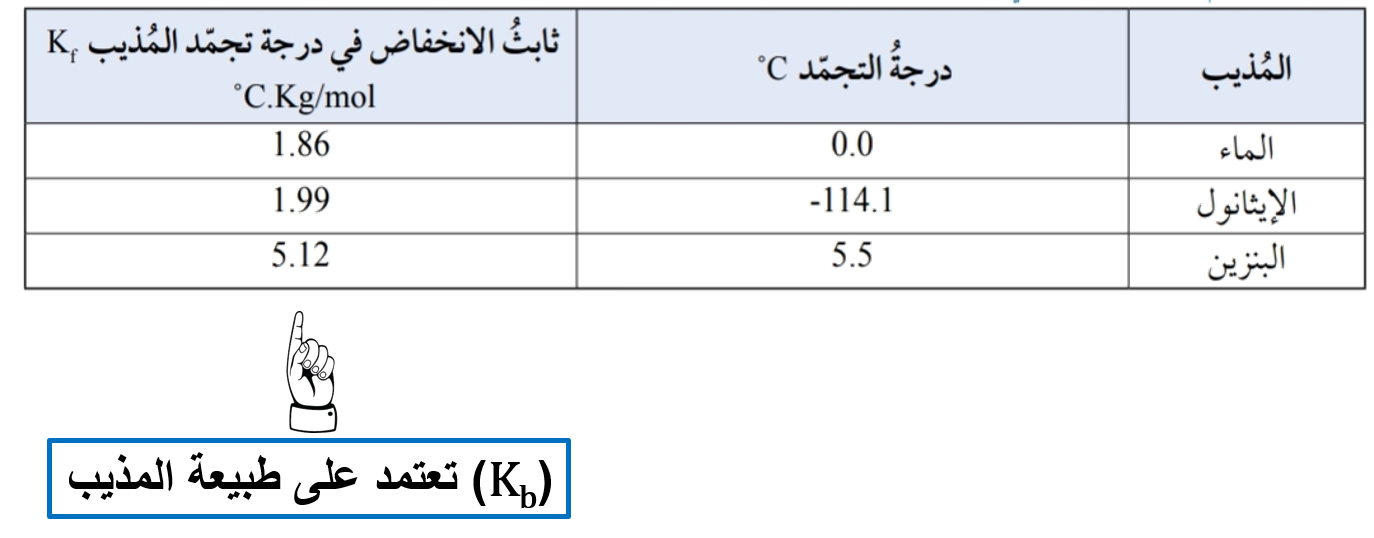
(Kf) = مقدار الانخفاض في درجة تجمّد المذيب عند إذابة 1mol من المذاب في Kg من المذيب النقي.
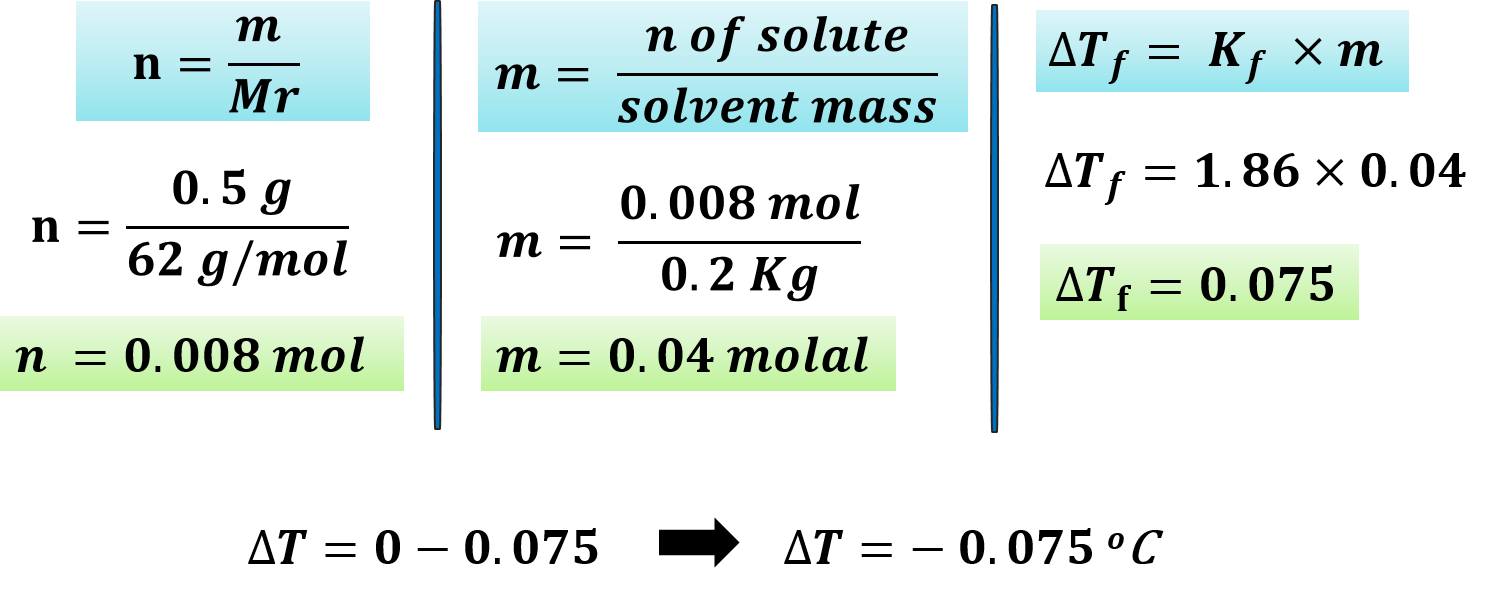
مثال: احسب درجة التجمّد لمحلول يحتوي على 0.5g من مادة مذابة في 0.2Kg من الماء المقطر؟ علمًا أن (Mr =62 g/mol , Kf = 1.86 oC.Kg/mol)
الحل:
أتحقَّق: أحسُبُ مقدارَ الانخفاض في درجة التجمّد لمحلول تكوّنَ بإذابة 0.1mol من مادّة غيرِ متأيِّنة في 400g منَ البنزين. علمًا أنّ ثابتَ الانخفاض في درجة تجمّد البنزين 5.12 oC.Kg/mol
الحل:
1- حساب عدد مولات المذاب:
2- حساب التركيز المولالي:
3- حساب الانخفاض في درجة التجمد :
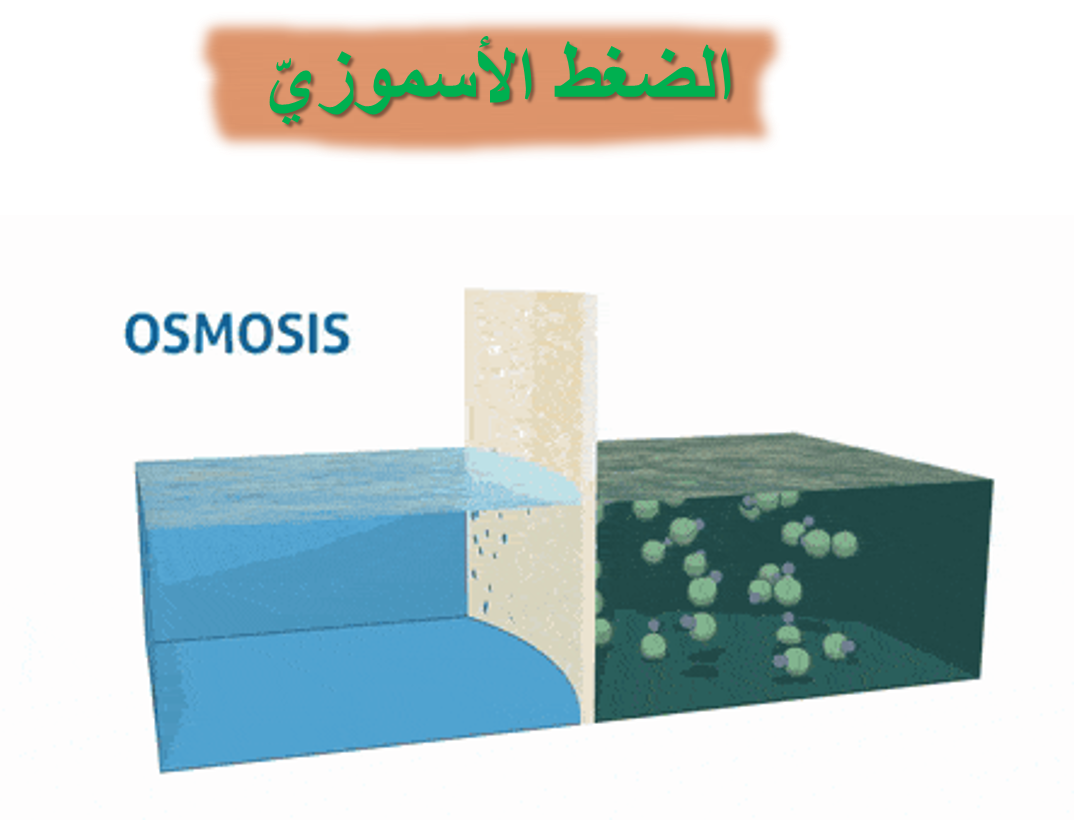
ماذا يقصد بالأسموزيّة؟
هي عملية انتشار المذيب من الوسط الأقل تركيز إلى الوسط الأعلى تركيز عبر أغشية شبه منفذة.
ما أهمية هذه العملية؟
تؤدي دورًا حيويًا في الكثير من العمليات الحيوية في النباتات.
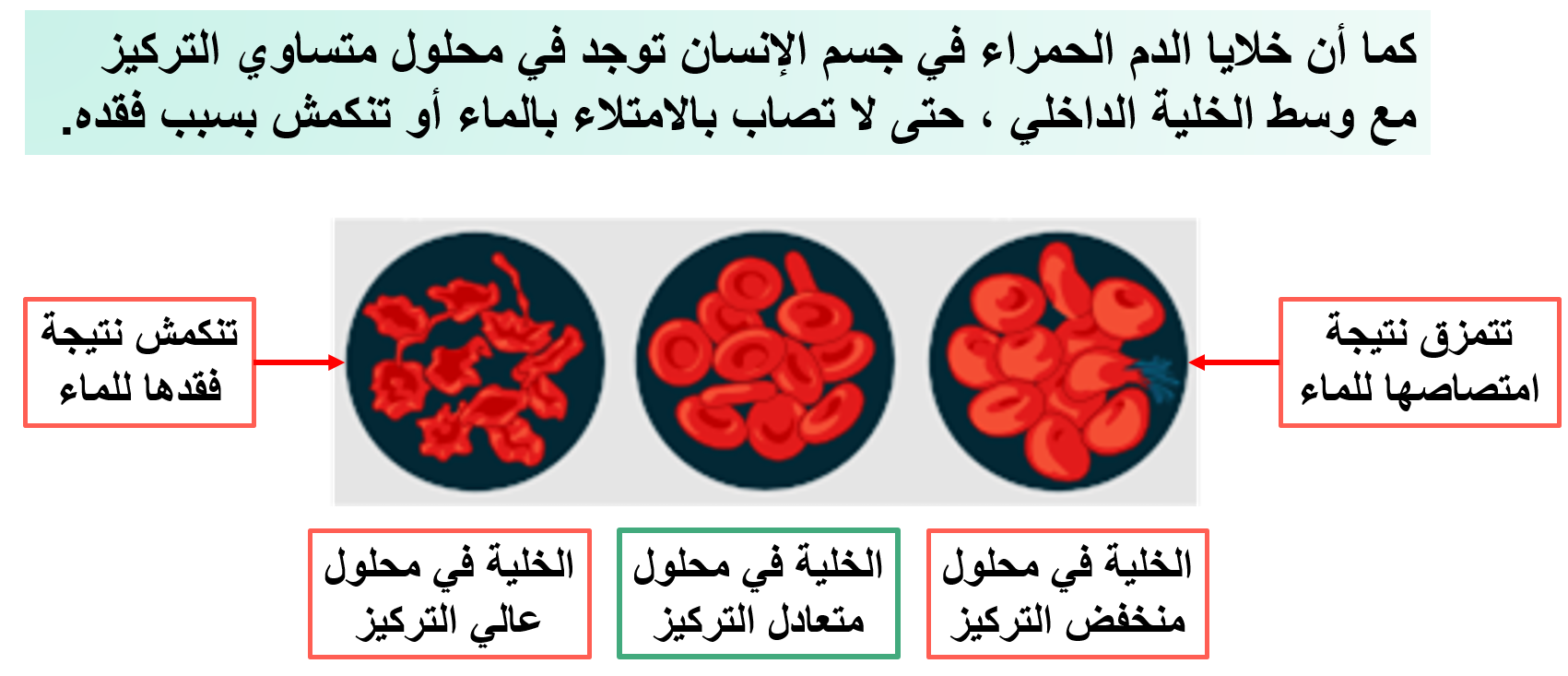
ما وظيفة الأغشية شبه المنفذة؟
ماذا يسمى الضغط الذي يدفع المذيب النقي من الوسط الأقل تركيز إلى الوسط الأعلى تركيز عبر الغشاء شبه المنفذ؟ الضغط الأسموزيّ
«ويعد من الخصائص الجامعة للمحاليل»
لأنه يعتمد على عدد جسيمات المذاب في كمية محددة من المحلول.
أتحقَّق: ما المقصودُ بالضغط الأُسموزيّ؟
الإجابة: الضغط الذي يدفع المذيب النقي من الوسط الأقل تركيز الى الوسط الأعلى تركيز عبر غشاء شبه منفذ.