- المفاهيم والمصطلحات :
عزيزي الطالب ستتعرف في هذا الدرس على هذه المفاهيم والمصطلحات العلمية :
|
طاقة الرابطة |
Energy Bond |
|
حرارة التفاعل |
Heat Reaction |
|
القيمة الحرارية للوقود |
Thermal Fuel Value |
|
قانون حفظ الطاقة |
Energy Conservation Low |
|
قانون هيس |
Hess’s Low |
|
حرارة التكوين القياسية |
Standard Enthalpy of Formation |
حساب التغير في المحتوى الحراري (Calculate Enthalpy Change) :
- تختلف التفاعلات في آليات حدوثها وسرعتها حيث أن :
أ) بعضها يحدث في ظروف صعبة لا يمكن توافرها في المختبر
ب) بعضها قد يستغرق حدوثه زمنًا طويلًا فيصعب قياس حرارة التفاعل بالمسعر والطرائق التقليدية
- لذلك؛ يلجأ الكيميائيون إلى إستخدام طرائق نظرية لحساب التغير في المحتوى الحراري.
- الطرائق النظرية التي يلجأ لها الكيميائيون لحساب التغير في المحتوى الحراري لأي تفاعل :
أ) حساب طاقة الرابطة
ب) إستخدام قانون هيس
جـ) حساب حرارة التكوين القياسية HfoΔ
- طاقة الرابطة : (Bond Energy)
- تعريفها: هي كمية الطاقة اللازمة لكسر مول من الروابط بين ذرتين في الحالة الغازية .
- وحدة قياسها: ( كيلوجول/ مول) (KJ/mol)
- رمزها : B . E
الشرح وطريقة حساب طاقة الرابطة :
- تمر التفاعلات الكيميائية بالعادة بمرحلتين :
1) المرحلة الأولى: يحدث فيها تكسير الروابط بين ذرات المواد المتفاعلة مما يتطلب إكتساب الذرات طاقة كافية لكسر الروابط بينها.
2) المرحلة الثانية: يحدث فيها إعادة ترتيب الذرات وتكوين الروابط بينها في تراكيب كيميائية جديدة.
* يمكن إستخدام طاقة الروابط في حساب التغير في المحتوى الحراري للتفاعل
مثال (1):
عند إحتراق غاز البروبان بوجود الأكسجين كما في المعادلة :
فإن التفاعل يمر بمرحلتين أساسيتن كما في الشكل الأتي :
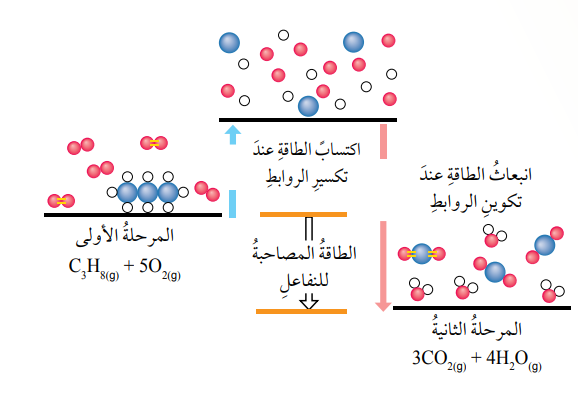
- في الشكل السابق :
- المرحلة الأولى : يجري فيها تكسير الروابط بين الذرات في المواد المتفاعلة فتتكسر الروابط بين ذرات الكربون في البروبان (C3H8) وكذلك الرابطة بين ذرتي الأكسجين في جزيء الأكسجين (O2)، فتكتسب كل رابطة منها كمية كافية من الطاقة لكسرها وبذلك فإن هذه العملية تكون ماصة للطاقة.
- المرحلة الثانية : يجري تكوين روابط جديدة بين ذرات الكربون والأكسجين في المركب (CO2) الناتج وكذلك بين ذرات الأكسجين والهيدروجين في مركب H2O؛ يرافق التكوين لهذه الروابط إنبعاث كمية من الطاقة وتكون هذه العملية طاردة للطاقة.
- بشكل عام :
إن تفاعل إحتراق الوقود يكون عادةً طاردًا للحرارة وذلك لأن :
الطاقة المنبعثة نتيجة تكوين الروابط الجديدة تكون أكبر من الطاقة الممتصة اللازمة لتكسير الروابط في المواد المتفاعلة.
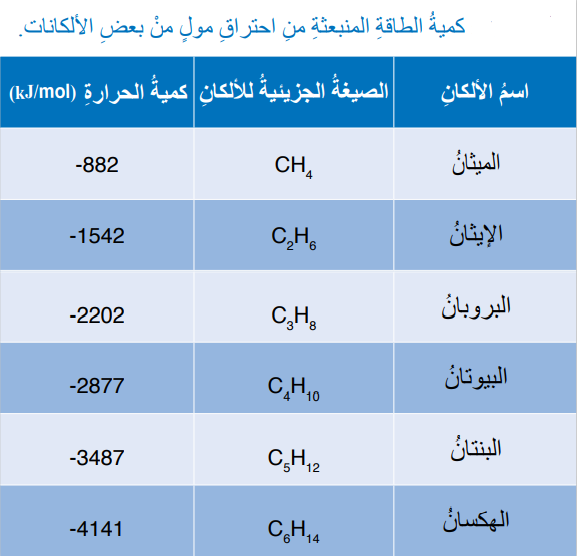
الجدول الأتي يبين كمية الطاقة المنبعثة عن حرق مول من الألكانات المختلفة وهي مواد تتكون من الكربون والهيدروجين :
 |
 |
- يلاحظ من الجدول :
- أنه بزيادة عدد ذرات الكربون في الألكان فإنه:
" تزداد الكتلة المولية وبذلك تزداد كمية الطاقة الناتجة عن إحتراقها"
- القيمة الحرارية للوقود (Thermal Fuel Value):
" هي كمية الحرارة الناتجة عن حرق غرام واحد من الوقود حرقًا تامًا بوجود الأكسجين "
- يتضح أن التفاعل الكيميائي:
- في المرحلة الأولى يتضمن تكسير الروابط بين ذرات المواد المتفاعلة وهذا يتطلب تزويد هذه الروابط بكمية كافية من الطاقة لتكسيرها وهذه الطاقة تسمى بـطاقة الرابطة
- في المرحلة الثانية تتكون روابط جديدة يرافق ذلك إنبعاث كمية من الطاقة وإنخفاض في طاقة المواد الناتجة وتبعًا لقانون حفظ الطاقة في التفاعلات الكيميائية فإن مجموع الطاقة التي تمتصها الروابط في المواد المتفاعلة والتي تنبعث عند تكوين الروابط الجديدة يمثل التغير في المحتوى الحراري HΔ
نص قانون حفظ الطاقة : " إن مجموع الطاقة التي تمتصها روابط المواد المتفاعلة يساوي الطاقة التي تنبعث عند تكوين الروابط الجديدة "
- الجدول الأتي يمثل قيم الطاقة لعدد من الروابط مقيسةً بوحدة (كيلو جول/ مول )
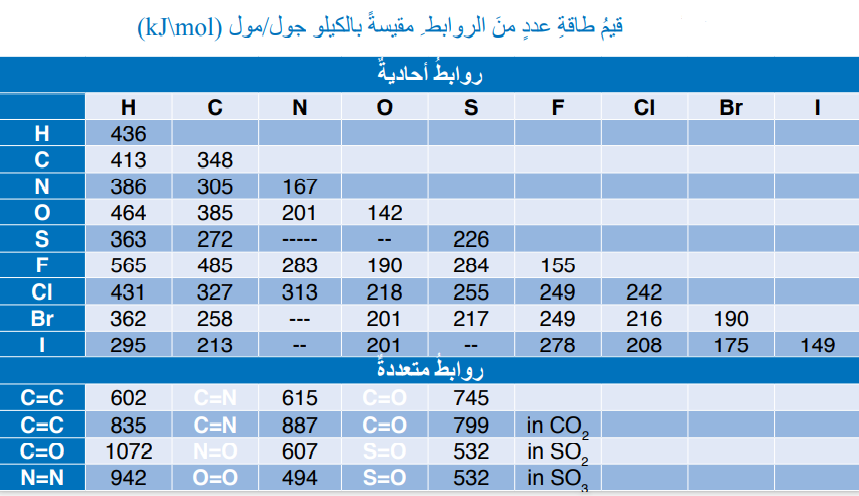
- تجدر الإشارة إلى أن :
- كمية الطاقة اللازمة لكسر الرابطة (طاقة الرابطة ) تساوي كمية الطاقة الناتجة عن تكوينها لكن :
- طاقة الروابط في المواد الناتجة تكون سالبة بسب إنبعاث الطاقة عند تكوين الرابطة.
- تبين العلاقة الأتية كيفية حساب الحرارة المرافقة للتفاعل (HΔ) :
عند إعادة ترتيب المعادلة تصبح :
حيث أن :
Σ B.E re: مجموع طاقة الروابط التي يتم تكسيرها في المواد المتفاعلة.
Σ B.E pr: مجموع طاقة الروابط التي يتم تكوينها في المواد الناتجة.
مثال (2):
يتكون غاز كلوريد الهيدروجين وفقًا للمعادلة الأتية :
احسب الحرارة المرافقة للتفاعل علمًا بأن طاقة الرابطة الأحادية (Cl – Cl) = 242 KJ/mol
وطاقة الرابطة الأحادية بين ذرتي الهيدروجين = KJ/mol436 وطاقة الرابطة الأحادية بين الهيدروجين والكلور = 431 KJ/mol
الإجابة :
تحليل السؤال :
يلاحظ أن هناك رابطة أحادية بين ذرتي الكلور (Cl – Cl) وكذلك رابطة أحادية بين ذرتين الهيدروجين (H – H) في المواد المتفاعلة وأن هناك جزيئين من(HCl) ، كل جزيء منها يحتوي رابطة أحادية (H - Cl) أي أن عدد روابط (H - Cl) :
عدد روابط (H - Cl) = 1 × 2 = 2
الحل :
الإشارة السالبة لحرارة التفاعل تشير إلى أن التفاعل طارد للحرارة
مثال (3):
يتفاعل النتروجين مع غاز الأكسجين مكونًا أكسيد النتروجين كما في المعادلة الآتية :
احسب التغير في المحتوى الحراري بإستخدام الجدول الذي يمثل طاقات الروابط :
الإجابة :
تحليل السؤال :
يلاحظ أنه في المواد المتفاعلة يوجد جزيء (N2) والذي يحتوي على رابطة ثلاثية بين ذرتي النيتروجين، بالإضافة إلى جزيئين من الأكسجين، يحتوي كل منهما رابطة ثنائية بين ذرتي الأكسجين ، أما في المواد الناتجة فهناك جزيئان من (NO2) يحتوي كل جزء منهما على رابطة ثنائية مع إحدى ذرات الأكسجين ، وعلى رابطة أحادية مع الذرة الأخرى؛ فيكون هناك : رابطتين ورابطة في النواتج:
الحل :
يلاحظ أن الإشارة الموجبة لحرارة التفاعل تشير إلى أن التفاعل ماص للحرارة
سؤال (1):
بالإعتماد على جدول طاقات الروابط : أحسب التغير في المحتوى الحراري للتفاعلين الآتيين، وأصنفها إلى ماصةٍ وأخرى طاردةٍ للحرارة :
1) تفاعل غاز الميثان مع غاز الكلور لتكوين غاز الكلوروميثان وغاز كلوريد الهيدروجين كما في المعادلة :
2) تحلل الماء وفق المعادلة الآتية :
الإجابة :
تحليل الفرع رقم (1) :
المواد المتفاعلة :
يوجد أربع روابط (C – H) في المركب (CH4) ورابطة (Cl – Cl) في المركب Cl2
المواد الناتجة :
يوجد ثلاث روابط (C – H) ورابطة (C – Cl) في المركب (CH3Cl) ,وهناك رابطة (H – Cl) في المركب HCl
الحل :
تحليل الفرع رقم (2) :
المواد المتفاعلة :
هناك جزيئان H2O كل جزيء منهما يحتوي على رابطتين (O – H) أي أن هناك أربع روابط (O – H)
المواد الناتجة :
يوجد جزيئان H2 كل جزيء يحتوي على رابطة (H – H) ، أي أن هناك رابطتين (H – H) ورابطة (O꓿O) في المركب O2
الحل :
- قانون هيس : (Hess’s Law)
- تحدث الكثير من التفاعلات الكيميائية بخطوتين أو أكثر ويمثل مجموع هذه الخطوات المعادلة النهائية للتفاعل.
- عندما كان التغير في المحتوى الحراري لا يعتمد على مسار حدوث التفاعل أو الخطوات التي يمر بها ويعبرُ عن الحالة النهائية للتفاعل ، توصل العالم الكيميائي جيرمان هنري هيس إلى أن :
- التغير في المحتوى الحراري يساوي مجموع التغيرات الحرارية لخطوات حدوث التفاعل سواءً أحدث التفاعل بخطوة واحدة أم أكثر.
- ينص قانون هيس على أن : " التغير في المحتوى الحراري للتفاعل يعتمد على طبيعة المواد المتفاعلة والناتجة، وليس على مسار التفاعل.
- كيفية حساب حرارة التفاعل بإستخدام قانون هيس : سيتم توضيح طريقة الحساب من خلال المثال الآتي :
مثال (4):
يتفاعل الغرافيت (C) مع الأكسجين لتكوين أول أكسيد الكربون كما في المعادلة الآتية :
عند إجراء التفاعل فإنه يتكون خليط من أول أكسيد الكربون (CO) وثاني أكسيد الكربون (CO2)، ويمكن زيادة نسبة الأكسجين للحصول على ثاني أكسيد الكربون (CO2) كما في المعادلتين الآتيتين، أي أنه يمكن وضع تصور لحدوث التفاعل يشتمل على خطوتين لكل منهما حرارة تفاعل خاصةٍ بهما كما يأتي :
بإستخدام المعادلتين (1, 2) أحسب حرارة التفاعل :
الإجابة :
تحليل السؤال :
لحساب حرارة التفاعل يجب إعادة تنظيم التفاعلين لنحصل عند جمعها على المعادلة النهائية للتفاعل، وحيث أن الناتج النهائي للتفاعل يتضمن أول أكسيد الكربون (CO)، ولا بد أن يظهر في النواتج عند جمع المعادلتين ولذلك نعكس المعادلة (2) ونعكس إشارة ونضرب المعادلة بـ (2) للتخلص من الكسر في المعادلة لتصبح على النحو الآتي :
يصبح لدينا المعادلتين على النحو الآتي :
لاحظ أن مركب (CO2) لا يظهر في معادلة التفاعل المطلوب حساب التغير في المحتوى الحراري له، لذلك يجب التخلص منه عند جمع المعادلتين وبالتالي يجب أن تكون أعداد مولاته متساوية في المعادلتين لنتمكن من إختصاره، فنضرب المعادلة (2) بــ (2) ونجمع المعادلتين (2) و (3) مع مراعاة اختصار الصيغ المتماثلة على جانبي المعادلتين، نحصل على صافي المعادلة الكلية للتفاعل ومقدار التغير في المحتوى الحراري للتفاعل كما يآتي :
بهذه الطريقة يمكن حساب التغير في المحتوى الحراري للتفاعل بإستخدام قانون هيس ، الشكل الآتي يبين مخطط التغير في المحتوى الحراري لتفاعل الغرافيت مع الأكسجين
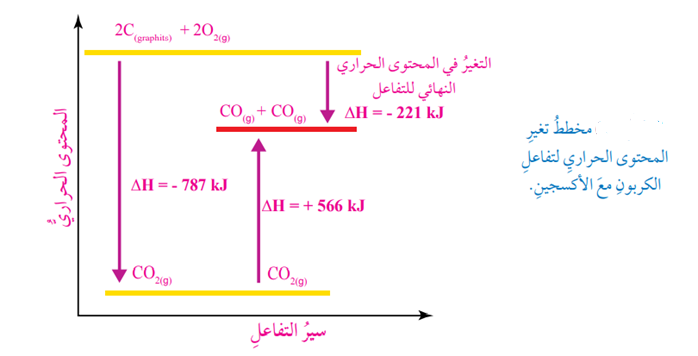
مثال (5):
يتفاعل الأكسجين مع غاز كلوريد الهيدروجين؛ وفق المعادلة الآتية :
أستخدم المعادلتين الآتيتين لحساب التغير في المحتوى الحراري للتفاعل :
الإجابة :
نلاحظ أن المعادلة المطلوبة لا تتضمن المركب HCl في المواد الناتجة، وإنما يوجد في المواد المتفاعلة، لذلك نعكس المعادلة (1)، ونعكس إشارة لتصبح المعادلة كما يآتي :
وحيث أن المعادلة النهائية تحتوي على (4) مولات من HCl، في حين أن المعادلة (3) تحتوى على مولين (2) منه، فإننا نضرب المعادلة (3) وقيمة بـ(2) وتصبح المعادلة كما يآتي :
نجمع المعادلتين (2, 4) وقيم لهما، لنحصل على المعادلة النهائية وقيمة التغير في المحتوى الحراري للتفاعل
يتضح من المثالين السابقين أنه يمكن حساب التغير في المحتوى الحراري للتفاعل بإستخدام قانون هيس من خلال مجموع التغيرات في المحتوى الحراري للتفاعلات التي تمثل خطوات حدوث التفاعل أي أن:
وكذلك حرارة التفاعل الكلية تساوي مقدارًا ثابتًا، بغض النظر عن خطوات حدوث التفاعل.
سؤال (2):
يتفاعل الألمنيوم(Al) مع أكسيد المنغنيز (MnO2) وفق المعادلة الآتية :
أستخدم المعادلتين الآتيتين لحساب التغير في المحتوى الحراري للتفاعل :
الإجابة :
للتخلص من الأكسجين نضرب المعادلة الأولى بـ (2)، ونعكس المعادلة الثانية ونضربها بـ (3)، ونجمعها؛ لتصبح المعادلات على النحو الآتي :
- حرارة التكوين القياسية (Standard Enthalpy of Formation) : ()
- تعريفها: هي التغير في المحتوى الحراري الناتج عن تكوين مول واحد من المركب من عناصره الأساسية .
- تشير الحالة القياسية إلى قياس التغير في المحتوى الحراري في ظروف قياسية
- الظروف القياسية التي يتم فيها قياس التغير في المحتوى الحراري :
أ) التركيز (1 mol/L)
ب) درجة الحرارة 25 Cᵒ
جـ) الضغط يساوي 1 atm
- تستخدم حرارة التكوين القياسية في حساب التغير في المحتوى الحراري للتفاعل
- طريقة حساب حرارة التكوين القياسية :
التغير في المحتوى الحراري القياسي للتفاعل والذي يرمز له بالرمز ΔHf° وهو الذي يساوي مجموع حرارة التكوين القياسية لجميع المركبات في التفاعل.
بالرموز :
حيث أن :
:ΔHf°التغير في المحتوى الحراري للتفاعل
ΔHf° (re): حرارة التكوين القياسية للمركبات المتفاعلة
ΔHf° (pr) : حرارة التكوين القياسية للمركبات الناتجة .
- تكون حرارة التكوين القياسية للمركبات الناتجة سالبة
- تكون حرارة التكوين القياسية للعناصر الحرة تساوي صفرًا
- الجدول الآتي يمثل قيم حرارة التكوين القياسية لعدد من المركبات؛ حيث تستخدم هذه القيم في حساب حرارة التفاعل القياسية أو التغير في المحتوى الحراري القياسي للتفاعل (ΔHf°)
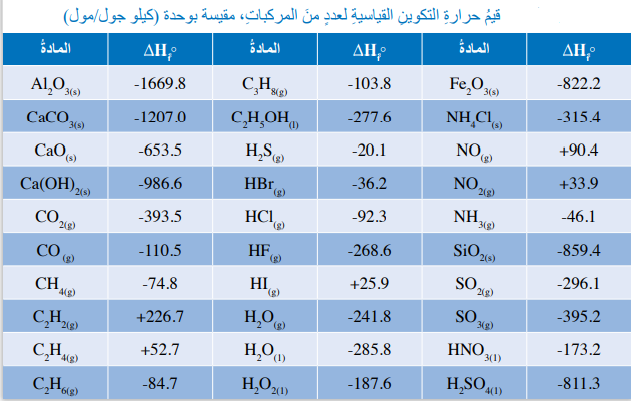
سؤال (3) :
لماذا تظهر قيم حرارة التكوين لبعض المركبات في الجدول بقيم موجبة :
الإجابة :
لأن بعض المركبات مثل (NO2) و (NO) تكون الطاقة اللازمة لتكسير الروابط بين ذراتها أكبر من الطاقة الناتجة عن تكوينها .
مثال للتوضيح :
في الظروف القياسية يتفاعل نصف مول من الأكسجين (O2) مع مول من غاز الهيدروجين (H2) لتكوين مول من الماء السائل ويرافق ذلك إنبعاث طاقة حرارية مقدارها (285.8 KJ/mol)، وهذه الطاقة تمثل حرارة التكوين القياسية للماء ويرمز لها بالرمز foΔH ويمكن التعبير عن التفاعل بالمعادلة الآتية :
مثال(6):
بإستخدام جدول الذي يبين قيم حرارة التكوين للمركبات المختلفة أحسب التغير في المحتوى الحراري للتفاعل الآتي :
الحل :
تحليل السؤال :
بالرجوع للجدول نجد أن حرارة التكوين للمركبات في التفاعل كما يأتي :
عند حساب التغير في المحتوى الحراري نضرب حرارة التكوين المركب بعدد مولاته في المعادلة :
سؤال (4) :
بإستخدام جدول حرارة التكوين القياسية، أحسب حرارة التفاعل الآتي :
الإجابة :
نضرب حرارة التكوين القياسية للمركب (NH3) بـ (4)، وكذلك نضرب حرارة التكوين القياسية للمركب (NO2) بـ (4) بسبب وجود أربعة مولات من كل منها في المعادلة،
ونضرب حرارة التكوين القياسية للماء (H2O(g)) بـ (6)، نلاحظ أن حرارة التكوين القياسية للأكسجين تساوي صفرًا :
- حساب حرارة التفاعل الكيميائي لكتلة معينة من المادة:
- يعبر عن الطاقة المرافقة للتفاعل في المعادلة الكيميائية بكتابة حرارة التفاعل ضمن المعادلة
- في المعادلات الطاردة للحرارة تكتب حرارة التفاعل في جهة المواد الناتجة
- في التفاعلات الماصة للحرارة تكتب حرارة التفاعل في جهة المواد المتفاعلة
- في كلتا الحالتين تعامل الطاقة معاملة المواد المتفاعلة أو الناتجة
- يمكن التعبير عن حرارة التفاعل بكتابتها إلى جانب المعادلة وتسمى المعادلة بـ المعادلة الكيميائية الحرارية (The Thermochemical Equation)
مثال للتوضيح :
يحرق مول من غاز الميثان بوجود الأكسجين منتجًا طاقة حرارية مقدارها(KJ 882 ) كما يآتي :
بالتدقيق في المعادلة الكيميائية الحرارية نجد أن إحتراق مول من الميثان (CH4) حيث كتلته المولية (16g) احتراقًا تامًا بوجود (2) مول من الأكسجين ينتج ما مقداره (882 KJ) من الحرارة، ويعني ذلك :
- أنه ينتج من إحتراق مولين من الميثان كتلتهما (32g) ما مقداره (2 x 882 = 1772 KJ)
- بالتالي يمكن إستخدام المعادلة الكيميائية الحرارية لحساب كمية الحرارة المرافقة لإحتراق كتلة معينة من المادة أو تفاعلها.
مثال(7):
يحترق الميثان بوجود الأكسجين؛ وفق المعادلة الحرارية الآتية :
فإذا احترق (128g) من الميثان بوجود كمية كافية من الأكسجين فأحسب كمية الحرارة المرافقة للتفاعل؛ علمًا بأن الكتلة المولية للميثان تساوي (16g/mol) :
الإجابة :
تحليل السؤال :
بالرجوع إلى المعادلة الموزونة نجد أن احتراق مول من الميثان (CH4) ينتج (882 KJ)، حيث أن المطلوب حساب كمية الحرارة الناتجة عن احتراق (128 g) من الميثان فإننا نحول هذه الكتلة إلى مولات كما يأتي :
ثم حساب النسبة المولية (X) للمادة (CH4) بقسمة عدد مولاتها في التفاعل (nr) على عدد مولاتها في المعادلة (ne)
ثم نحسب كمية الحرارة الناتجة (q) عنها بضرب النسبة المولية (nr) بكمية الحرارة المرافقة للتفاعل ΔH
q= X x ΔH = 8 x 882 = 7056 KJ
مثال(8):
يحضر أكسيد الكالسيوم CaO من تحلل كربونات الكالسيوم CaCO3 بالحرارة، وفق المعادلة الآتية :
أحسب كمية الحرارة اللازمة لتحليل (150g) من كربونات الكالسيوم بشكل كامل، علمًا بأن الكتلة المولية لكربونات الكالسيوم تساوي (100 g/ mol) :
الإجابة :
تحليل السؤال :
بالرجوع إلى المعادلة الموزونة نجد أن تحلل مول من كربونات الكالسيوم CaCO3 ينتج (178 KJ) وحيث أن المطلوب حساب كمية الحرارة اللازمة لتحلل (150g) من كربونات الكالسيوم CaCO3 فإننا نحول هذه الكتلة إلى مولات كما يآتي:
ثم حساب النسبة المولية (X) للمادة CaCO3 بقسمة عدد مولاتها في التفاعل (nr) على عدد مولاتها في المعادلة (ne)
ثم نحسب كمية الحرارة (q) الناتجة عنها، بضرب النسبة المولية (X) بكمية الحرارة المرافقة للتفاعل
q= X x ΔH = 1.5 x 178 = 267 KJ
سؤال (5) :
يحضر أكسيد النتروجين (NO) باحتراق الأمونيا بوجود الأكسجين، وفق المعادلة الحرارية الآتية :
أحسب كمية الحرارة الناتجة عن احتراق كمية كافية من الأمونيا لإنتاج (200g) من أكسيد النتروجين (NO)، علمًا بأن الكتلة المولية لأكسيد النتروجين (NO) تساوي (30 g/mol):
الإجابة :
1) نحسب عدد مولات (NO) :
2) نحسب النسبة المولية :
3) نحسب كمية الحرارة الناتجة :
q= X x ΔH = 1.66 x (-904.6) = -1501.64 KJ
سؤال (6) :
يحترق الإيثانول السائل (CH3CH2OH) بوجود الأكسجين، وفق المعادلة الحرارية الآتية :
فإذا احترق 30g)) من الإيثانول بوجود كمية كافية من الأكسجين فأحسب كمية الحرارة المرافقة للتفاعل، علمًا بأن الكتلة المولية للإيثانول تساوي (46 g/mol) :
الإجابة :
1) نحسب عدد مولات الإيثانول :
2) نحسب النسبة المولية :
3) نحسب كمية الحرارة الناتجة :
q= X x ΔH = 0.65 x (--1368) = -889.2 KJ
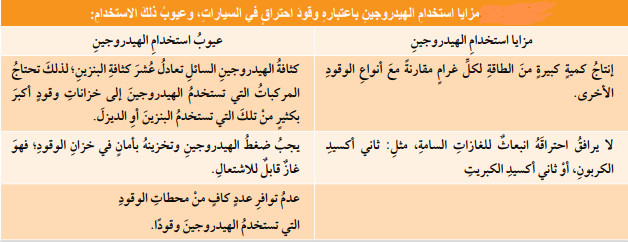
- الإثراء والتوسع : الهيدروجين بإعتباره وقودًا (Hydrogen as Fuel)
* يعد تفاعل إحتراق الهيدروجين بوجود الأكسجين من التفاعلات الأكثر إنتاجًا للطاقة بين المواد، فهو من التفاعلات الطاردة للطاقة؛ حيث يحترق الهيدروجين وفقًا للمعادلة الآتية :
+ عند إحتراق (2g) من الهيدروجين ينتج طاقة حرارية مقدارها (286KJ)، وهذه كمية من الطاقة كبيرةً مقارنةً بما تنتجه الكمية نفسها من أنواع الوقود الأخرى؛ لذلك:
- يستخدم الهيدروجين بإعتباره وقودًا في الصواريخ الفضائية والغواصات
* حيث أن : إحتراق الهيدروجين لا يرافقه إنتاج أي نوع من الغازات السامة فهو يعد من الوقود النظيف.
* الجدول الآتي يبين كمية الطاقة الناتجة عن إحتراق غرام واحد لعدد من أنواع الوقود المختلفة :
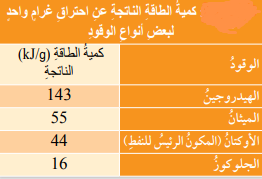
* الجدول الآتي يبين مزايا إستخدام الهيدروجين بإعتباره وقود إحتراق، وعيويه في السيارات :