مفاهيم أساسية في الديناميكا الحرارية Basic Concepts in Thermodynamics
في أثناء دراسة علم الميكانيكا، حددت معاني المفاهيم الأساسية، مثل: الكتلة، والقوة، والطاقة الحركية، وغيرها بدقة؛
لتسهيل التعامل معها. وبالمثل، لتسهيل وصف الظواهر الحرارية يلزم تحديد معاني المفاهيم الأساسية فيها بدقة،
ومنها: درجة الحرارة، والحرارة، والطاقة الحرارية. وقبل البدء بدراسة هذه المفاهيم لا بد من توضيح نموذج الحركة الجزيئية
للمادة؛ لدراسة الخصائص الحرارية للمواد على المستوى المجهري.
نموذج الحركة الجزيئية للمادّة Kinetic Molecular Model of Matter
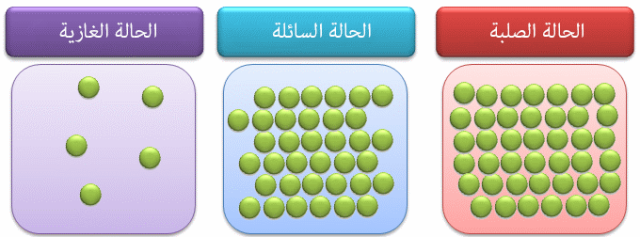
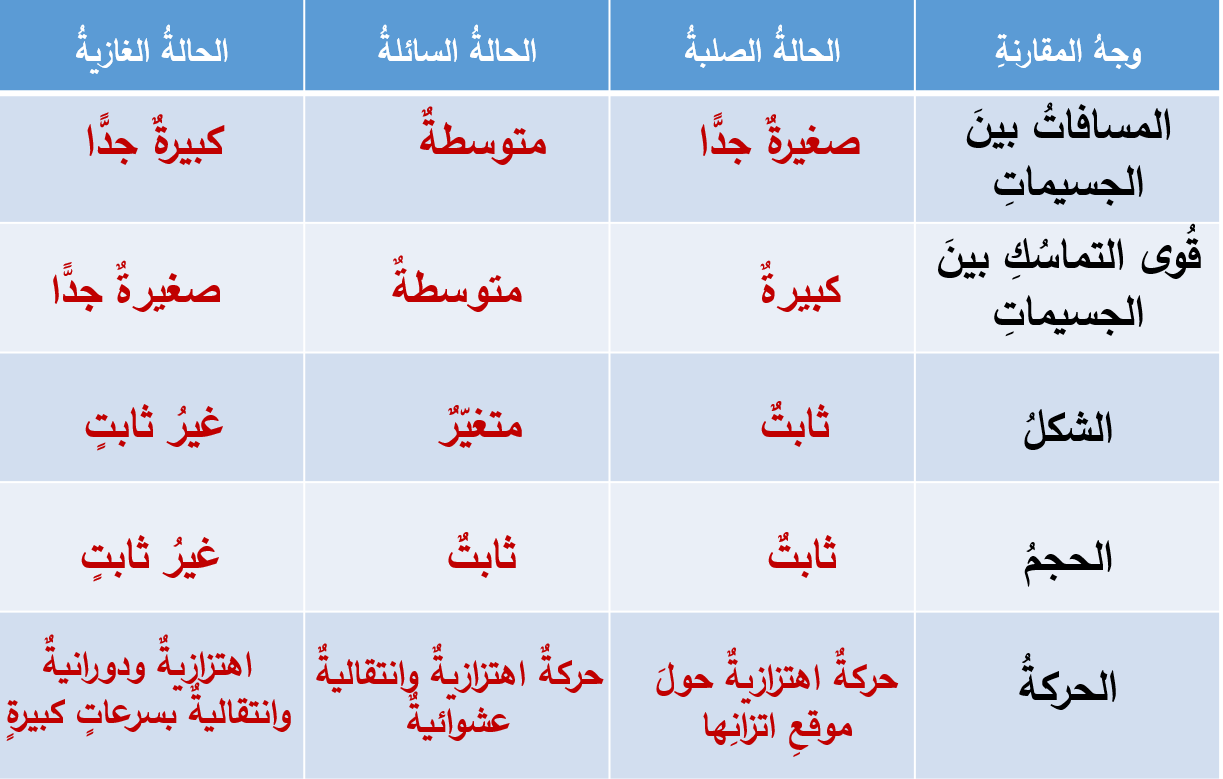
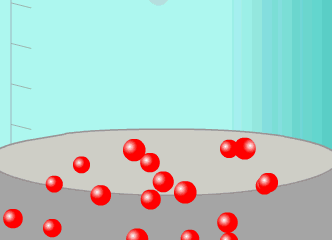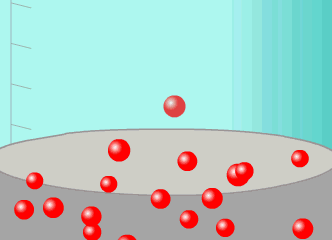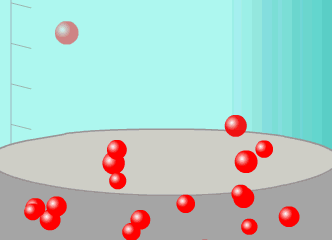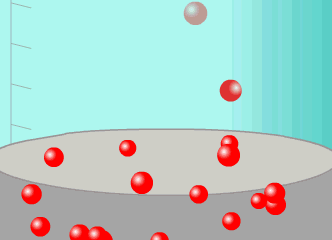
ينص نموذج الحركة الجزيئية على أن المواد جميعها، سواء أكانت صلبة أم سائلة أم غازية، تتكون من جسيمات (جزيئات
أو ذرات)، المسافات الفاصلة بينها صغيرة جدا في المواد الصلبة، ومتوسطة في السوائل، وكبيرة جدا في الغازات، أنظر إلى
الشكل. ويوجد بين جزيئات المادة الواحدة قوى تماسك تعمل على تماسكها وترابطها، تكون كبيرة في الحالة الصلبة،
ومتوسطة في الحالة السائلة، وصغيرة جدا في الغازات. كما هو موضح في كل من المشهد المتحرك والجدول التاليين:
درجة الحرارة والطاقة الحرارية Temperature and Thermal Energy
يستخدم مصطلح درجة الحرارة؛ للتعبير عن مدى سخونة الأجسام أو برودتها. وتحدد درجة الحرارة اتجاه انتقال الطاقة بين
الأجسام عند اتصالها حراريا؛ إذ تنتقل الطاقة تلقائيا من الجسم الأعلى درجة حرارة إلى الجسم الأدنى درجة حرارة. فمثلا،
عندما أضع يدي في طريق الماء المتدفق من الصنبور، أحدد أن الماء ساخن أو بارد بناء على الفرق في درجة الحرارة بينهما.
ويكون جسمان أو نظامان في حالة اتصال حراري Thermal contact عندما تنتقل الطاقة بينهما بطريقة أو أكثر من طرائق
انتقال الطاقة (التوصيل الحراري، والحمل الحراري، والإشعاع الحراري) نتيجة الاختلاف في درجتي حرارتيهما، وليس بالضرورة
وجود اتصال مباشر (تلامس) بينهما. ويقصد بالنظام System مجموعة الجسيمات أو الأجسام تحت الدراسة، وله حدود تفصله
عن المحيط الخارجي Surrounding إن الاعتماد على حاسة اللمس في تحديد درجة حرارة جسم أو نظام قد يكون مضللا أحيانا؛
لأنها تختلف من شخص إلى آخر، ولأن إحساسي بدرجة حرارة جسم تعتمد على توصيله الحراري، كما أنه يعطي عبارة وصفية
لدرجة الحرارة (مثلا: ساخن، بارد، أسخن، أبرد،...)؛ لذا، يستخدم مقياس درجة الحرارة Thermometer لقياس درجة الحرارة بشكل
أكثر دقة. وقد طور العلماء تدريجات مختلفة لقياس درجة الحرارة، من أشهرها:
- تدريج سلسيوس Celsius scale
-تدريج فهرنهايت Fahrenheit scale
- تدريج كلفن (المطلق) .Kelvin scale
للحصول على تعريف أدق لدرجة الحرارة، أدرس ما يحصل لجسيمات مادة على المستوى المجهري عندما يكسب طاقة أو يفقدها؛
إذ تمتلك هذه الجسيمات طاقة حركية، وطاقة كامنة ناتجة عن القوى المتبادلة بين جسيمات المادة، ألاحظ الشكل التالي:
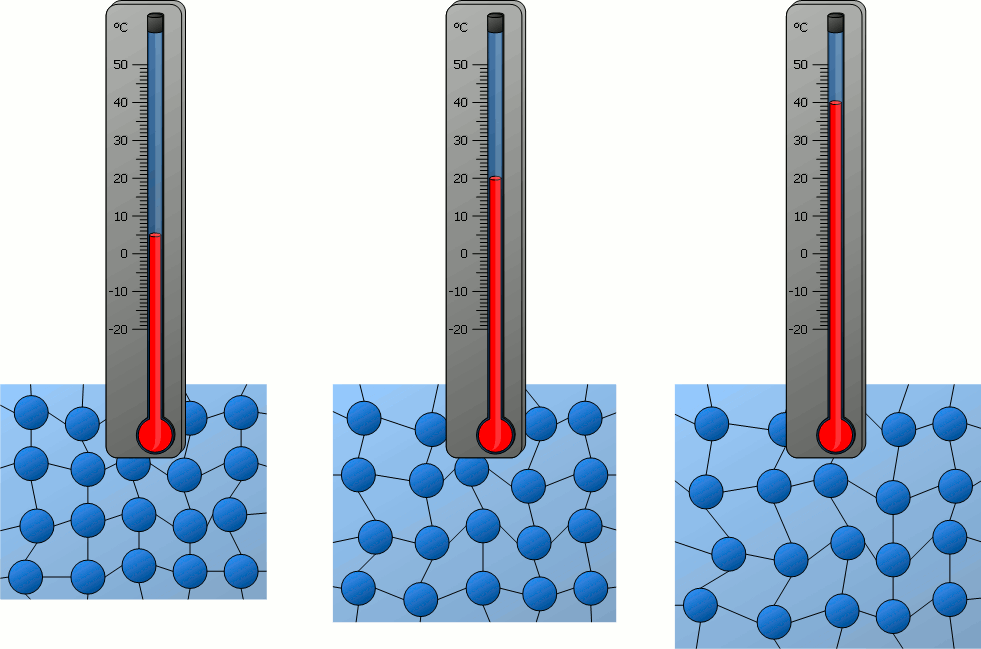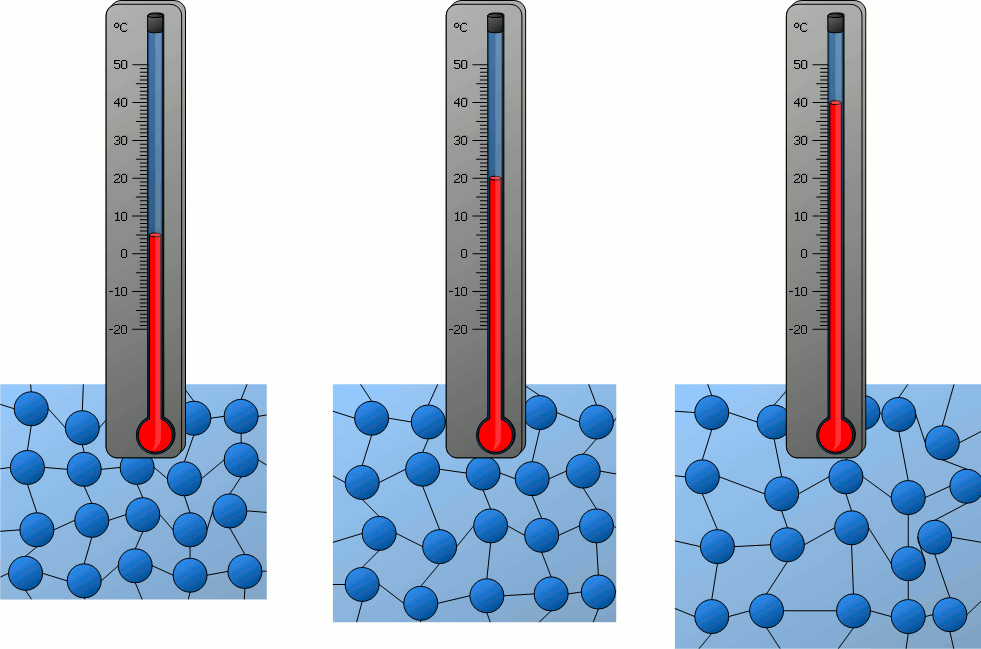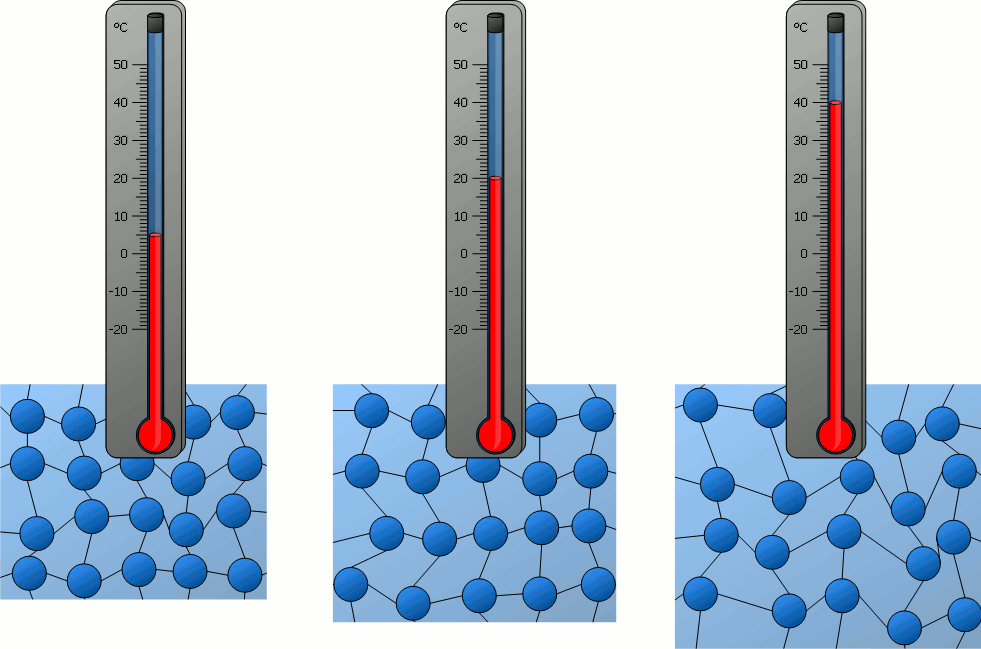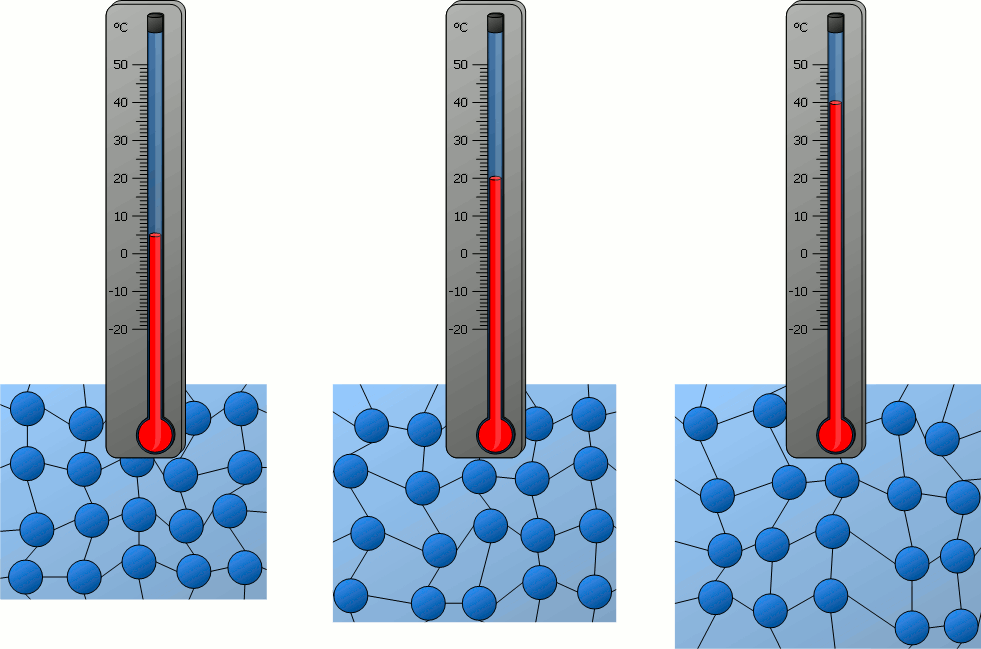
فعندما يكسب جسم طاقة يزداد مقدار سرعة حركة جسيماته العشوائية (الاهتزازية، الانتقالية،الدورانية)،
أي تزداد طاقاتها الحركية، فترتفع درجة حرارته.إذن:لا بد من وجود علاقة بين درجة حرارة الجسم والطاقة الحركية لجسيماته.
درجة الحرارة Temperature مقياس لمتوسط الطاقة الحركية للجسيمات المكونة لجسم ما.
الطاقة الحرارية Thermal energy تساوي مجموع الطاقة الحركية لجسيمات الجسم جميعها.
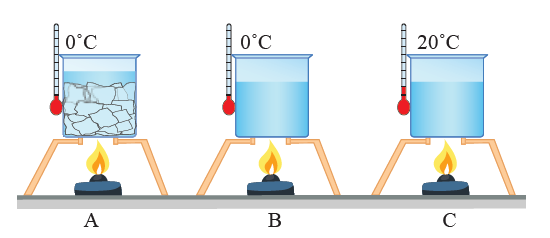
يوضح الشكل كأسي شاي متماثلين لهما درجة الحرارة نفسها (T)؛ لذا، يكون متوسط الطاقة الحركية للجسيمات الموجودة في
الكأسين متساويا. وبما أن كتلة الشاي (عدد جسيماته) في الكأس الموضح في الشكل (أ) أكبر منها في الكأس الموضح في الشكل (ب)؛
فإن الطاقة الحرارية للشاي في الشكل (أ) هي الأكبر، على الرغم من أن لهما درجة الحرارة نفسها.

الحرارة والطاقة الحرارية Heat and Thermal Energy
عندما يفقد جسم طاقة أو يكسبها؛ تتغير درجة حرارته ما لم تتغير حالته الفيزيائية، أي إن طاقته الحرارية تتغير. فعندما يكون
جسمان (نظامان) في حالة اتصال حراري تنتقل الطاقة من الجسم الأعلى درجة حرارة إلى الجسم الأدنى درجة حرارته، وتسمى
هذه الطاقة المنتقلة الحرارة Heat ، ورمزها Q
استخدم العلماء وحدات قياس مختلفة لقياس الحرارة خلال فترة تطور مفهومها، ولا يزال بعضها مستخدما، ومن أشهرها:
السعر Calorie وهو كمية الطاقة اللازمة لرفع درجة حرارة (1 g) من الماء بمقدار (1 ˚C)، وتستخدم هذه الوحدة عادة للدلالة على
مقدار ما يحويه الغذاء من طاقة. أما وحدة قياس الحرارة حسب النظام الدولي للوحدات فهي الجول (joule (J ، وهي نفسها
وحدة قياس أشكال الطاقة الأُخرى والعلاقة الرياضية التي تربط السعر بالجول هي 1 cal = 4.186 J.
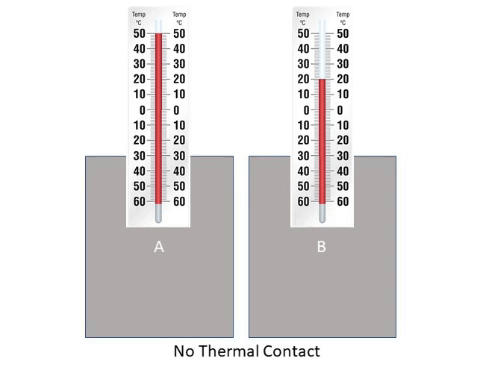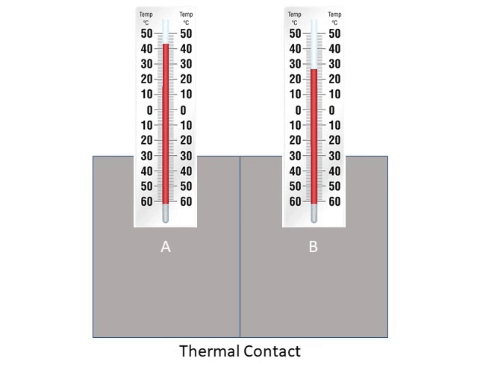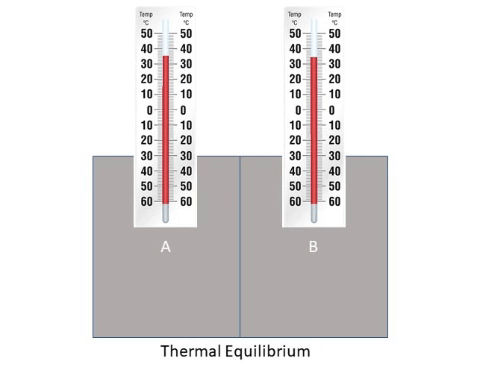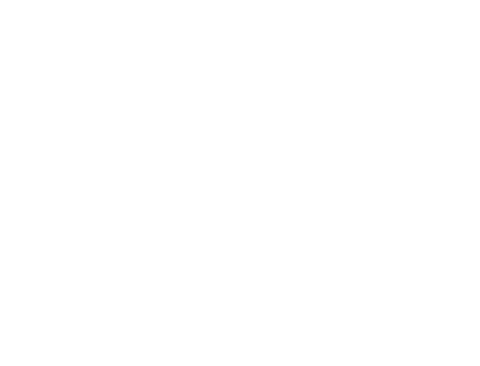
الاتّزان الحراري Thermal Equilibrium
يوضح الشكل جسمين مختلفين في درجتي حرارتيهما؛ إذ درجة حرارة الجسم A أكبر منها للجسم B، وهذا يعني أن جسيمات
الجسم A لها متوسط سرعة أكبر. ومن ثم، فإن متوسط طاقتها الحركية أكبر منها للجسم B. وعند اتصال الجسمين حرار ياً
تنتقل الطاقة تلقائيا من الجسم الأعلى درجة حرارة إلى الجسم الأدنى درجة حرارة؛ إذ تصطدم الجسيمات المتحركة بسرعة كبيرة
في الجسم A بالجسيمات المتحركة بسرعة أقل منها في الجسم B، فتنتقل الطاقة من الجسم A إلى الجسم B نتيجة هذه التصادمات،
ما يعني ازدياد الطاقة الحركية لجسيمات الجسم B ونقصانها لجسيمات الجسم A. ويستمر انتقال الطاقة بين الجسمين حتى يصبح
لهما درجة الحرارة نفسها، وعندها يتساوى معدلا انتقال الطاقة بين الجسمين، ويكونان في حالة اتزان حراري Thermal equilibrium ،
ويكون صافي الطاقة المنتقلة بين الجسمين صفرا، أنظر إلى الشكل التالي.
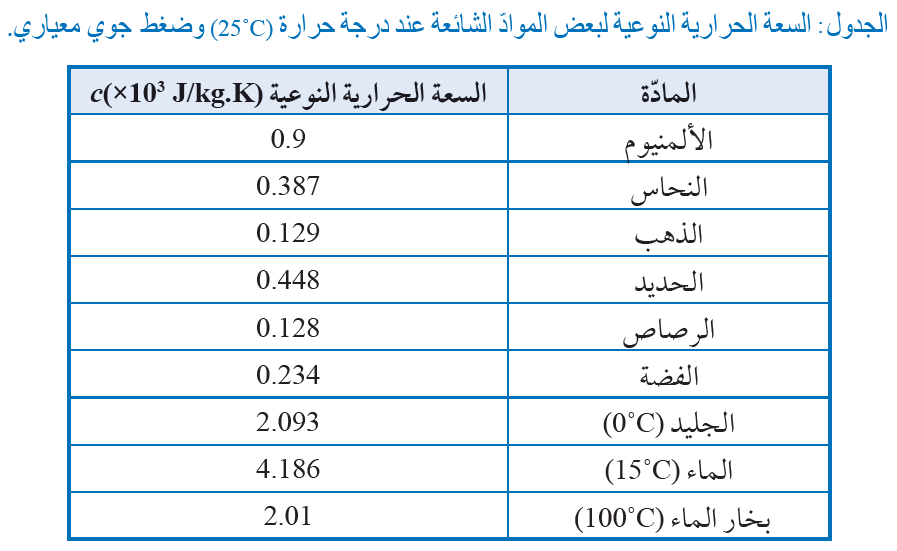
السعة الحرارية النوعية Specific Heat Capacity
تختلف الكتل المتساوية المصنوعة من مواد مختلفة في مقدار تغير درجة حرارتها، عند اكتسابها أوفقدها كمية الطاقة نفسها،
فبعضها ترتفع درجة حرارته بمقدار أقل من غيره على الرغم من تزويدها بكميات متساوية من الطاقة. وأستنتج من ذلك أن نوع
مادة الجسم يؤثر في مقدار التغير في درجةحرارته عند تسخينه أو تبريده؛ إذ توجد خاصية للمادة تعتمد على طبيعتها، وتختلف من
مادة إلى أخر ى نتيجة اختلاف كيفية حركة ذراتها وجزيئاتها على المستوى المجهري، واختلاف عدد ذراتها أو جزيئاتها في وحدة الكتل،
إضافة إلى اختلافها في مقدرتها على توصيل الطاقة حسب تراص الذرات وترابطها. تسمى هذه الخاصية السعة الحرارية النوعية ،
(Specific heat capacity) وتعرف بأنها كمية الطاقة اللازمة لرفع درجة حرارة ( 1 kg ) من المادة بمقدار ( 1˚C ) أو (1 K)، ورمزها c،
وتقاس بوحدة J/kg.K حسب النظام الدولي للوحدات. وهي تعتمد على نوع مادة الجسم فقط؛ فهي تختلف من مادة إلى أخرى، ولا
تعتمد على كتلة الجسم أو حجمه. وبناء على السعة الحرارية النوعية؛ يمكنني تفسير سبب ارتفاع درجة حرارة الماء في المسبح
بمقدار أقل من ارتفاع درجة حرارة الخرسانة المحيطة به، بأنه نتيجة الاختلاف في السعة الحرارية النوعية بينهما.فالسعة الحرارية
النوعية للماء (4186 J/kg.K ) تقريبا، بينما السعة الحرارية النوعية للخرسانة ( 880 J/kg.K ) تقريبا. وهذا يعني أن(1 kg) ) من الخرسانة
يحتاج فقط إلى ( 880 J ) من الطاقة لرفع درجة حرارته بمقدار ( 1 K )، بينما يحتاج ( 1 kg ) من الماء إلى ما يقارب خمسة أضعاف هذه
الطاقة لرفع درجة حرارته بمقدار ( 1 K )؛ لذا ترتفع درجة حرارة الخرسانة ذات السعة الحرارية النوعية الأصغر بشكل أسرع من الماء ذي
السعة الحرارية النوعية الأكبر على الرغم من تزويدهما بمعدل الطاقة نفسه لكل وحدة مساحة، كما أنها تبرد بشكل أسرع من الماء عند
فقدهما معدل الطاقة نفسه.إضافة إلى تأثير نوع مادة الجسم (السعة الحرارية النوعية) في مقدار التغير في درجة حرارته، فإن لكل من
كتلته وكمية الطاقة التي يزود بها تأثير أيضا في مقدار هذا التغير. أربط هذه المتغيرات معاً عن طريق تعريف السعة الحرارية النوعية
رياضيا كما يأتي: إذا ز ود جسم كتلته ( m) بطاقة مقدارها ( Q)، وتغيرت درجة حرارته بمقدار ( ΔT )، فإنه يمكن التعبير عن السعة الحرارية النوعية(c)
لمادة الجسم رياضياً بالعلاقة الآتية:
تستخدم هذه العلاقة لحساب كمية الطاقة التي يكتسبها جسم أو يفقدها عند تغير درجة حرارته -التي تساوي التغير في طاقته الحرارية ( ΔE )- كما يأتي:
ألاحظ أنه إذا اكتسب الجسم طاقة؛ فإن كلا من ( Q) و ( ΔT ) تكونان موجبتين. أما إذا فقد الجسم طاقة فإن كلا من ( Q) و ( ΔT ) تكونان سالبتين.
|
وضعت هناء قطعة رصاص كتلتها ( 250 g) ودرجة حرارتها ( 20˚C )، على مصدر حراري زودهابكمية طاقة مقدارها ( 2.6 kJ ). إذا كانت السعةالحرارية النوعية للرصاص ( cPb = 130 J/kg.K ) تقريبا، فأحسب مقدار ما يأتي: .أ . التغير في الطاقة الحرارية لقطعة الرصاص (ΔEPb) ب. درجة حرارة قطعة الرصاص النهائية.
|
الحل أ . مقدار التغير في الطاقة الحرارية لقطعة الرصاص يساوي كمية الطاقة التي اكتسبتها؛ إذ لا يوجد تغير في الحالة الفيزيائية للرصاص. ΔEPb = Q = 2.6 × 103 J ب. أستخدم العلاقة الآتية لحساب درجة حرارة قطعة الرصاص النهائية.
|
|
سخان كهربائي قدرته ( 1.5 kW )، يحتوي على ( 20 kg ) ماء درجة حرارته ( 15˚C )، يراد تسخينه إلى درجة حرارة ( 65˚C ). بافتراض تحول الطاقة الكهربائية كاملة إلى طاقة حرارية اكتسبهاالماء، الحرارية النوعية للماء ( cw = 4200 J/kg.K ) تقريبا، أحسب مقدار ما يأتي: أ . كمية الطاقة التي اكتسبها الماء. ب. الزمن الذي يستغرقه السخان في تسخين الماء. |
الحل أ . تحول مقاومة السخان الطاقة الكهربائية إلى طاقة حرارية يكتسبها الماء، وترفع درجة حرارته.
ب. العلاقة التي تربط القدرة بالشغل والزمن، P = الطاقة الكهربائية التي يستهلكها السخان، تساوي كمية الطاقة التي يكتسبها الماء.
|
|
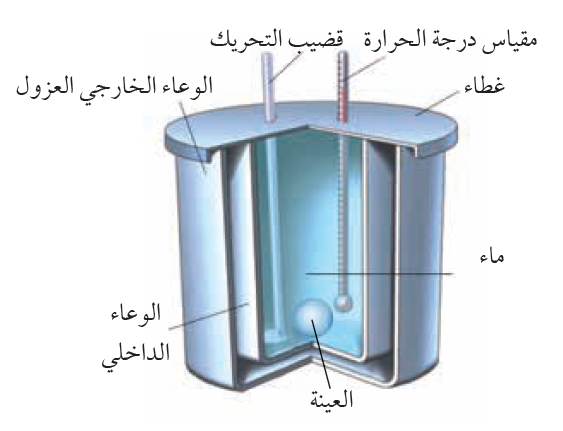
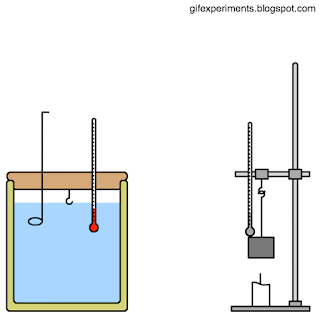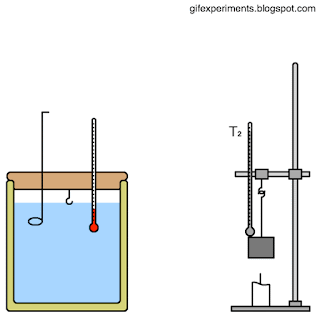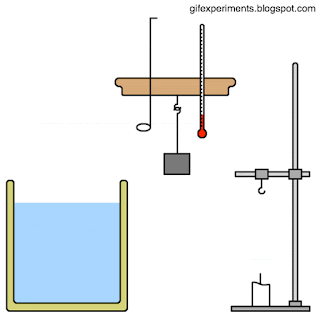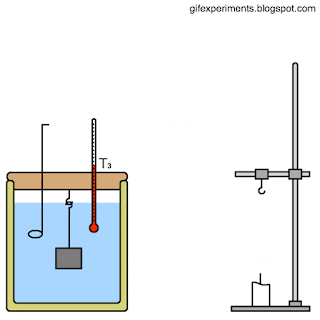
المسعّر الحراري Calorimeter كتلتها، والتغير في درجة حرارتها، وكمية الطاقة التي تكتسبها أو تفقدها. يمكن قياس الكتلة والتغير في درجة الحرارة بطريقة مباشرة، أما قياس كمية الطاقة فيتطلب عدة إجراءات وخطوات. بما أن السعة الحرارية النوعية للماء معروفة؛ فيمكنني قياس كمية الطاقة المتبادلة بين عينة من مادة مجهولة السعة الحرارية النوعية وكمية محددة من الماء. إذ تسخن عينة معلومة الكتلة من مادة معينة إلى درجة حرارة محددة، ثم توضع في وعاء معزول حراريا يحتوي على ماء بارد معلوم الكتلة ودرجة الحرارة، ثم تقاس درجة حرارة الماء بعد وصول النظام المكون من الماء والعينة والوعاء إلى حالة الاتزان الحراري، فيمكنني حساب السعة الحرارية النوعية لتلك المادة. تسمى الأداة التي يحدث داخلها تبادل الطاقة الحرارية المسعر الحراري Calorimeter . أنظر إلى الشكل الذي يوضح مكونات مسعر حراري بسيط معزول حراريا، بحيث لا يحدث تبادل حراري بينه وبين المحيط الخارجي قدر الإمكان. يوضح الشكل نظاما يتكون من عينة ( x) مرتفعة درجة الحرارة (Tx) من مادة مجهولة السعة الحرارية النوعية ( cx ) موضوعة في ماء بارد؛ إذ تنتقل الطاقة تلقائيا داخل النظام من الجزء الأعلى درجة حرارة إلى الجزء الأدنى درجة حرارة، حتى يصبحا في حالة اتزان حراري، ويكون لهما درجة الحرارة النهائية ( Tf ) نفسها. |
|
إذا كان النظام مغلقا ومعزولا حراريا، بحيث لا تدخل طاقة أو مادة إلى النظام ولا تغادره، يبقى
المجموع الكلي للطاقة في النظام ثابتا. وبافتراض النظام مكون من العينة ( x) والماء (بإهمال الطاقة
التي تكتسبها مادة المسعر) فتكون الطاقة الكلية للنظام ثابتة، أي أن: Ex + Ew = constant
وبما أن النظام مغلق ومعزول حراريا؛ فإ ّ ن التغير الكلي في طاقة النظام يجب أن يساوي صفرا، أي إن:
ΔEx + ΔEw = 0
ΔEx = -ΔEw
لا يوجد تغير في الحالة الفيزيائية لجزأي النظام؛ لذا، يكون التغير في طاقة كل منهما ناتج عن التغير فيطاقته الحرارية فقط. ألاحظ أن
التغير في الطاقة الحرارية لأحد جزأي النظام موجب، فترتفع درجة حرارته، بينما يكون التغير في الطاقة الحرارية لجزء النظام الآخر سالبا،
فتنخفض درجة حرارته. وبما أن النظام مغلق ومعزول ولا يبذل شغل عليه؛ فإن التغير في الطاقة الحرارية لجزأي النظام ناتج عن انتقال
الطاقة بينهما، ومقداره يساوي كمية الطاقة المنتقلة ( Q)؛ لذا، يمكن التعبير عن تغير الطاقة الحرارية لكل من جزأي النظام بالعلاقة الآتية:
وبما أن كمية الطاقة التي تفقدها العينة Qhot) x ) تساوي كمية الطاقة التي يكتسبها الماء البارد ( Qcold )، وباستخدام مبدأ حفظ الطاقة؛
يمكنني التعبير رياضيا عما سبق كما يأتي:
ولأي عدد من الأجسام (… , A, B, C ) في حالة اتصال حراري في نظام مغلق ومعزول ومتزن حراريا، يمكن كتابة معادلة انتقال
الطاقة بينها كما يأتي:
 مثال محلول
مثال محلول
مسعر حراري يحتوي على ماء كتلته ( 0.4kg) ودرجة حرارته ( 20oC)، وضعت فيه كرة فلزية كتلتها ( 0.05kg ) ودرجة حرارتها
( 200oC). إذا كانت درجة الحرارة النهائية للنظام عند الاتزان الحراري (22.4oC )، والنظام مغلق ومعزول وبإهمال الطاقة التي
تكتسبها مادة المسعر، فأحسب مقدار ما يأتي:
أ . التغير في الطاقة الحرارية للماء.
ب. السعة الحرارية النوعية لمادة الكرة الفلزية.
الحل
أ. تفقد الكرة الفلزية الساخنة كمية من الطاقة يكتسبها الماء البارد، حتى يصلا إلى حالة الاتزان الحراري.
أحسب التغير في طاقته الحرارية كما يأتي:
التغير في الطاقة الحرارية للماء موجب، أي إنه اكتسب طاقة.
:ب. أستخدم معادلة انتقال الطاقة الآتية
:(cb ) وبالحل بالنسبة إلى
حالات المادّة States of Matter
تصنّف المواد حسب حالتها الفيزيائية إلى: صلبة، أو سائلة، أو غازية. تسمى هذه الحالات الثلاث الحالات الفيزيائية
للمادة، وهي الحالات الفيزيائية الأكثر شيوعا للمادة. وقد تعرفت خصائص كل منها عند دراسة نموذج الحركة
الجزيئية في بداية الدرس. يوجد حالة فيزيائية رابعة للمادة تسمى البلازما ( Plasma )، عند درجات الحرارة العالية جدا فقط؛ لذا، لن ندرسها.
يحدث غالبا تغير في درجة حرارة المادة عندما تنتقل الطاقة بينها وبين محيطها الخارجي. ولكن، توجد حالات لا يؤدي فيها نقل
الطاقة إلى تغير في درجة الحرارة. ويحدث هذا عندما تتغير الخصائص الفيزيائية للمادة من حالة فيزيائية إلى حالة أخرى. يشار إلى
هذا التغير عادة باسم تغير الحالة الفيزيائية Phase change ، يوجد تغيران شائعان في الحالة الفيزيائية للمادة، هما: التغير بين
الحالتين الصلبة والسائلة (الانصهار، والتجمد)، والتغير بين الحالتين السائلة والغازية (التصعيد، والتكاثف). تتضمن هذه
التغييرات في الحالة الفيزيائية للمادة تغيرا في الطاقة الكامنة (الوضع) للمادة، من دون تغير في درجة حرارتها.
التغير بين الحالتين: الصلبة والسائلة Change of State Between Solid and Liquid
عند تزويد مادة صلبة بالطاقة؛ ترتفع درجة حرارتها حتى تصل إلى درجة حرارة محددة تثبت عندها، على الرغم من استمرار
تزويدها بالطاقة، وألاحظ أن الحالة الفيزيائية للمادة الصلبة تبدأ في التغير وتتحول إلى الحالة السائلة عند درجة الحرارة
نفسها تسمى درجة الحرارة التي تتغير عندها الحالة الفيزيائية للمادة من الحالة الصلبة إلى الحالة السائلة درجة الانصهار
Melting point، وهي خاصية فيزيائية للمادة النقية، وتتغير من مادة إلى أخرى حسب قوى الترابط بين جسيمات المادة.وهي
نفسها درجة حرارة التجمد Freezing point التي تتغير عندها الحالة الفيزيائية للمادة من الحالة السائلة إلى الحالةالصلبة.
الحرارة النوعية الكامنة للانصهار Specific Latent Heat of Fusion
يتسبب تسخين مادة ما في زيادة الطاقة الحركية لجسيماتها، فتزداد درجة حرارتها. أما في أثناء تغير الحالة الفيزيائية للمادة
عند درجة الانصهار، فإن تسخينها يزيد من الطاقة الكامنة للجسيمات، مع بقاء طاقتها الحركية ثابتة؛ لذا، لن تزداد درجة
حرارتها. لذا فإن نقل الطاقة إلى مادة ما؛ لا يؤدي دائما إلى زيادة درجة حرارتها، ففي بعض الأحيان يغير حالتها الفيزيائية.
تعرف الحرارة النوعية الكامنة للانصهار Specific latent heat of fusion بأنها كمية الطاقة اللازمة لتحويل ( 1 kg ) من المادة
من الحالة الصلبة إلى الحالة السائلة من دون تغيير درجة حرارتها، رمزها ( Lf ) ووحدة قياسها (J/kg) حسب النظام الدولي للوحدات. وهي خاصية للمادة النقية لا تعتمد على كتلتها. فمثلا، الحرارة النوعية الكامنة لانصهار الجليد تساوي
( 3.33x105J/kg )، وهذا يعني أنه يلزم طاقة مقدارها ( 3.33x105J/kg ) لتحويل (1kg) من الجليد عند درجة الانصهار ( 0oC ) من الحالة الصلبة إلى الحالة السائلة عند درجة الحرارة نفسها.
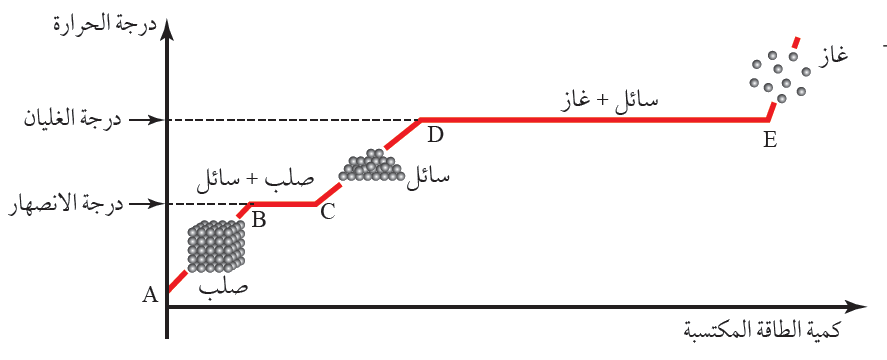
فمثلا، يوضح الشكل تمثيلا بيانيا لتغير درجة حرارة جسم من مادة معينة بتغير كمية الطاقة المكتسبة، كما
يوضح ثبات درجة حرارة مادة الجسم في أثناء انصهارها عند درجة الانصهار. وألاحظ من الشكل أن الجسم
الصلب قد زود بكمية من الطاقة فارتفعت درجة حرارته بين النقطتين A و B حتى وصلت إلى درجة
الانصهار للمادة المصنوع منها، كما ألاحظ أن درجة حرارة مادة
الجسم تثبت بين النقطتين B و C على الرغم من استمرار تزويده بالطاقة؛ إذ تؤدي الطاقة المكتسبة إلى انصهار
مادة الجسم عند درجة الانصهار؛ إذ تستخدم الطاقة المكتسبة في تكسير الروابط بين جسيمات الحالة الصلبة،
بحيث تصبح حرة وتتحرك مبتعدة عن بعضها. وبعد انصهار مادة الجسم كاملة وتحولها إلى سائل تؤدي أي
كمية طاقة مكتسبة إلى رفع درجة حرارة المادة السائلة، ويتضح ذلك بين النقطتين C و .D.
التغير بين الحالتين: السائلة والغازية Change of State Between Liquid and Gas
باستمرار تسخين مادة سائلة ترتفع درجة حرارتها حتى تثبت عند درجة حرارة محددة، تبدأ عندها حالتها الفيزيائية
بالتغير إلى الحالة الغازية عند درجة الحرارة نفسها. تسمى درجة الحرارة التي تتغير عندها الحالة الفيزيائية للمادة
من الحالة السائلة إلى الحالة الغازية درجة الغليان Boiling point ، وهي خاصية فيزيائية للمادة النقية، تتغير من
مادة إلى أخرى حسب قوة الترابط بين جسيماتها. أما التكاثف Condensation فهو تغير الحالة الفيزيائية للمادة
من الحالة الغازية إلى الحالة السائلة. وتثبت درجة حرارة المادة في أثناء غليانها على الرغم من استمرار تزويدها
بالطاقة، وكي أعرف ما يحدث لهذه الطاقة.
الحرارة النوعية الكامنة للتصعيد Specific Latent Heat of Vaporization
يتطلب تغيير الحالة الفيزيائية لمادة من الحالة السائلة إلى الحالة الغازية تزويدها بالطاقة؛ من أجل التغلب على
القوى التي تربط بين جزيئاتها. فمثلا، يحتاج الماء في أثناء غليانه عند (100˚C ) إلى استمرار تزويده بالطاقة لاستمرار
غليانه وتحوله إلى بخار. في أثناء تغير الحالة الفيزيائية للمادة عند درجة الغليان، تستخدم الطاقة التي تز ود للسائل
في أثناء غليانه في كسر قوى الترابط بين الجزيئات التي تبقي جزيئات السائل معًا، ما يؤدي إلى زيادة المسافة
الفاصلة بينها؛ لذا، يزيد التسخين من الطاقة الكامنة للجسيمات وليس طاقتها الحركية، فتثبت درجة الحرارة عند
درجة الغليان ولا تزداد. وتستخدم هذه الطاقة أيضا لبذل شغل ضد القوة الناتجة عن ضغط الغلاف الجوي، بحيث تمكن الجسيمات من مغادرة سطح السائل،
تسمى كمية الطاقة اللازمة لتحويل ( 1kg) من المادة من الحالة السائلة إلى الحالة الغازية دون تغيير درجة حرارتها
الحرارة النوعية الكامنة للتصعيد Specific latent heat of vaporization ، ورمزها (Lv) ووحدة قياسها ( J/kg ) حسب
النظام الدولي للوحدات. وهي خاصية للمادة النقية لا تعتمد على كتلتها. فمثلا، الحرارة النوعية الكامنة لتصعيد
الماء تساوي ( 2.26x106J/kg)، وهذا يعني أنه يلزم طاقة مقدارها ( 2.26x106J/kg ) لتحويل 1kg ) من الماء عند درجة
الغليان ( 100oC ) من الحالة السائلة إلى الحالة الغازية (بخار الماء) عند درجة الحرارة نفسها.
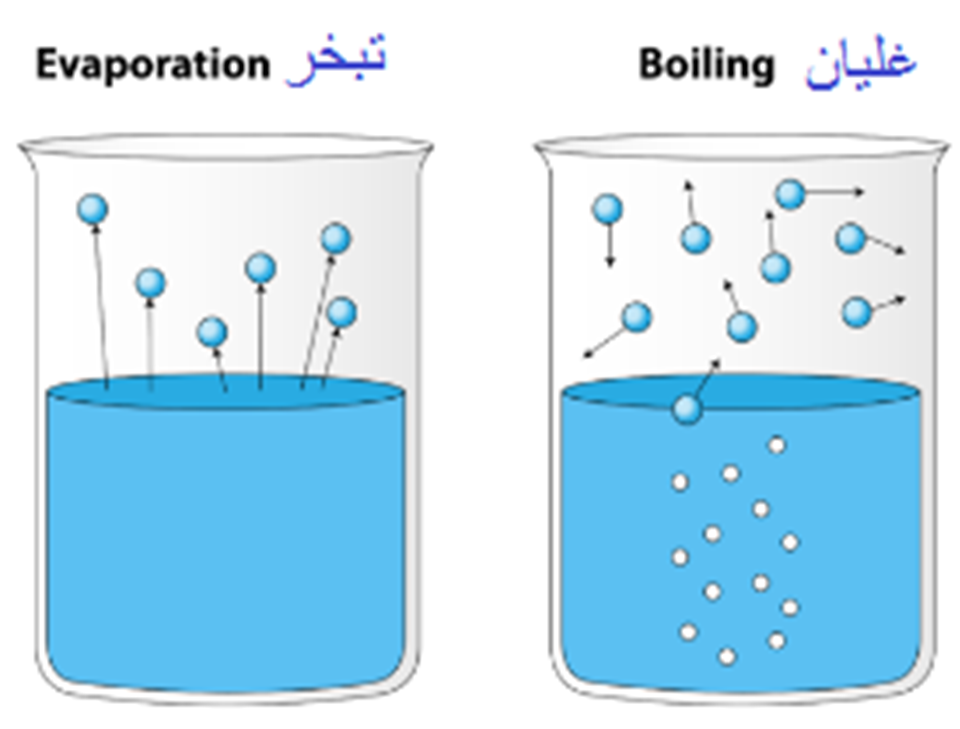
التبخّر والغليان Evaporation and Boiling
يخلط بعض الطلبة بين مفهومي التبخر والغليان؛ إذ يوجد فرق بينهما على الرغم من أنهمايمثلان تغير حالة
المادة من الحالة السائلة إلى الحالة الغازية، إلا أن التبخر Evaporation يحدث عند درجات الحرارة جميعها، وهي
عملية بطيئة تحدث للجزيئات الموجودة على سطح السائل كونها أقل ارتباطا ببقية جزيئات السائل مقارنة بارتباط
الجزيئات داخل السائل؛ فعندما يمتلك الجزيء طاقة حركية كافية تكون عادة أكبر من متوسط الطاقة الحركية
لبقية جزيئات السائل فإنه يتبخر، أنظر إلى الشكل فمثلا، تسخن أشعة الشمس الماء على السطح، ويكون لبعض
الجزيئات الموجودة على سطح الماء طاقة حركية أكبر من غيرها، وإذا كانت هذه الطاقة كافية لكسر قوى الترابط
بين جزيئاته فإنها ستتبخر وتغادر سطح الماء؛ على الرغم من أن درجة حرارته أقل من درجة الغليان، أنظر إلى
الشكل. أما الغليان Boiling فهو عملية تبخر سريعة تحدث عندما يساوي ضغط البخار الضغط الجوي، وهي
تحدث عند درجة حرارة محددة وهي درجة الغليان؛ إذ تمتلك جزيئات السائل طاقة كافية لمغادرة السائل بكميات
كبيرة بما فيها الجزيئات داخلة، فيكون التبخر من أجزاء السائل جميعها، وتظهر الفقاعات تحت سطحه؛ إذ تعمل الطاقة
المضافة على رفع الطاقة الكامنة من دون تغيير درجة الحرارة في أثناء الغليان، فتتكسر الروابط بينها، ما يمكنها
من الحركة بحرية أكبر. ومن ثم، تتحول إلى الحالة الغازية، وتخرج من السائل على شكل فقاعات. أنظر إلى الشكل
التالي:
الشكل: التخر والغليان
|
يوضح الشكل انصهار مكعبات جليد كتلتها ( 2kg) بدرجة حرارة ( 0oC ) إلى ماء سائل بدرجة حرارة ( 0oC ) وتوضحها المرحلة: ( A) إلى ( B)، ثم رفع درجة حرارة الماء السائل من ( 0oC ) إلى ماء سائل بدرجة حرارة ( 20oC ) وتوضحها المرحلة: ( B) إلى ( C). إذا علمت أن السعة الحرارية النوعية للماء ( 4200J/kg.K )،والحرارة النوعية الكامنة لانصهار الجليد ( 3.33x105J/kg )، ومستعينًا بالشكل والبيانات المثبتة عليه، أجيب عما يأتي: الحل: أ. استنفدت الطاقة المكتسبة في تكسير الروابط بين جزيئات الحالة الصلبة في بلورات الجليد، ولم تؤدِّ إلى زيادة الطاقة الحركية لجزيئات الماء، بل ازدادت طاقتها الكامنة. ب. أحسب كمية الطاقة اللازمة لصهر الجليد كما يأتي: ج. أحسب كمية الطاقة اللازمة لرفع درجة حرارة الماء في المرحلة من B إلى C كما يأتي: |
 |
|
كمية من بخار الماء كتلتها ( 5نل ) ودرجة حرارتها ( 130oC )، يراد تبريدها وتحويلها إلى سائل بدرجة حرارة(50oC). إذا علمت أن السعة الحرارية النوعية للبخار ( 2010J/kg.K )، والسعة الحرارية النوعية للماء (4200J/kg.K )، والحرارة النوعية الكامنة لتصعيد الماء ( 2.26x106J/kg )، أحسب ما يأتي: أ. كمية الطاقة المنطلقة ( Q1 ) عند تبريد بخار الماء من ( 130oC ) إلى ماء بدرجة حرارة ( 100oC ). ب. كمية الطاقة المنطلقة ( Q2 ) عند تبريد الماء من ( 100oC ) إلى ماء بدرجة حرارة ( 50oC). ج. كمية الطاقة الكلية المنطلقة عند تبريد بخار الماء من ( 130OC) إلى ماء بدرجة حرارة ( 50oC ). الحل أ. يوجد تغير في الحالة في أثناء التبريد، فأحسب كمية الطاقة المنطلقة على مرحلتين: الأولى: عند تبريد البخار من ( 130oC ) إلى بخار بدرجة حرارة ( 100oC ). الثانية: عند تغير الحالة عند تكاثف البخار وتحوله إلى ماء سائل عند درجة الغليان نفسها، وهي ( 100˚C ). لأنها طاقة منطلقة، علما بأن كمية الطاقة المنطلقة تساوي كمية الطاقة المكتسبة في أثناء تغير الحالة؛ أي ستنطلق كمية طاقة مساوية لكمية الطاقة التي استنفدت في التصعيد.
ج. كمية الطاقة الك ّ لية المنطلقة ( Qtotal ) عند تبريد بخار الماء من ( 130oC) إلى ماء بدرجة حرارة ( 50oC) تساوي كمية الطاقة المنطلقة عند تبريده من بخار بدرجة حرارة (130oC) إلى بخار بدرجةحرارة ( 100oC )، مضافا إليها كمية الطاقة المنطلقة عند تكاثفه عند درجة الغليان، مضافا إليها كمية الطاقة المنطلقة عند تبريد الماء من درجة حرارة ( 100oC) إلى درجة حرارة ( 50oC )؛ لذا، فهي تساوي ناتج الجمع الجبري للكميتين ( Q1 ) و ( Q2 )، وأحسبها كما يأتي: |
 مثال محلول
مثال محلول