تركيز المحلول
يعد مقياسًا للتعبير عن كمية المادة المذابة في كمية محدد من المذيب أو المحلول.
يعبر عنه وصفيًا: مخفف أو مركز

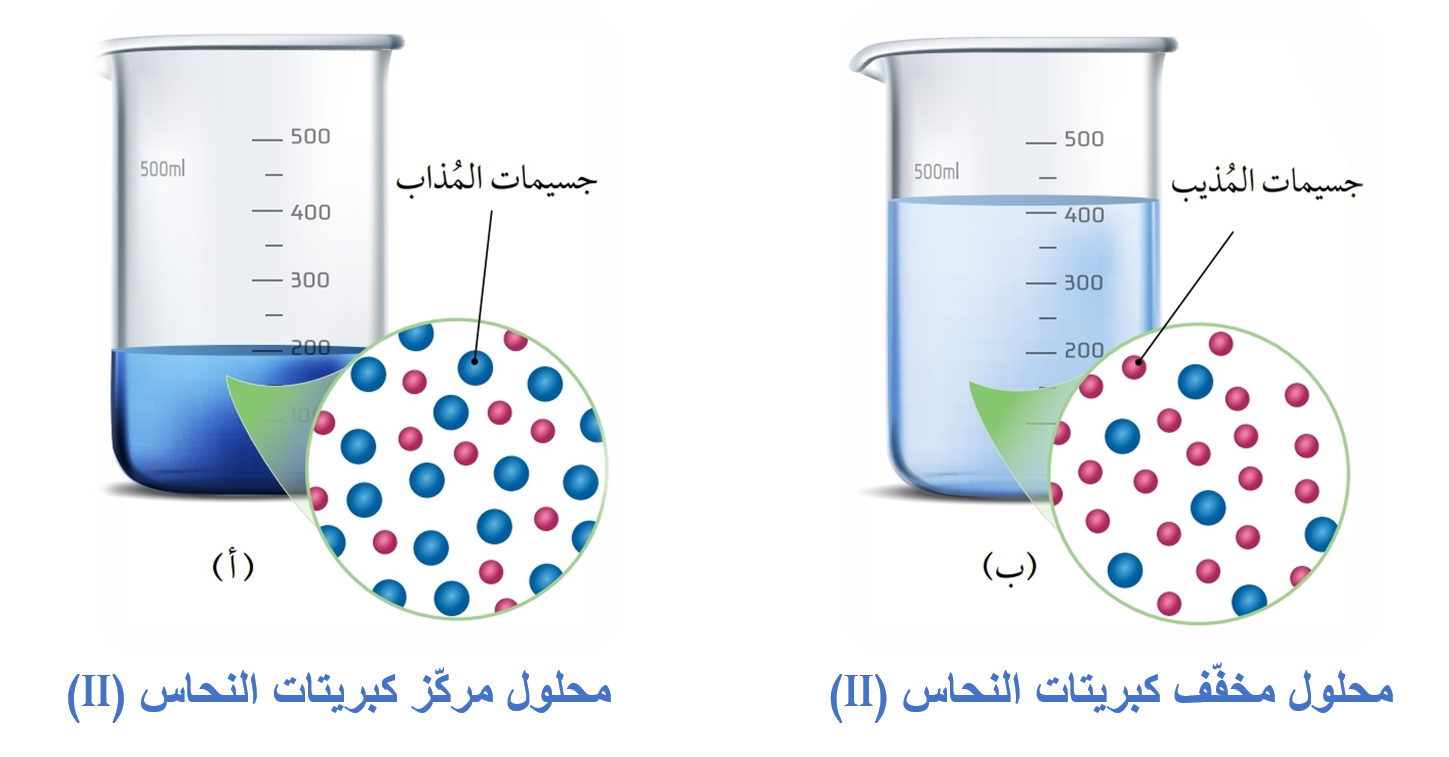
يمكن التعبير عن التركيز كميًا بوصفه نسبة بين كمية المذاب إلى كمية المذيب أو المحلول.
♦ طرق التعبير عن التركيز:
1- الكسر المولي.
2- النسبة المئوية الكتلية.
3- النسبة المئوية الحجمية.
4- التركيز المولاري.
5- التركيز المولالي.
1- الكسر المولي:
"نسبة عدد مولات المادة المذابة أو المذيب في المحلول إلى عدد المولات الكلية للمذاب و المذيب"
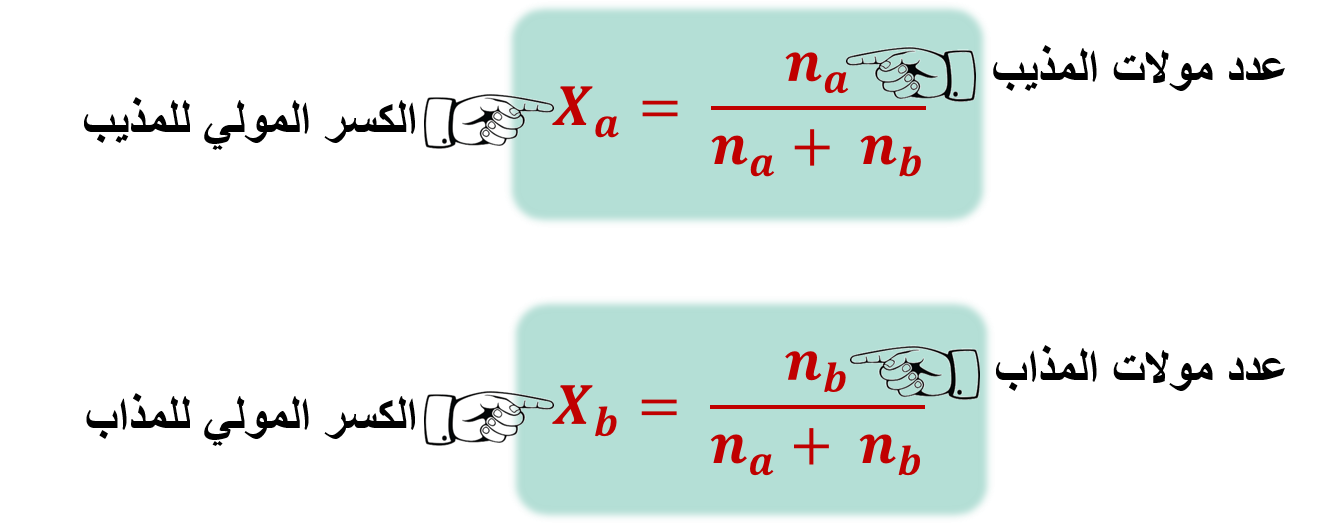
مثال: احسب الكسر المولي للماء (H2O) و لكلوريد الصوديوم (NaCl) في محلول يحتوي على 0.75mol من كلوريد الصوديوم و 5mol من الماء.
الحل:
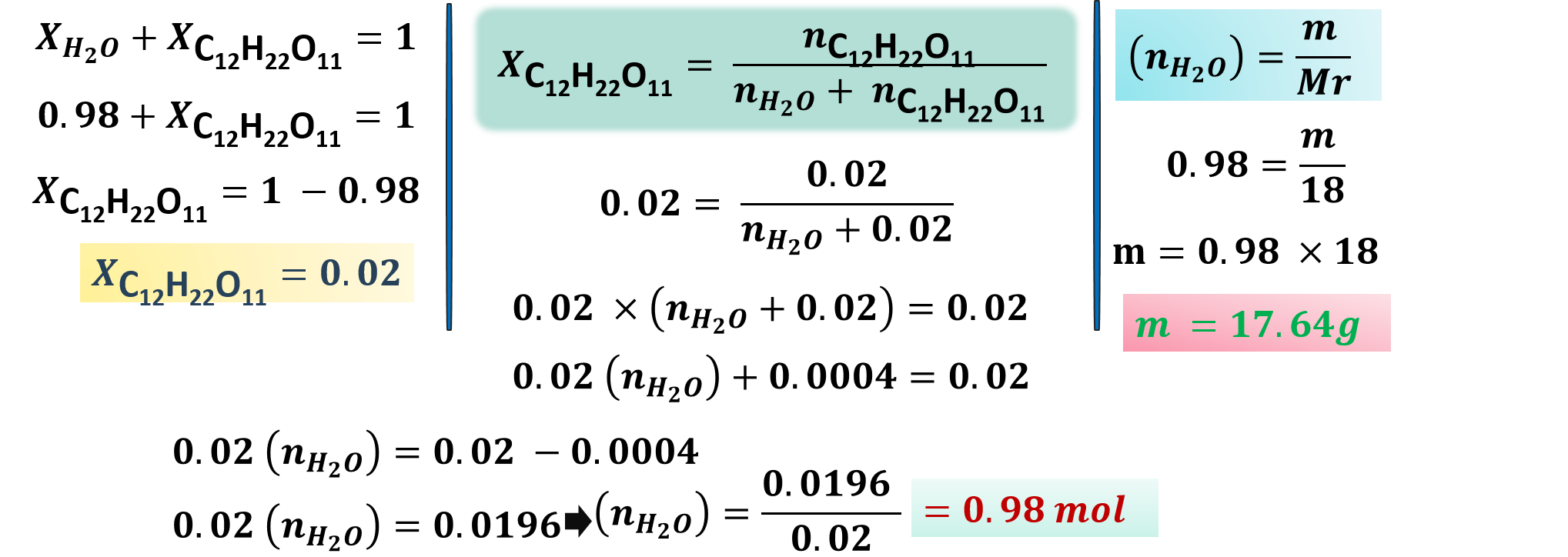
مثال: احسب كتلة الماء (H2O) في محلول السكروز(C12H22O11) ، إذا علمت أن عدد مولات السكروز =0.02mol وأن الكسر المولي للماء = 0.98؟
“ Mr (H2O) = 18g/mol ”
الحل:
أتحقَّق: أحسُبُ الكسرَ الموليَّ لكلٍّ منَ الماء وَحِمض الهيدروكلوريك HCl في محلول منهما، علمًا أنّ عدد مولات الماء 2mol وعدد مولات حِمض الهيدروكلوريك 2.5mol
الحل:
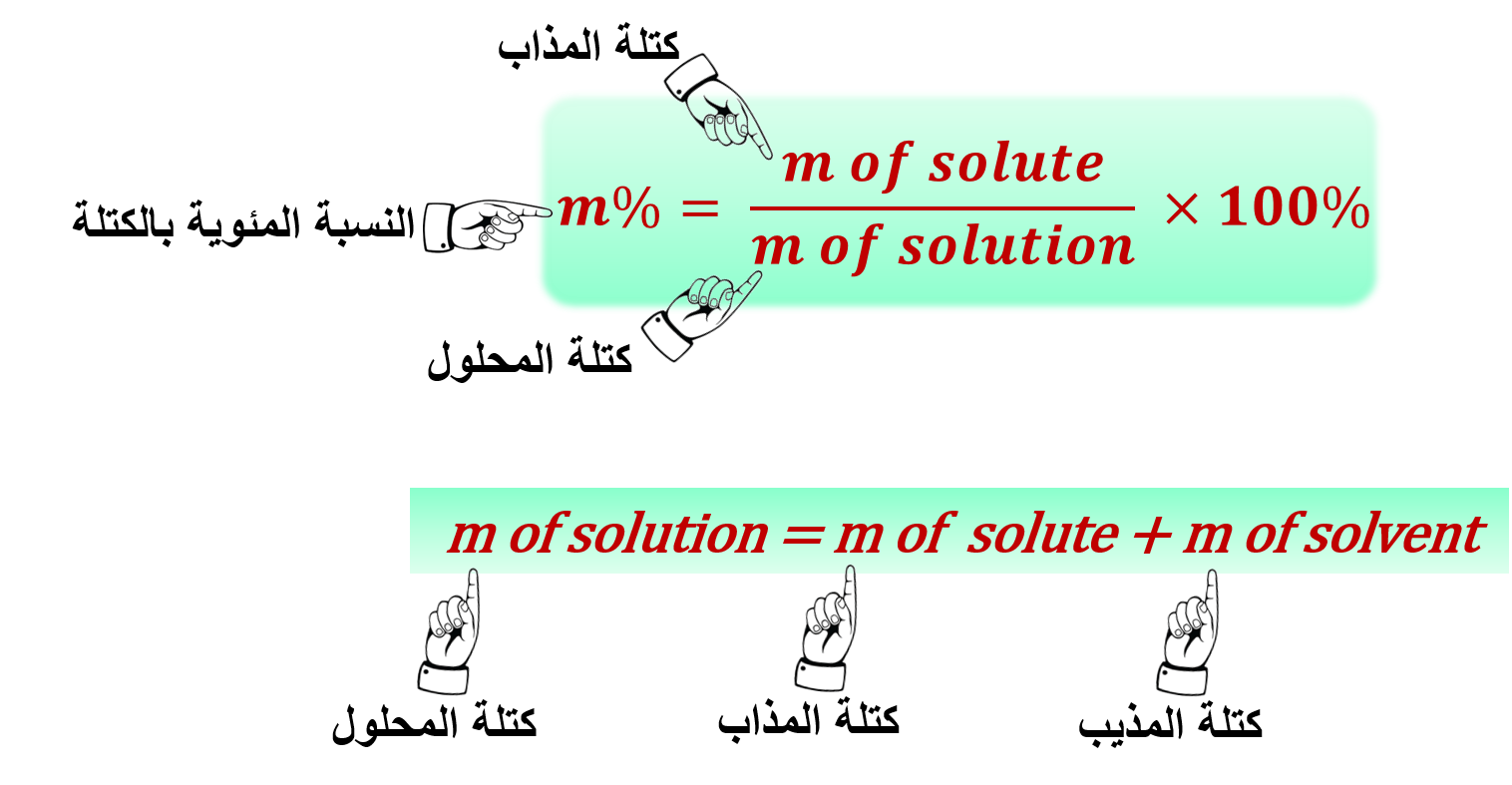
2- النسبة المئوية الكتلية: %m
" النسبة المئوية بين كتلة المذاب إلى كتلة المحلول "
ملاحظة: كتلة المحلول = كتلة المذاب + كتلة المذيب
♦ تستخدم في التعبير عن التركيز عندما يكون: المذاب صُلبًا والمذيب سائلًا
الحل: لتحضير هذا التركيز فإنه يلزم 10g من الملح وإذابته في كمية من الماء المقطر لتصبح كتلة المحلول 100g؛ وبذلك تكون كتلة المذيب 90g من الماء.

يمكن التعبير عن النسبة المئوية بالكتلة بالصيغة الرياضية:
مثال: احسب النسبة المئوية بالكتلة للمحلول الناتج من إذابة 50g من ملح الطعام (NaCl) في 200g من الماء المقطّر؟
الحل:
مثال: احسب كتلة هيدروكسيد البوتاسيوم (KOH) اللازمة لتحضير محلول كتلته 80g بتركيز 5% بالكتلة؟
الحل:
مثال: احسب عدد مولات هيدروكسيد الصوديوم (NaOH) اللازمة لتحضير محلول كتلته 160g بتركيز 8% بالكتلة؟ « علمًا أن: Mr (NaOH) = 40 g/mol»
الحل:
أتحقَّق: أحسُبُ النسبة المئويّة بالكتلة للمحلول الناتج من إذابة 70g من نترات البوتاسيوم KNO3 في 230g منَ الماء المُقَطَّر.
الحل:
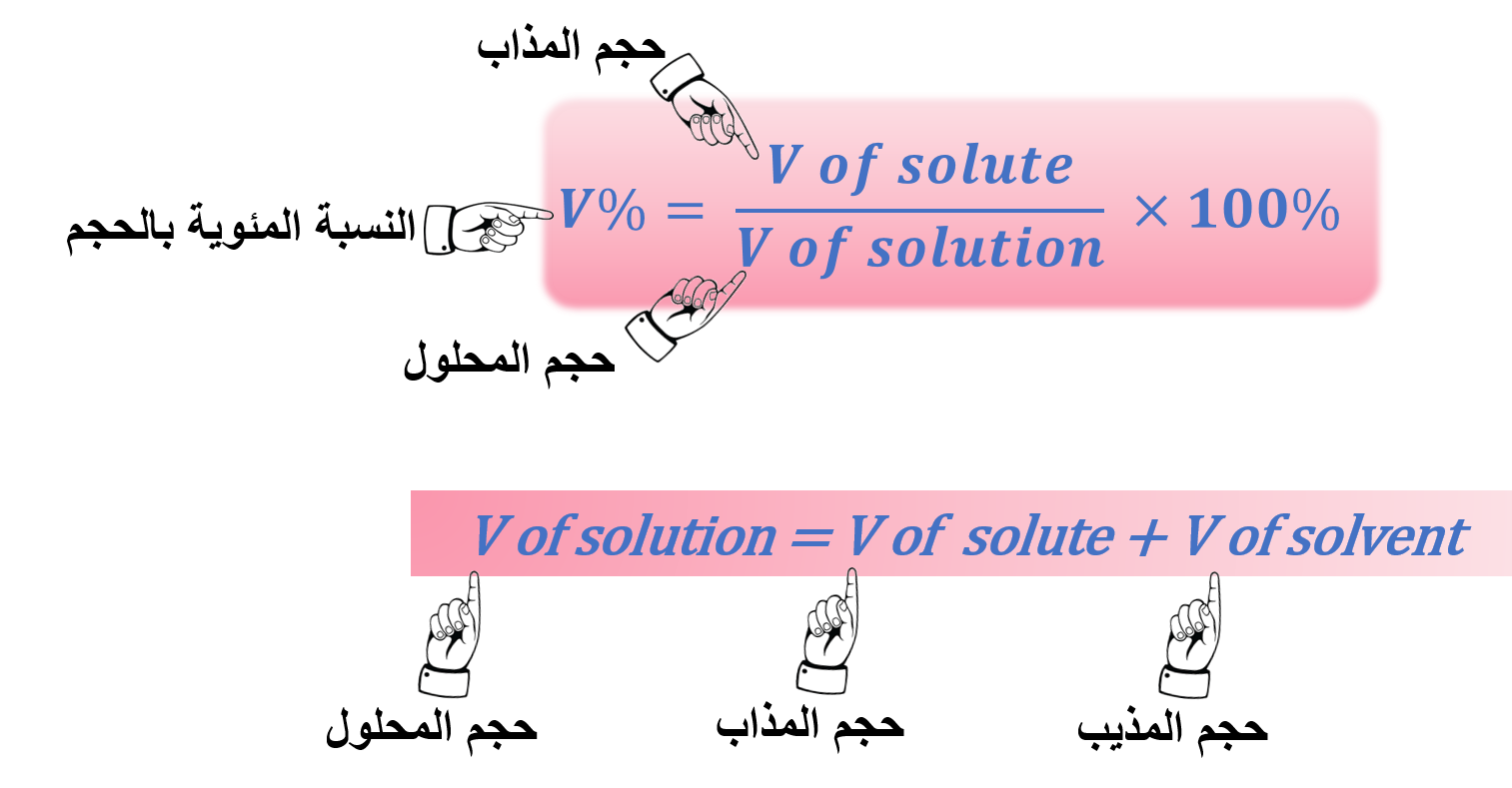
3- النسبة المئوية الحجمية: %V
" النسبة المئوية بين حجم المذاب إلى حجم المحلول "
ملاحظة: حجم المحلول = حجم المذاب + حجم المذيب
♦ تستخدم في التعبير عن التركيز عندما يكون: المذاب سائلًا والمذيب سائلًا
مثال: إلى ماذا تشير النسبة المئوية المكتوبة على العبوة؟
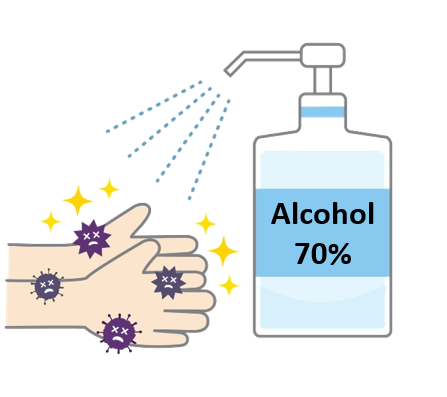
الحل: تشير النسبة 70% إلى تركيز محلول الكحول؛ أي أن كل 100mL من المحلول يحتوي على 70mL من الكحول و 30mL من الماء.

يمكن التعبير عن النسبة المئوية بالحجم بالصيغة الرياضية:
مثال: احسب النسبة المئوية بالحجم للمحلول الناتج من إذابة 60mL من حمض الكبريتيك (H2SO4) في 400mL من الماء المقطّر؟
الحل:
مثال: احسب حجم حمض النتريك (HNO3) اللازم لتحضير محلول حجمه 500mL بتركيز 65% بالحجم؟
الحل:
أتحقَّق: أحسُبُ النسبة المئويّة بالحجم لمحلول منَ الأسيتون CH3COCH3 حُضِّرَ بإذابة 28mL منه في كميّة منَ الماء المُقَطَّرِ حتى أصبح حجمُ المحلول 150mL
الحل:
أفكر: ما الفرقُ بين النسبة المئويّة بالكتلة والنسبة المئويّة بالحجم؟
الحل:
| النسبة المئوية بالكتلة | كتلة المذاب مقسومة على كتلة المحلول | المذاب في الحالة الصلبة والمذيب في الحالة السائلة |
| النسبة المئوية بالحجم | حجم المذاب مقسوما على حجم المحلول | المذاب والمذيب في الحالة السائلة |
4- المولارية: (M)
M" عدد مولات المادة المذابة في لتر واحد من المحلول "
♦ من أكثر الوحدات شيوعًا لقياس التركيز وتسمى أيضًا التركيز المولاري

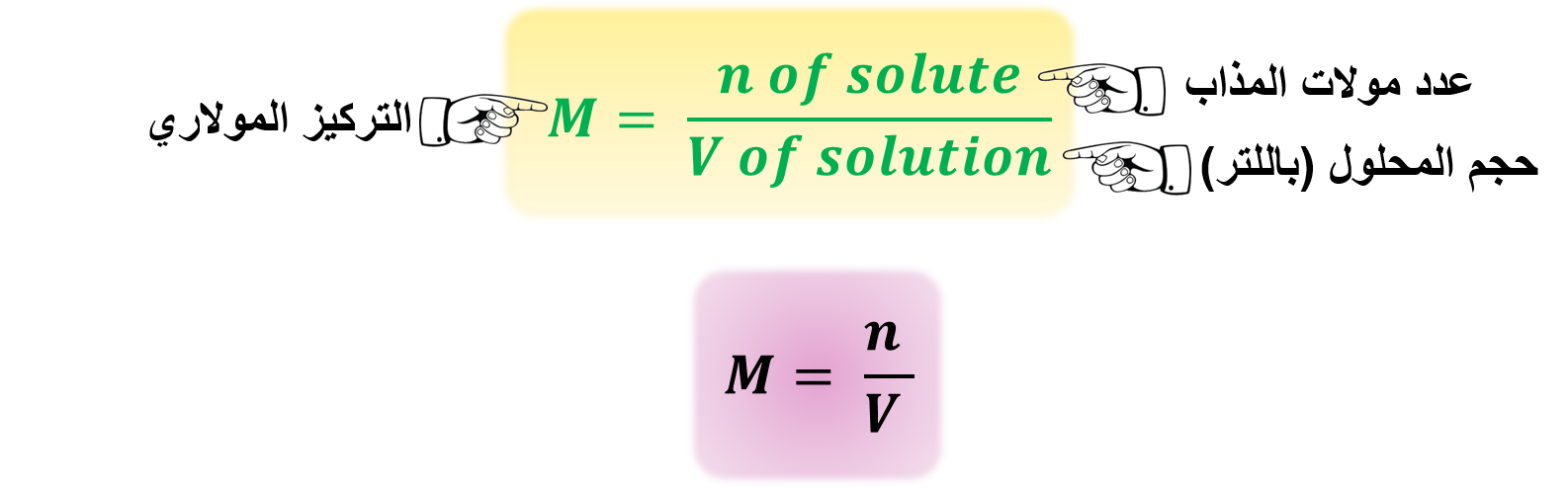
مثال: احسب مولارية محلول هيدروكسيد الصوديوم (NaOH) حضّر بإذابة 80g في نصف لتر من الماء؟ “ Mr (NaOH) = 40 g/mol ”
الحل:
1- نحسب عدد مولات المذاب؛ وذلك بقسمة الكتلة المعطاة على الكتلة المولية للمذاب:
2- نحسب التركيز المولاري؛ وذلك بقسمة عدد مولات المذاب على حجم المحلول (باللتر)
مثال:كم غرام من هيدروكسيد البوتاسيوم (KOH) يلزم لتحضير محلول تركيز 0.5M وحجمه 3L ؟ “ Mr (KOH) = 56 g/mol ”
الحل:
1- نحسب عدد مولات المادة المذابة من العلاقة:
2- نحسب كتلة المذاب، وذلك بضرب عدد المولات بكتلته المولية:
أتحقَّق:
أحسُبُ كتلةَ السُّكَر C6H12O6 اللازمةَ لعمل محلول حجمُهُ 2L وتركيزه المولاري 0.04M . علمًا أنّ الكتلة الموليّة Mr = 180 g/mol (C6H12O6)
الحل:
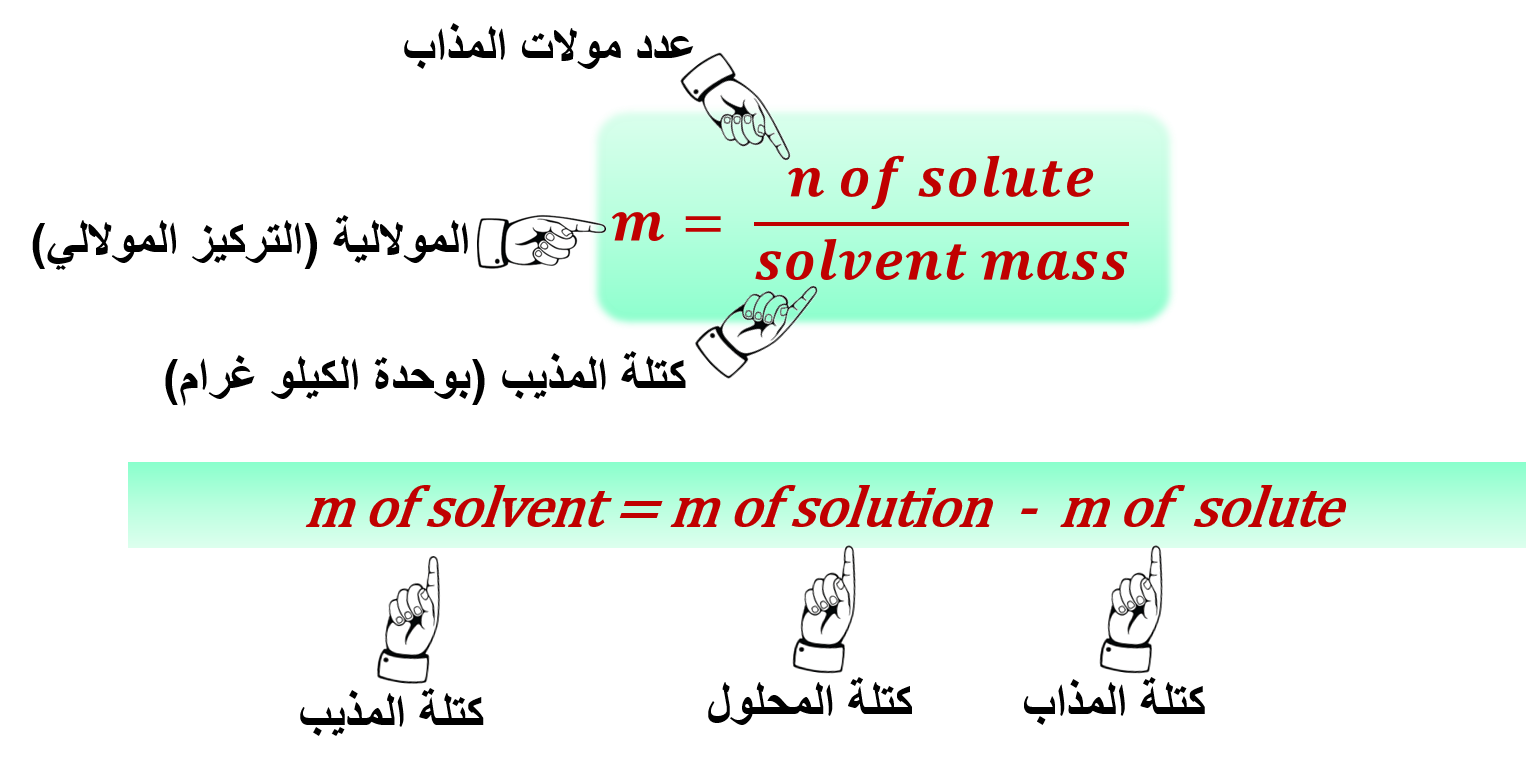
5- المولالية: (m)
" نسبة عدد مولات المذاب في 1Kg من المذيب "
♦ تستخدم في التعبير عن التركيز عندما: يتأثر حجم المحلول بتغيّر درجة حرارته.
♦ لذلك عادة ما يوصف تركيزه بالمولالية (m): «عدد مولات المذاب في كتلة معينة من المذيب»
يتأثر حجم المحلول بتغيّر درجة حرارته:
♦ فيزداد حجمه بزيادة درجة الحرارة، فيقل تركيزه. ♦ ويقل حجمه بنقصان درجة الحرارة، فيزداد تركيزه

يمكن التعبير عن المولالية ( التركيز المولالي) بالصيغة الرياضية:
مثال: احسب مولاليّة محلول تكوّن بإذابة 5mol من كلوريد الصوديوم (NaCl) في 500g من الماء المقطّر؟
الحل:
مثال:محلول حضّر بإذابة 30g من كبريتات الصوديوم (Na2SO4) في الماء، لتصبح كتلة المحلول 800g، فاحسب التركيز المولالي لهذا المحلول؟ “ Mr (Na2SO4) = 142 g/mol ”
الحل:
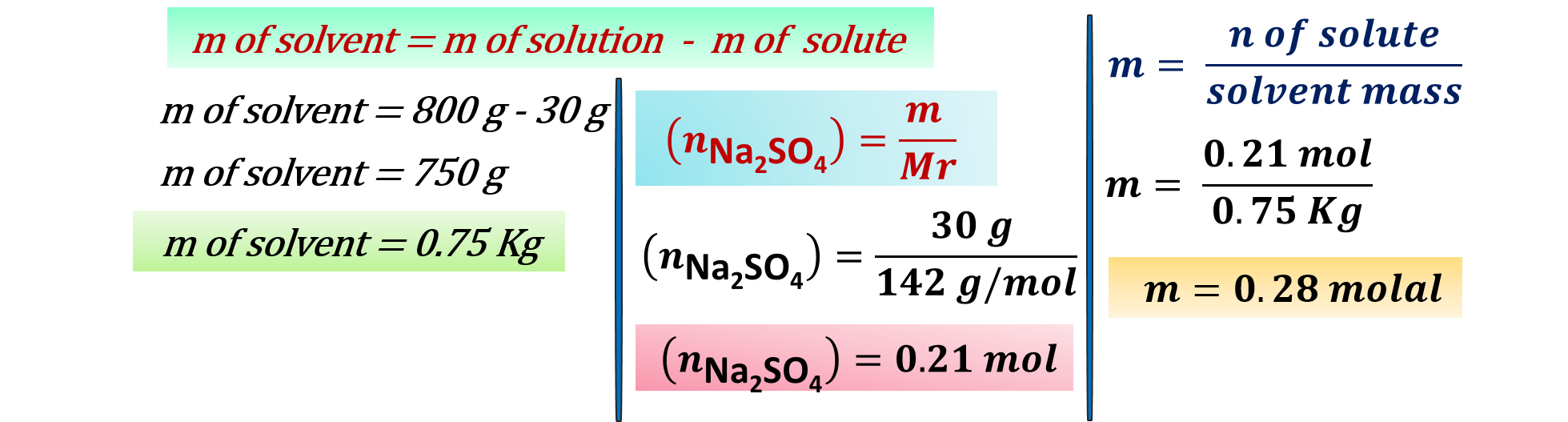
أتحقَّق: أحسُبُ مولاليّةَ المحلول الذي يحتوي على 8.4g فلوريد الصوديوم NaF مُذابة في 400g منَ الماء المُقَطَّر. علمًا أنّ الكتلة الموليّة ( Mr = 42 g/mol (NaF
الحل:
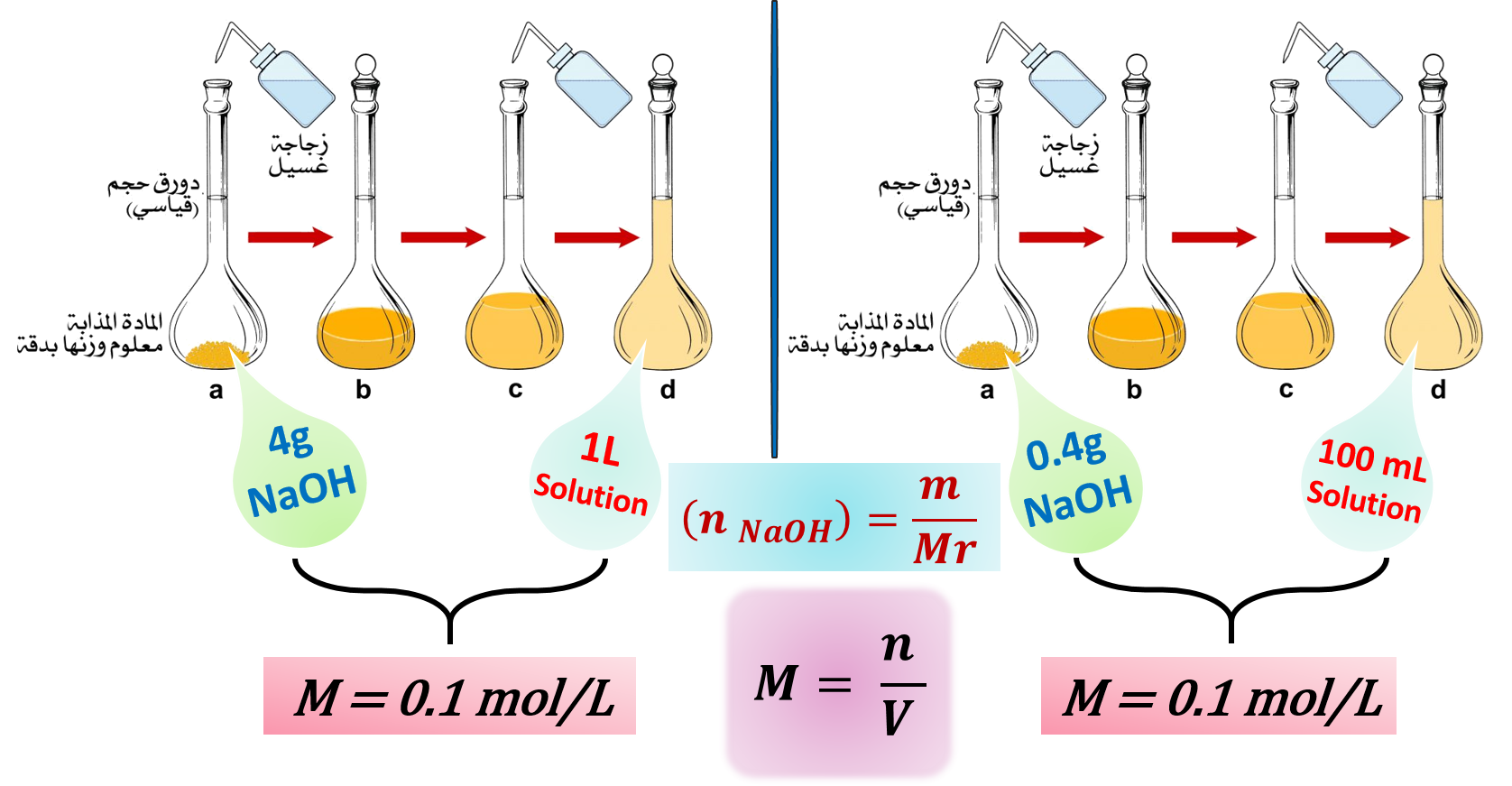
المحاليل القياسية
«محاليل معلومة التركيز بدقة»
üيحتوي 1L من المحلول القياسيّ على 1mol من المذاب.
يمكن تحضيره بإذابة كتلة معينة من المادة في كمية محددة من المذيب النقي.


تخفيفُ المحاليل
«يمكن الحصول على المحلول المخفّف بزيادة كمية المذيب»
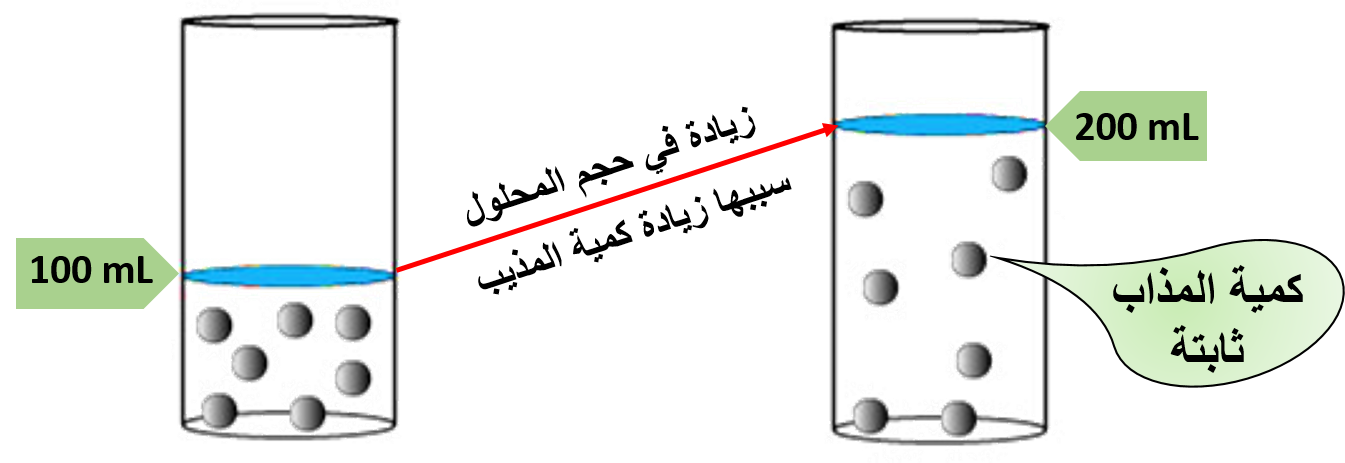

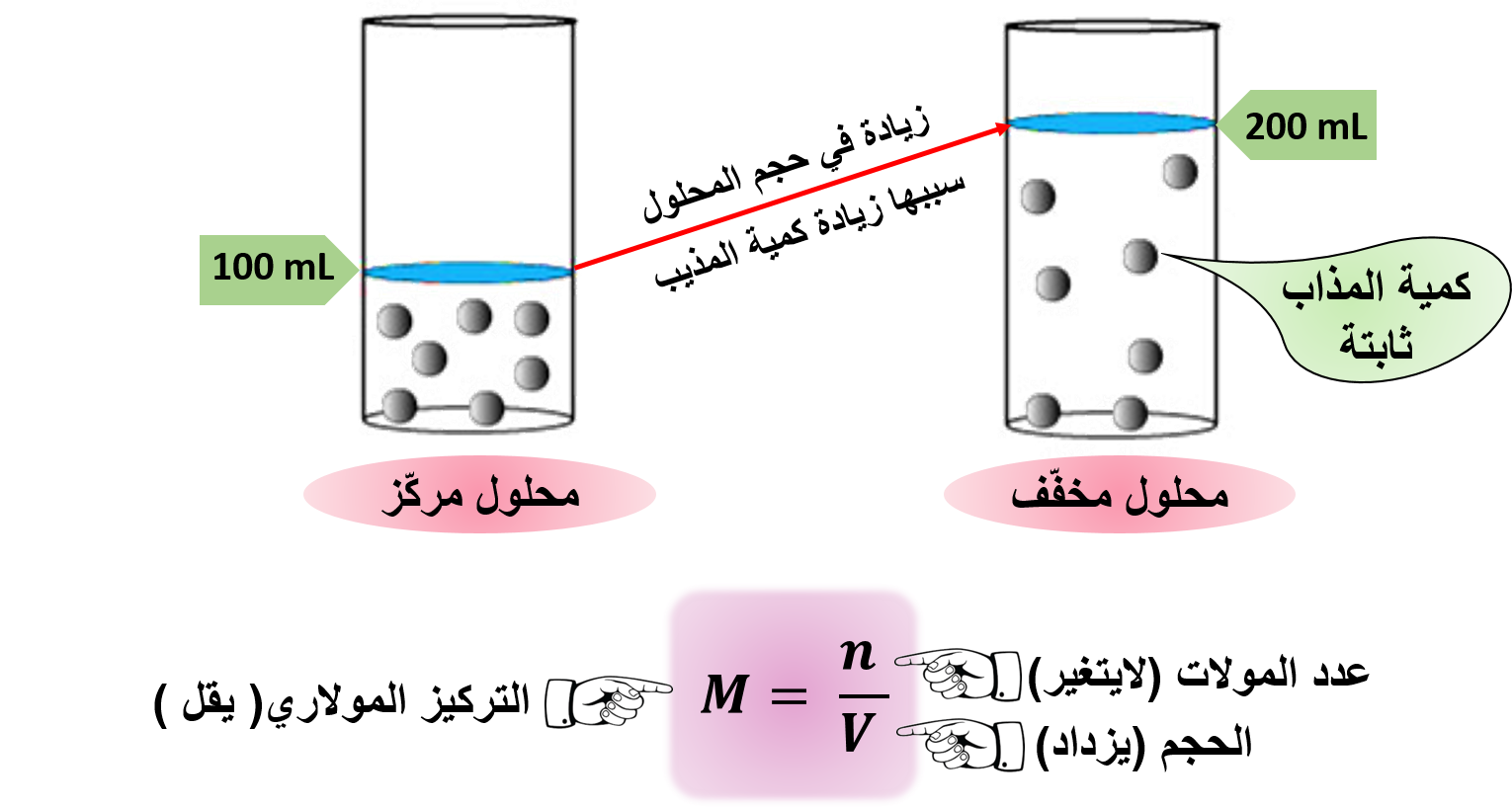
نستنتج مما سبق أن:
عند زيادة كمية المذيب فإن عدد جسيمات المذيب تزداد مسببّة زيادة في حجم المحلول، مع بقاء كمية المذاب ثابتة؛ وذلك يؤدي لتقليل تركيز المذاب وبالتالي يقل تركيز المحلول، دون تغيّر عدد المولات وكتلة المذاب.
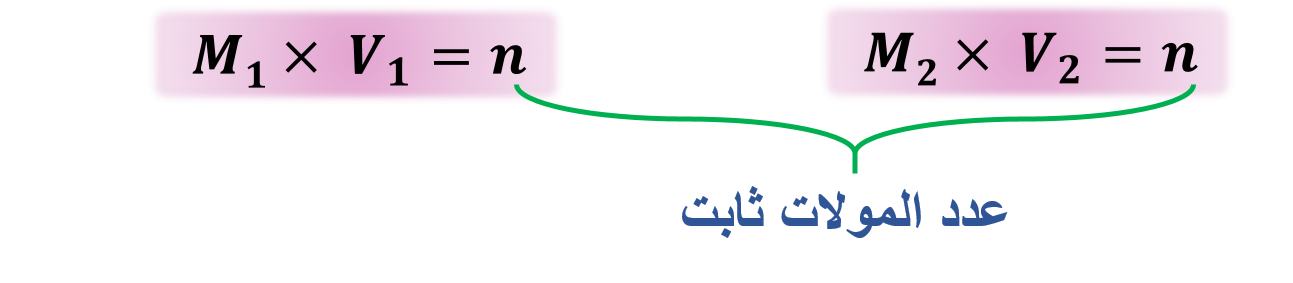
vيمكن حساب عدد المولات قبل التخفيف وبعده من خلال الصيغة الرياضية:

مثال: احسب مولاريّة محلول حضّر بإضافة 400mL من الماء المقطّر إلى 40mL من محلول تركيزه 0.5M؟
الحل:
M1 × V1 = M2 × V2
0.5 × 40 = M2 × 400
M2 = 0.05M
مثال: احسب حجم الماء اللازم إضافته إلى 8mL من محلول KOH ذي التركيز 0.2M ليصبح تركيزه 0.05M؟
الحل:
M1 × V1 = M2 × V2
0.2 × 8 = 0.05 × V2
V2 = 32 mL
حجم الماء اللزم إضافته = 32 - 8 = 24mL
أتحقَّق: أحسُبُ حجمَ الماء ال الزم إضافتُهُ إلى 50mL من محلول كلوريد البوتاسيوم KCl الذي تركيزُهُ 4M ليصبح تركيزُهُ 0.2M ؟
الحل:
M1 × V1 = M2 × V2
4 × 50 = 0.2 × V2
V2 = 1000 mL
حجم الماء اللزم إضافته = 1000 - 50 = 950mL