نظرية رابطة التكافؤ
"تمكَنَا هذه النظرية من معرفة كيف تتوزع إلكترونات الرابطة بين أغلفة التكافؤ للذرتين المكونتين للرابطة"
حيث:
تصف كيفية تكوّن الروابط بين الذرات بطريقة تداخل الأفلاك الذرية
وهذا ما لم تفسره نظرية تنافر أزواج إلكترونات غلاف التكافؤ التي تمكنت من التنبؤ بأشكال الجزيئات.
* تبحث نظرية رابطة التكافؤ:
1- مفهوم تداخل الأفلاك البسيطة. 2- مفهوم الأفلاك المهجنة (التهجين).

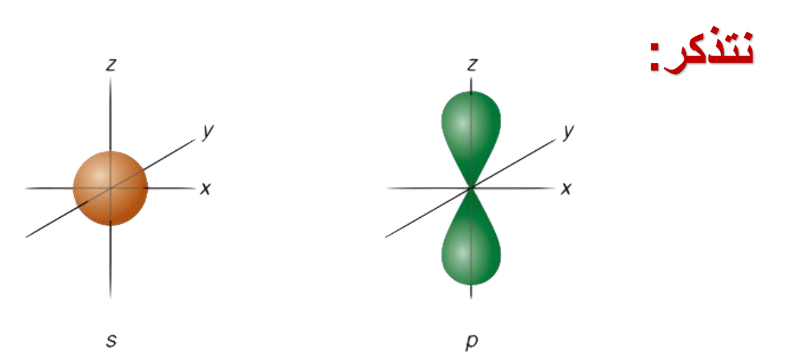
* أنواع التداخل في الأفلاك البسيطة:
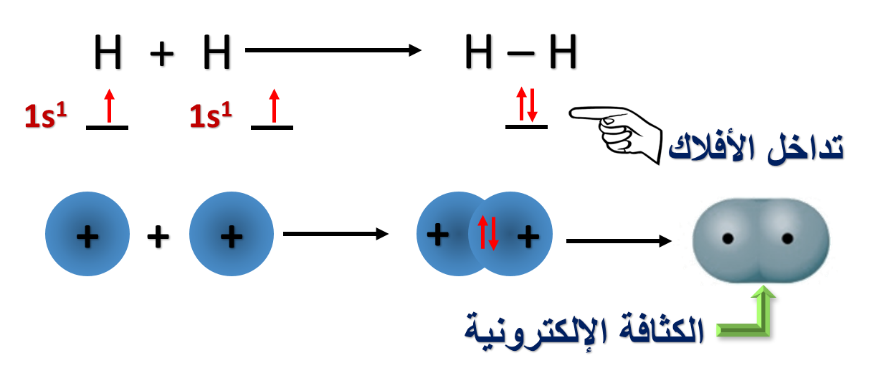
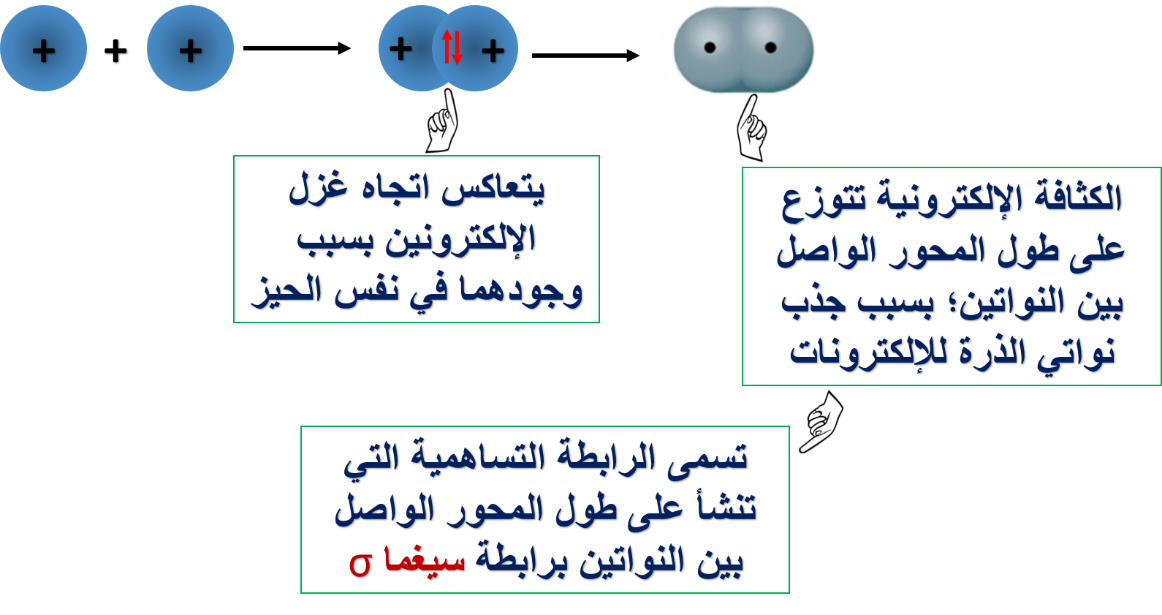
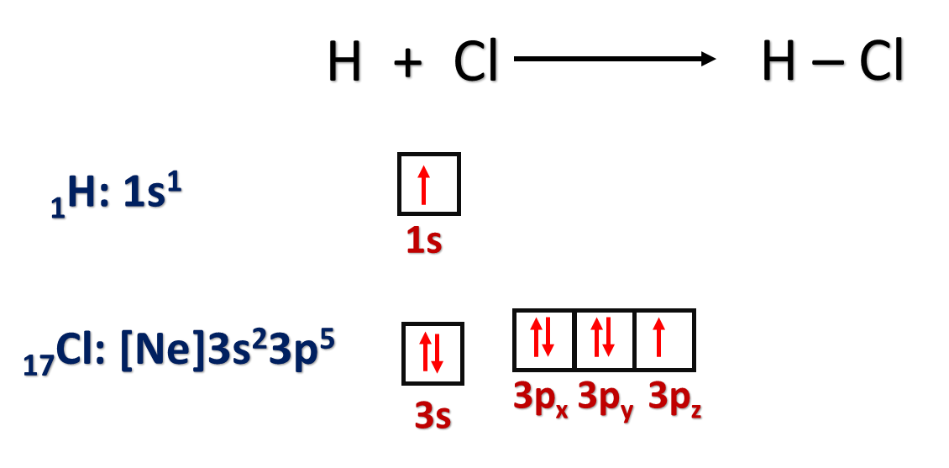
1- تداخل فلكي s لذرتي الهيدروجين في الجزيء H2
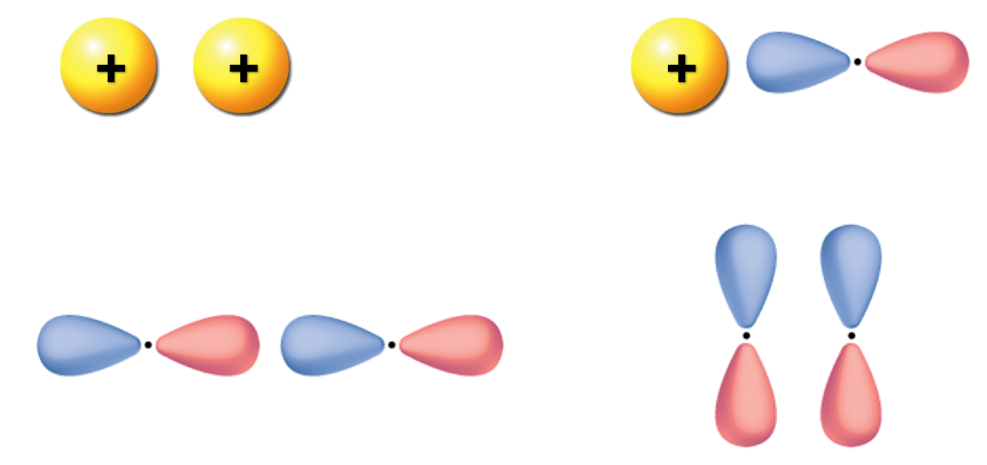
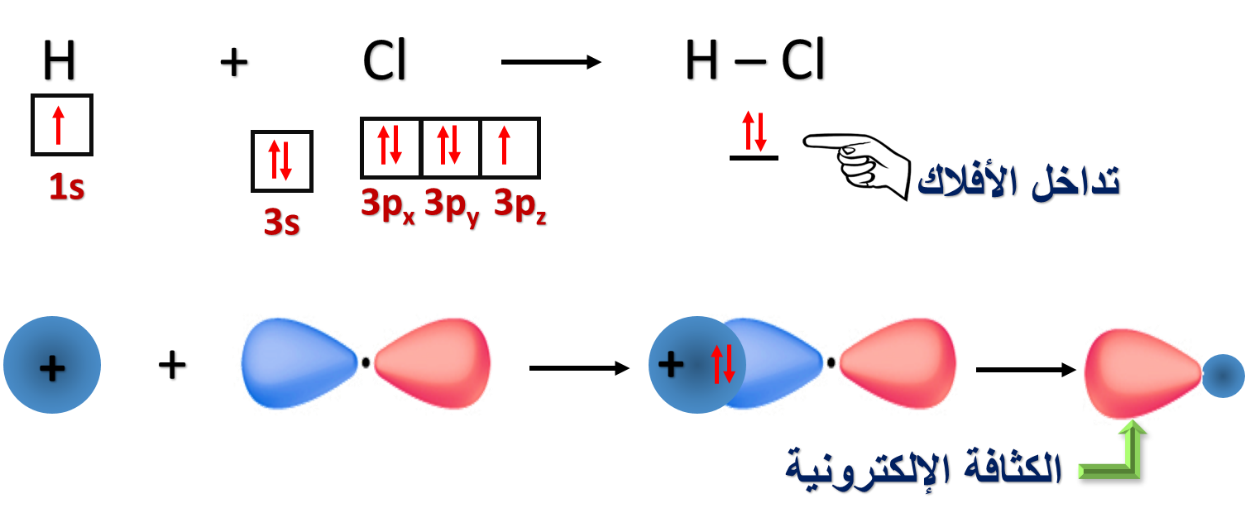
2- تداخل فلك s مع فلك p
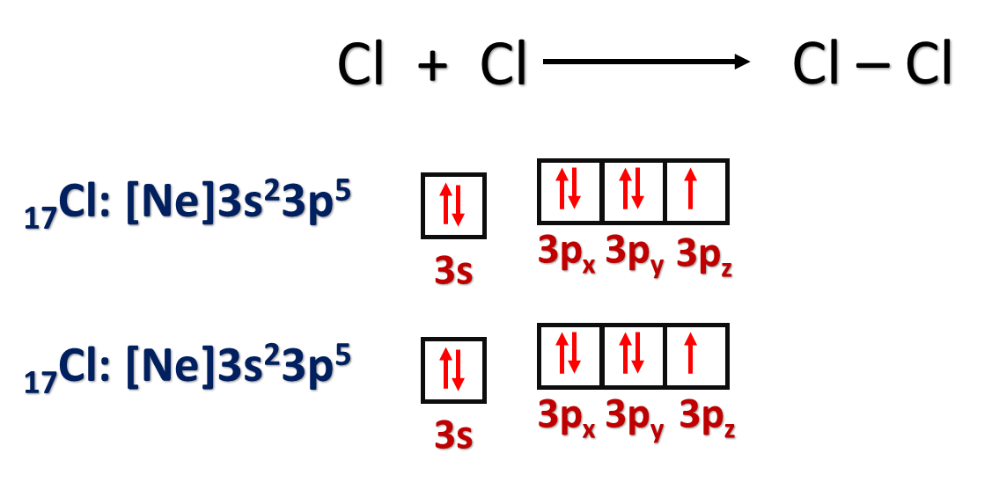
3- تداخل فلك p مع فلك p آخر
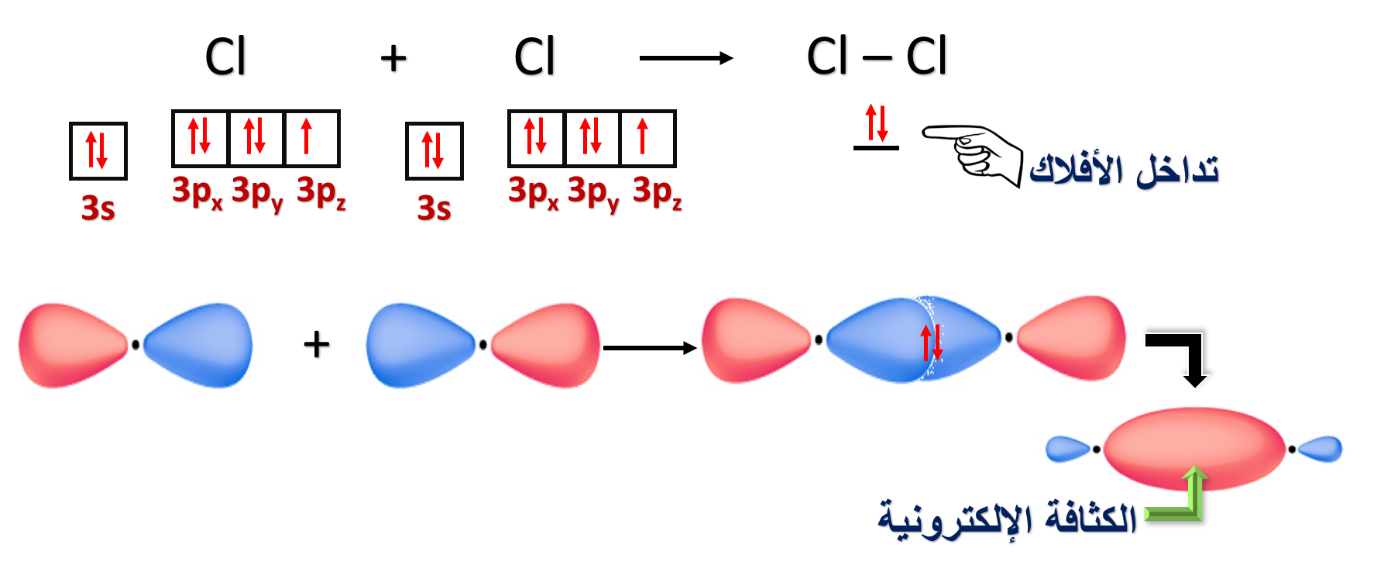
⦿ هل يمكن أن يحدث نوعان من التداخل في الأفلاك لنفس الجزيء؟
4- تداخل أفلاك p في جزيء O2
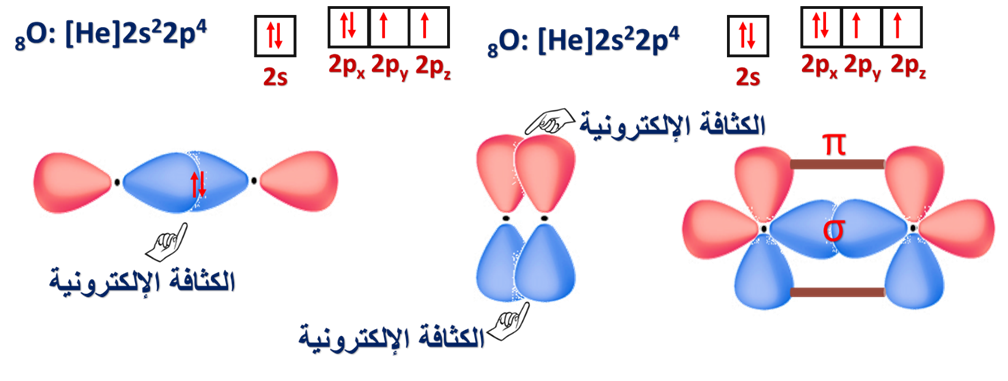
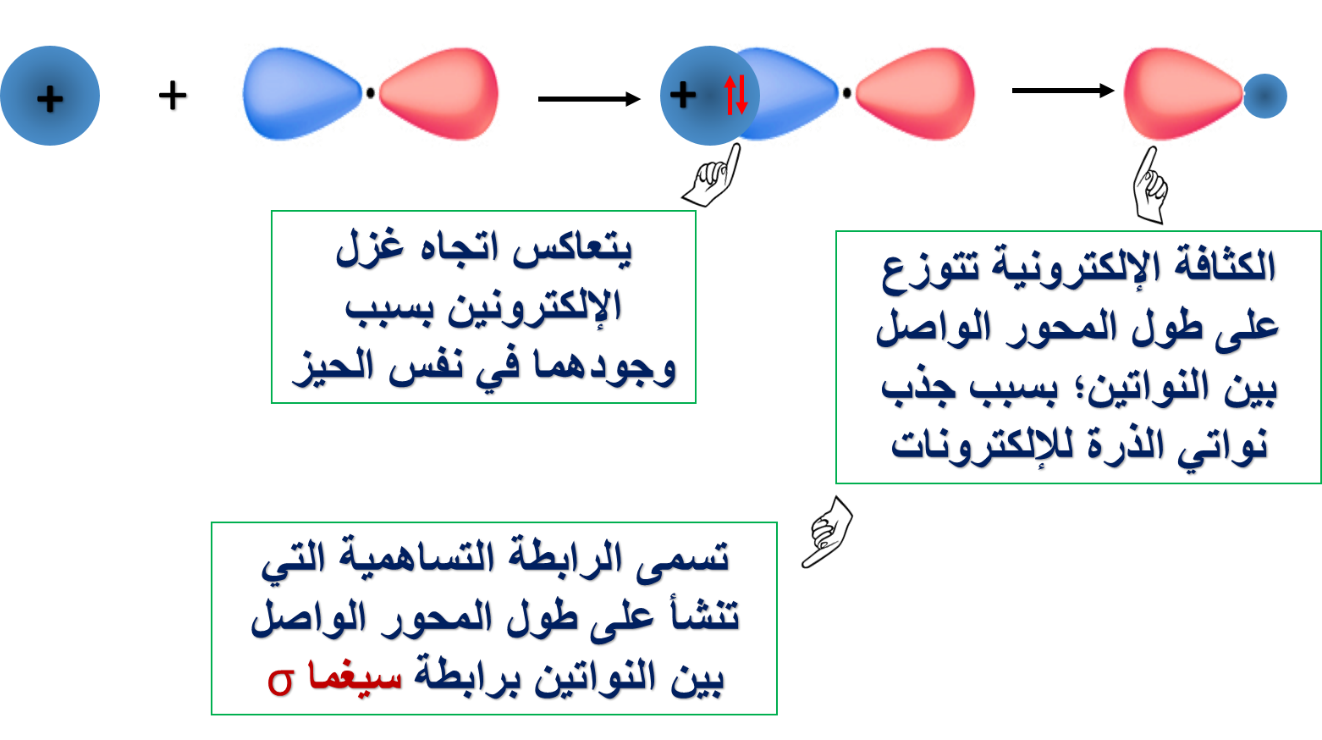
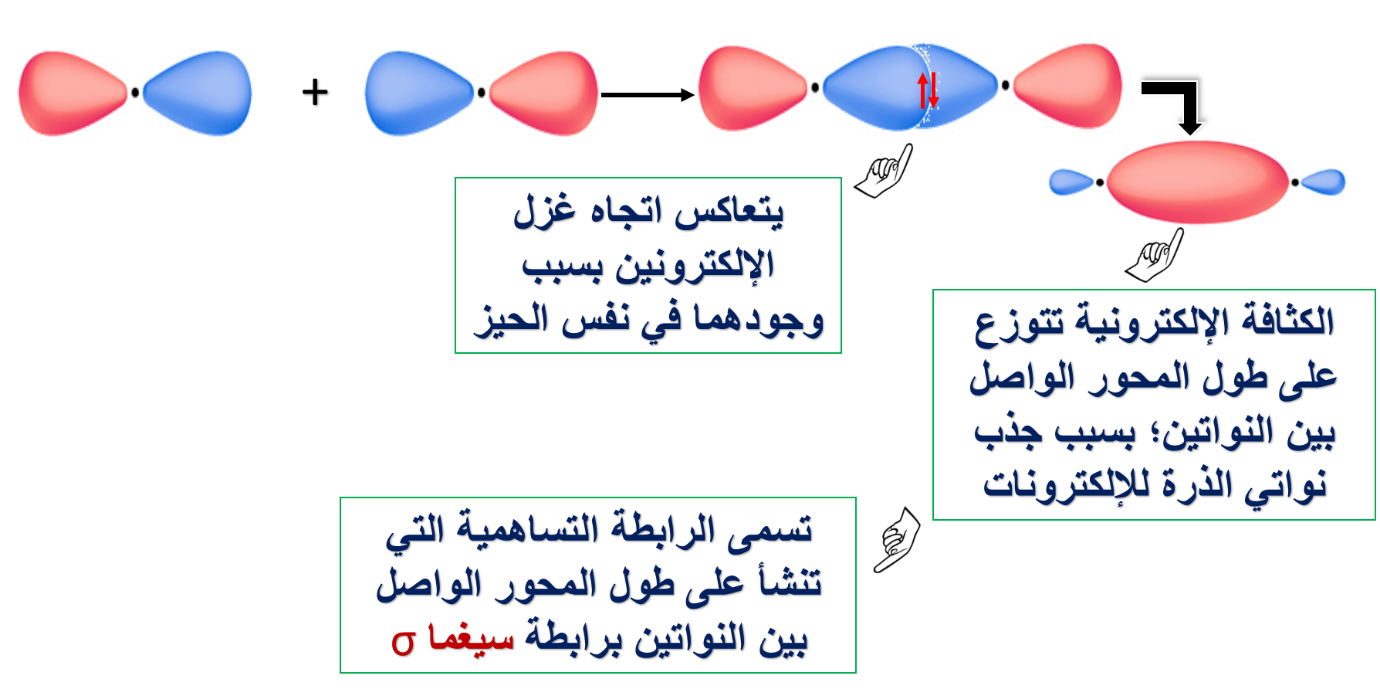
* مفهوم تداخل الأفلاك البسيطة.
حيث بيّنا كيف ساهم هذا المفهوم في تفسير تكوّن الروابط التساهمية لبعض المركبات التساهمية.
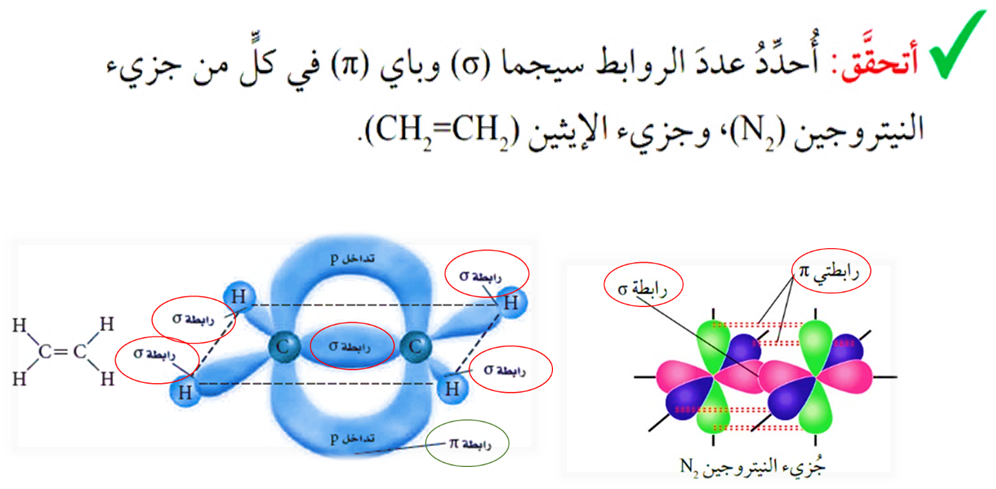
مثل: O = O N ≡ N H – Cl Cl – Cl H – H
والسؤال هنا
هل يستطيع مفهوم تداخل الأفلاك البسيطة تفسير تكوّن الروابط التساهمية لكل الجزيئات والمركبات التساهمية؟
أم يقتصر تفسيره على بعض المركبات البسيطة؟
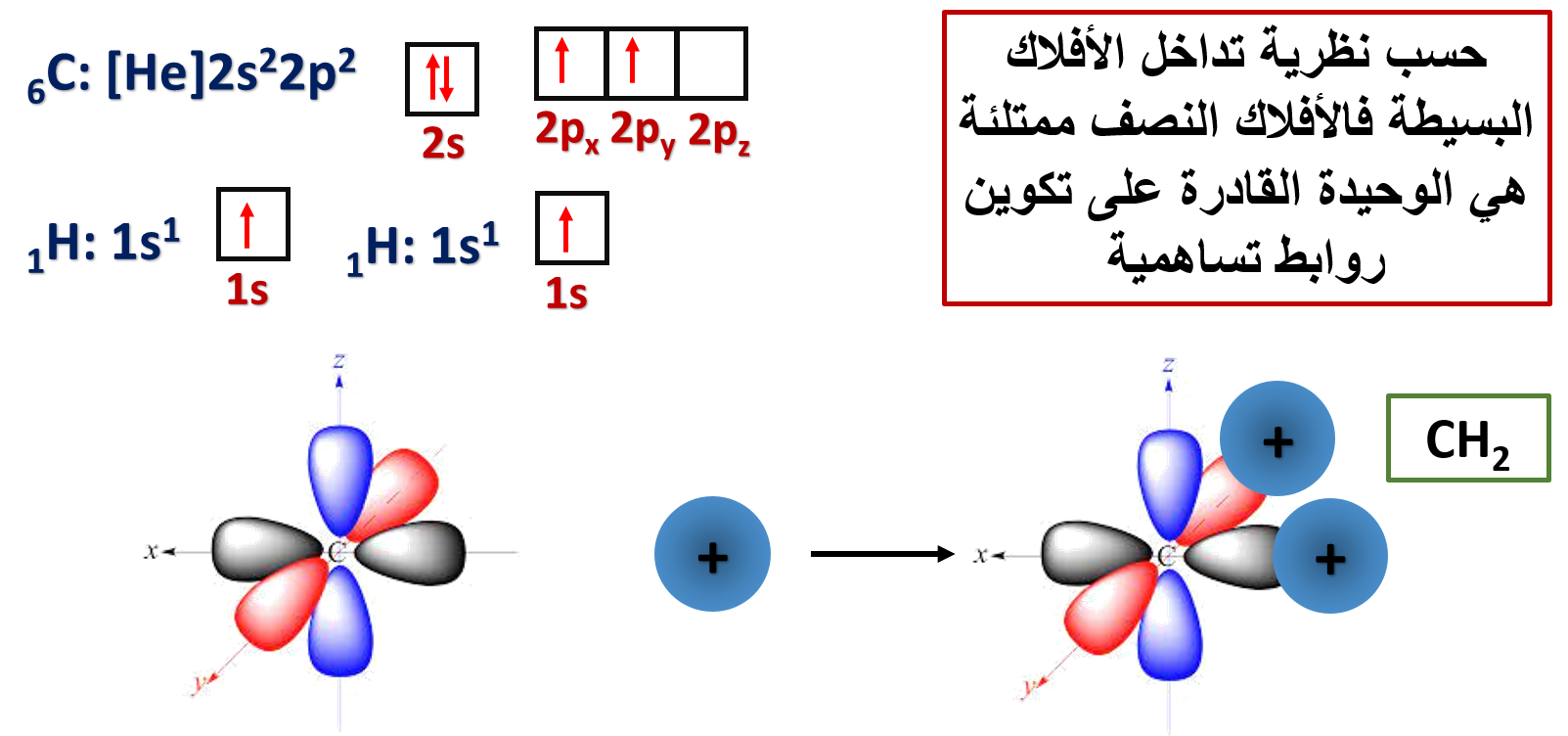
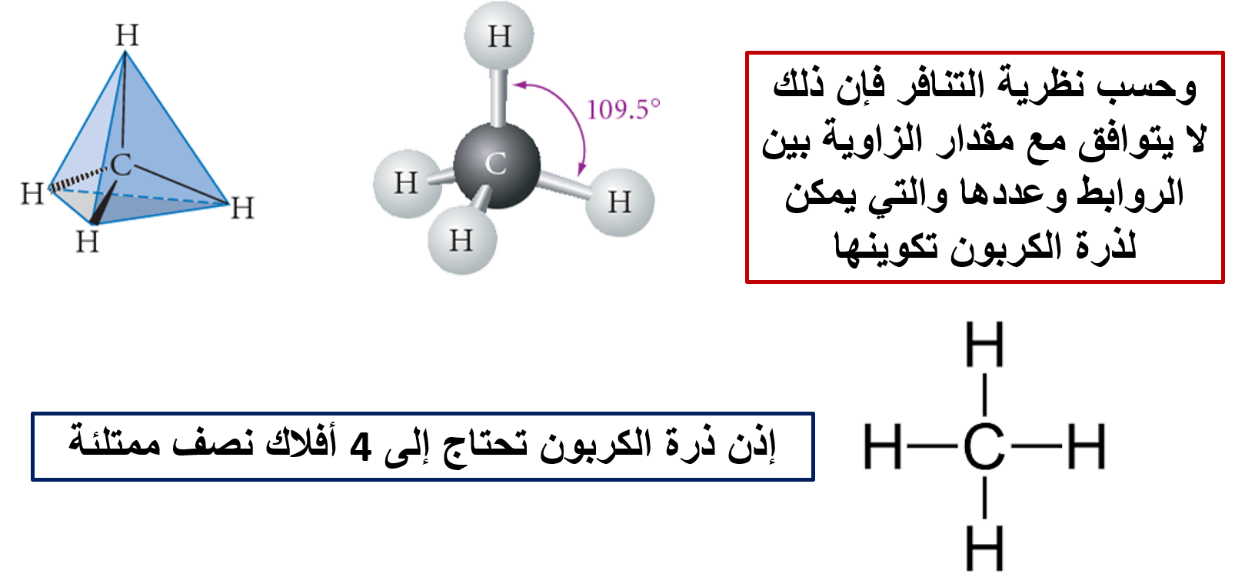
فمثلًا: هل يستطيع مفهوم تداخل الأفلاك البسيطة تفسير تكوّن الروابط التساهمية بين ذرة الكربون C وذرة الهيدروجين H؟

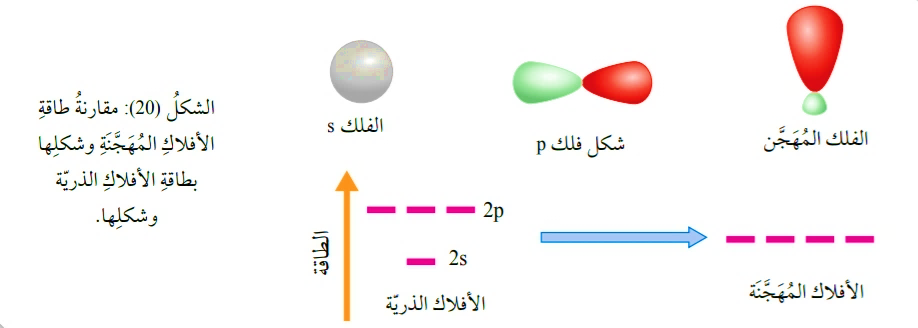
* مقارنة طاقة الأفلاك المهجّنة وشكلها بطاقة الأفلاك الذرية وشكلها
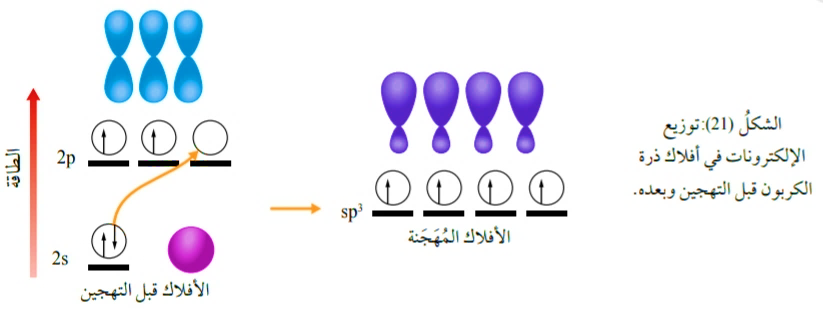
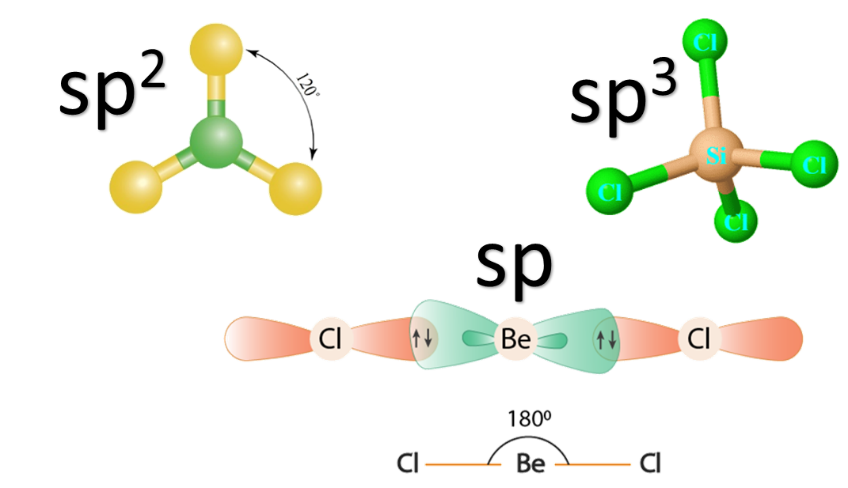
1- التهجين sp3
وينتج من تشارك فلك s مع 3 أفلاك من p
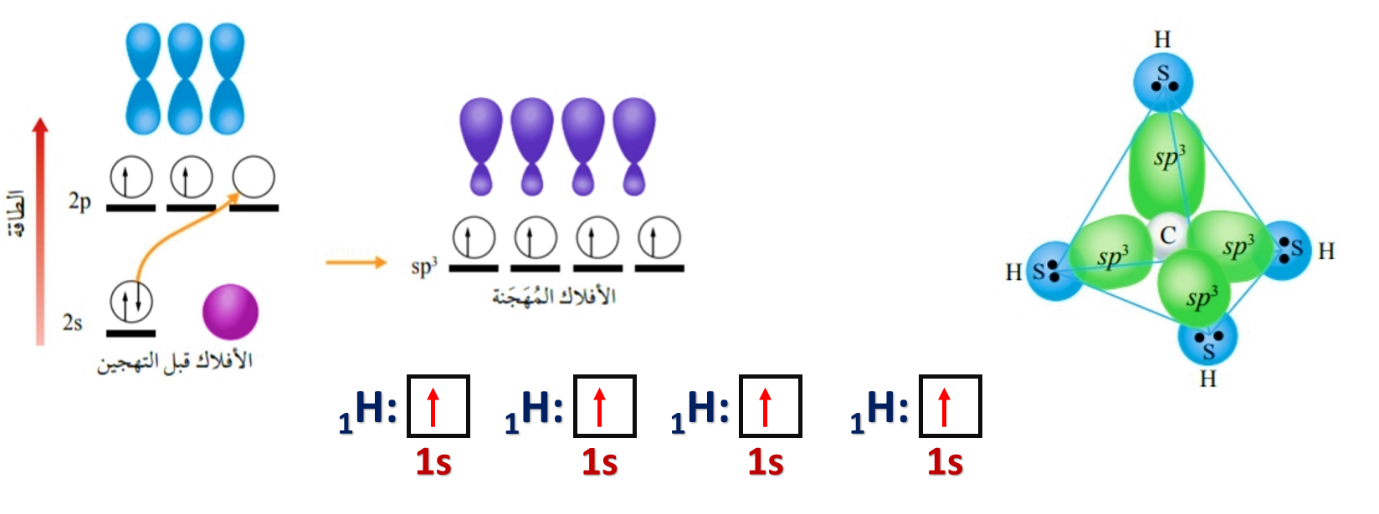
ومن خلال التهجين sp3
يمكن تفسير الروابط في جزيء الماء H2O
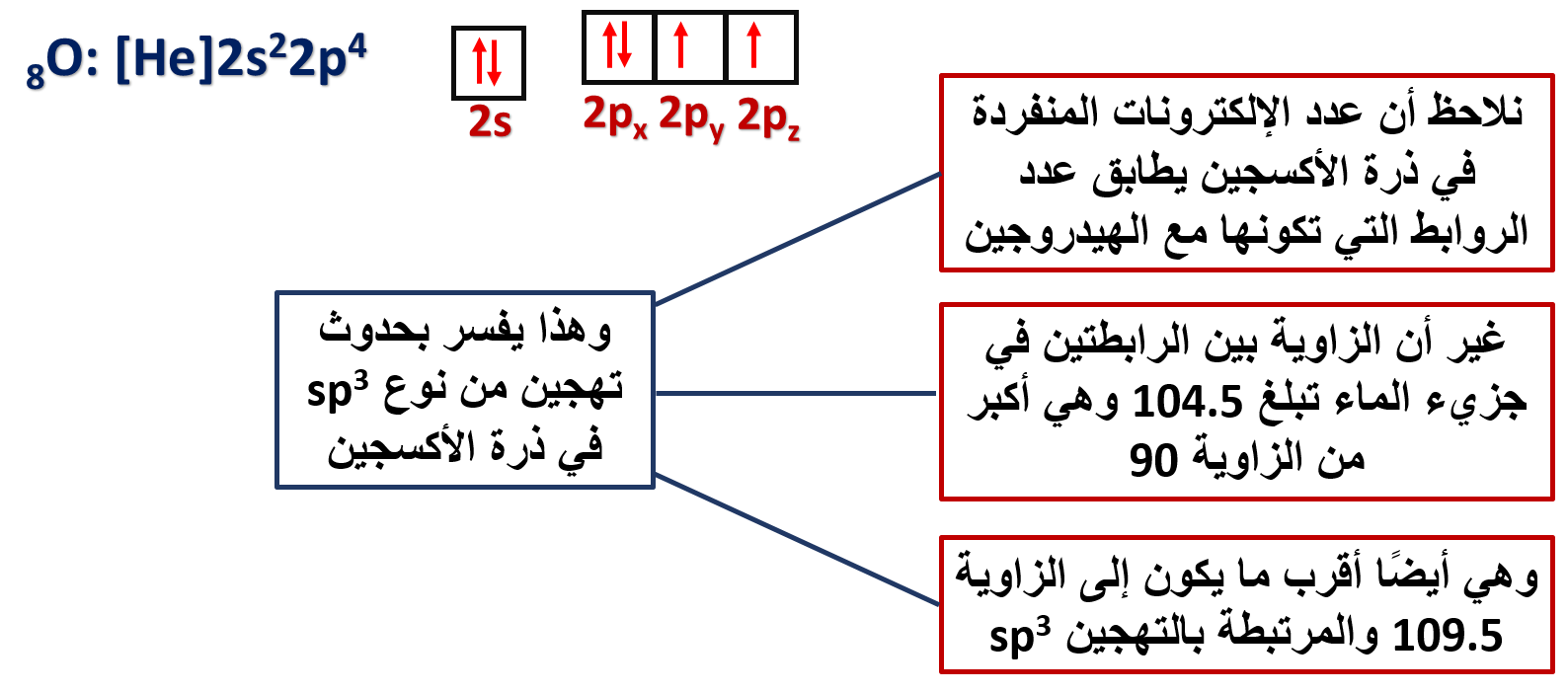
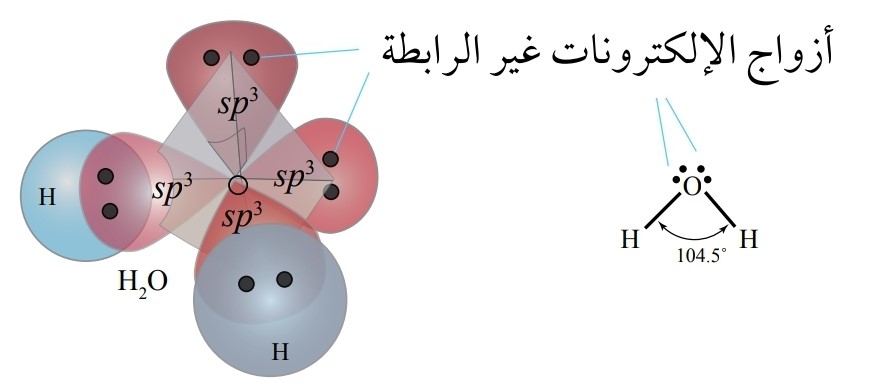
- على الرغم من أن تهجين الماء sp3 إلا أن الزاوية بين الروابط تبلغ 104.5، فما تفسير ذلك؟
وجود زوجين من الإلكترونات غير الرابطة حول ذرة الأكسجين يخضعان لجذب نواة ذرة الأكسجين فقط وهما يشغلان حيزًا حول النواة أكبر من الذي تحتله إلكترونات الرابطة التي تخضع لجذب نواتي الأكسجين والهيدروجين المكونتين للرابطة، وبذلك تتنافر مع أزواج إلكترونات الروابط، مسببة انخفاضًا قليلًا عن مقدار الزاوية 109.5 والمرتبطة بالتهجين sp3
كما نلاحظ أن الشكل الفراغي لجزيء الماء يشتق من شكل رباعي الأوجه المنتظم ليكون شكلًا منحنيًا
ومن خلال التهجين sp3
ويمكن أيضًا تفسير الروابط في جزيء الأمونيا NH3
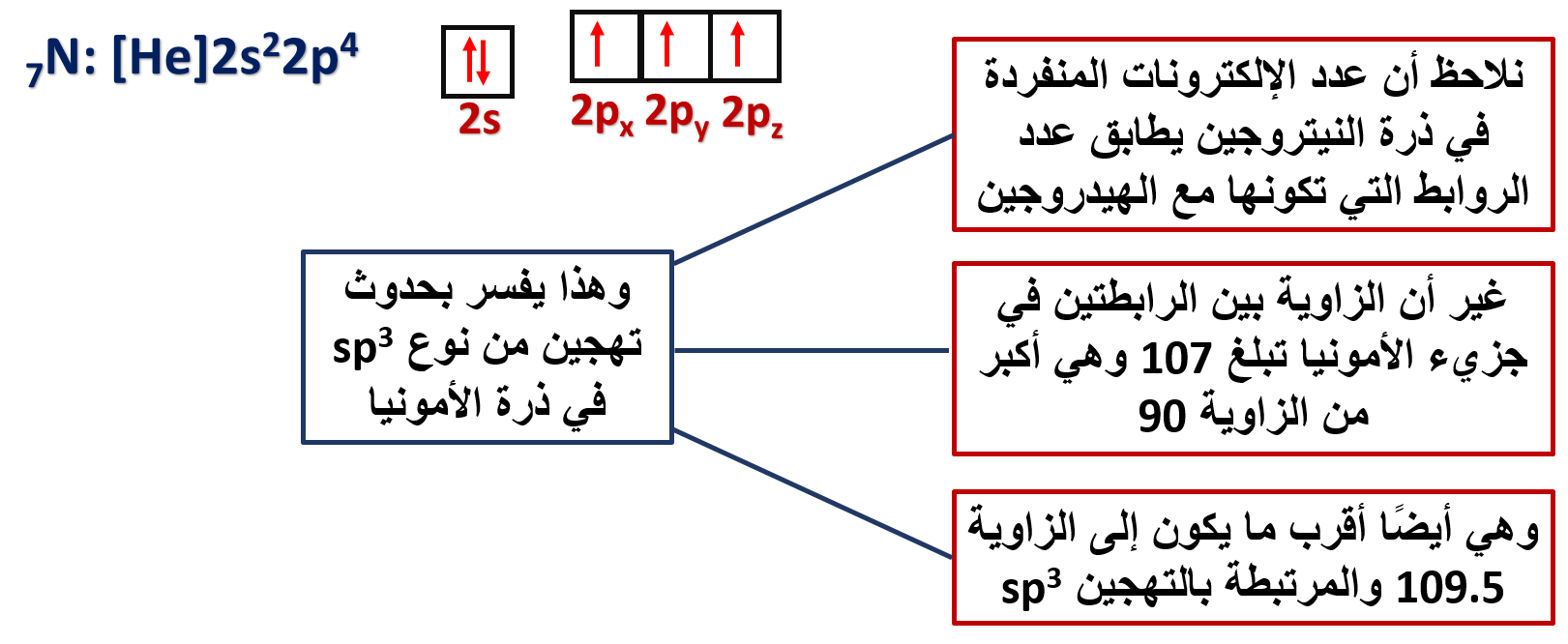
♦ على الرغم من أن تهجين الأمونيا sp3 إلا أن الزاوية بين الروابط تبلغ 107، فما تفسير ذلك؟
وجود زوج من الإلكترونات غير الرابطة حول ذرة النيتروجين يخضع لجذب نواة ذرة النيتروجين فقط وهو يشغل حيزًا حول النواة أكبر من الذي تحتله إلكترونات الرابطة التي تخضع لجذب نواتي النيتروجين والهيدروجين المكونتين للرابطة، وبذلك يتنافر مع أزواج إلكترونات الروابط، مسببًا انخفاضًا قليلًا عن مقدار الزاوية 109.5 والمرتبطة بالتهجين sp3
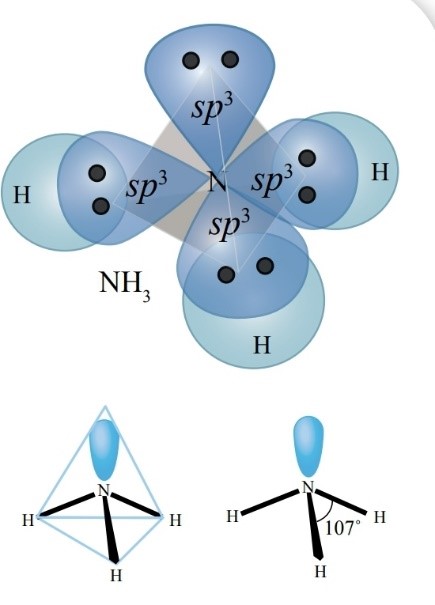
كما نلاحظ أن الشكل الفراغي لجزيء الأمونيا هو شكل هرم ثلاثي، حيث تتوزع ذرات الهيدروجين على رؤوس هذا الهرم.
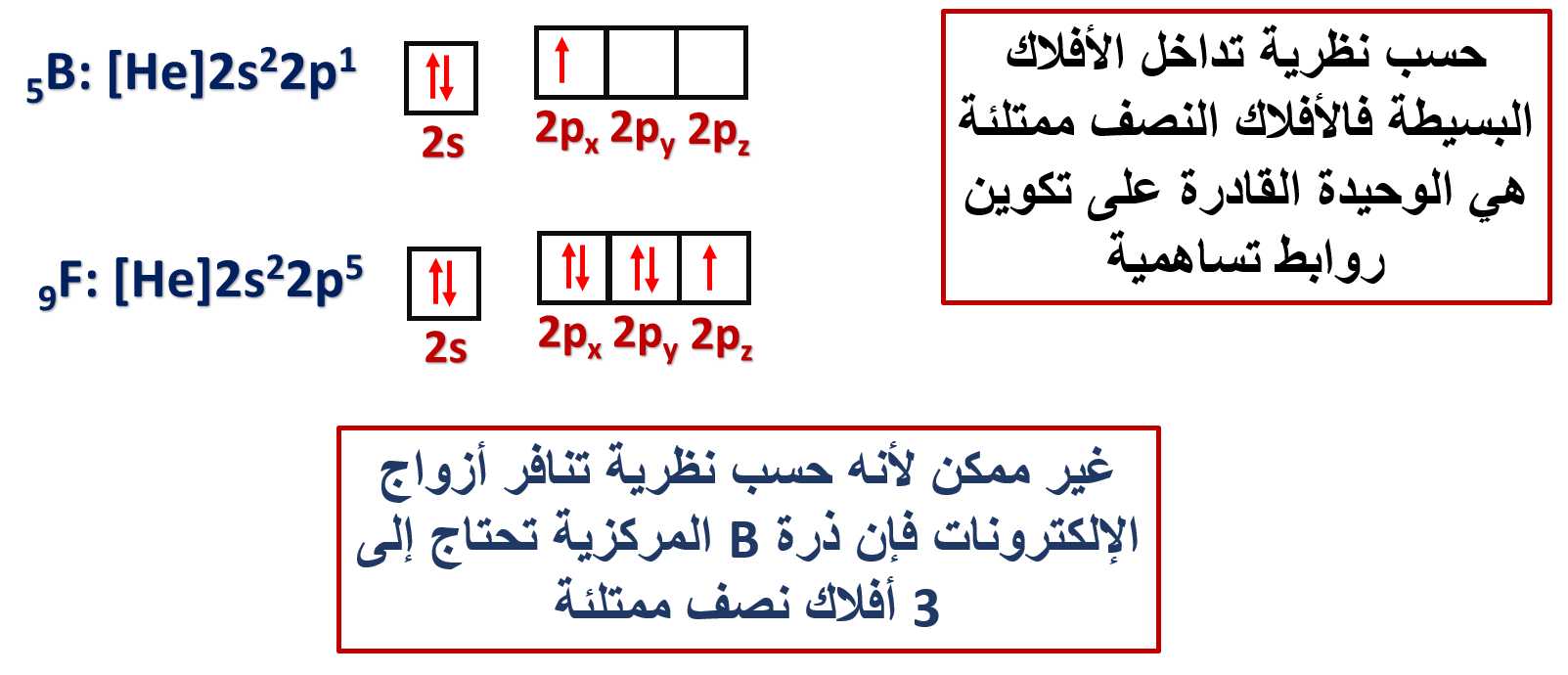
وكمثال آخر: هل يستطيع مفهوم تداخل الأفلاك البسيطة تفسير تكوّن الروابط التساهمية بين ذرة البورون B وذرة الفلور F؟
سؤال أفكر: ما الأفلاكُ التي تستخدمُها ذرّةُ السيليكون في تكوين الروابط معَ ذرّة الكلور في الجزيء SiCl4؟ sp3
سؤال أفكر: ما التهجينُ المتوقّع لذرّة الفسفور في الجزيء (PCl3)؟ sp3
2- التهجين sp2
وينتج من تشارك فلك s مع فلكين من p
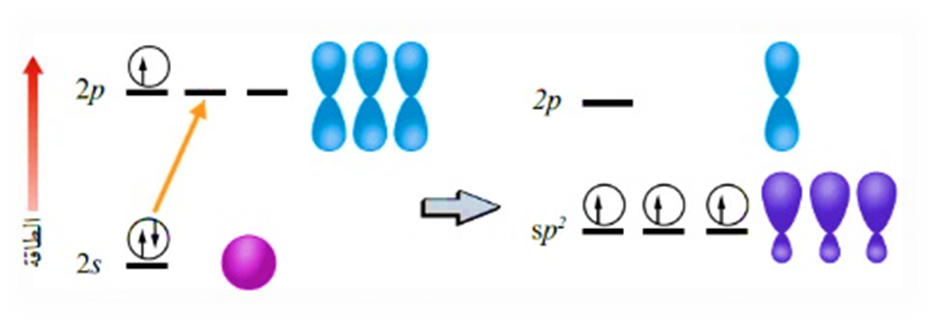
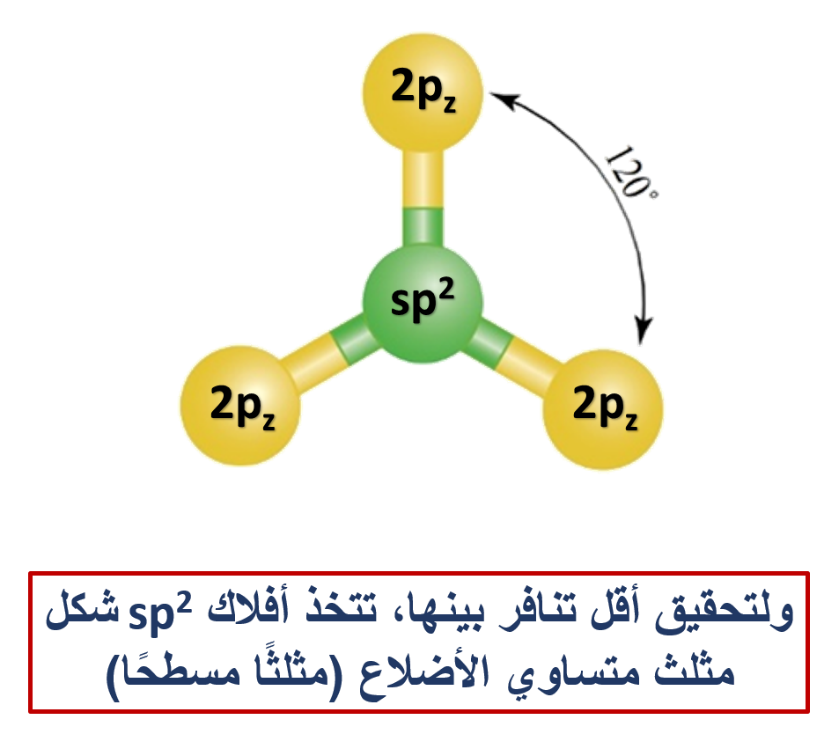
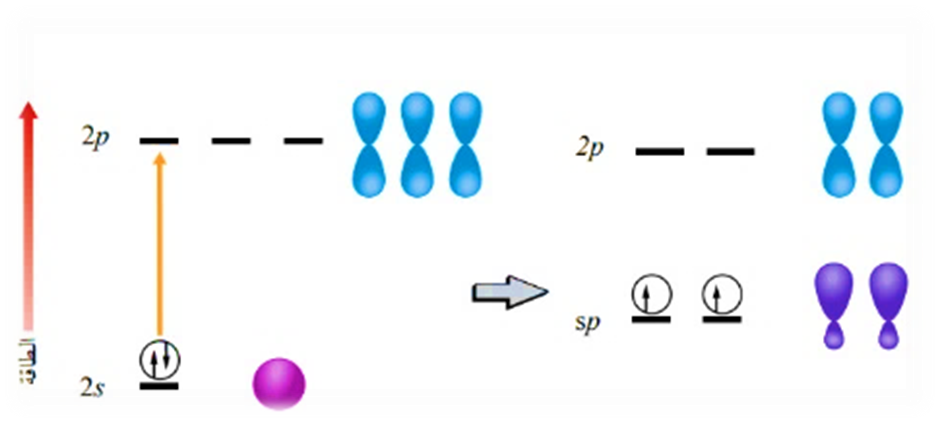
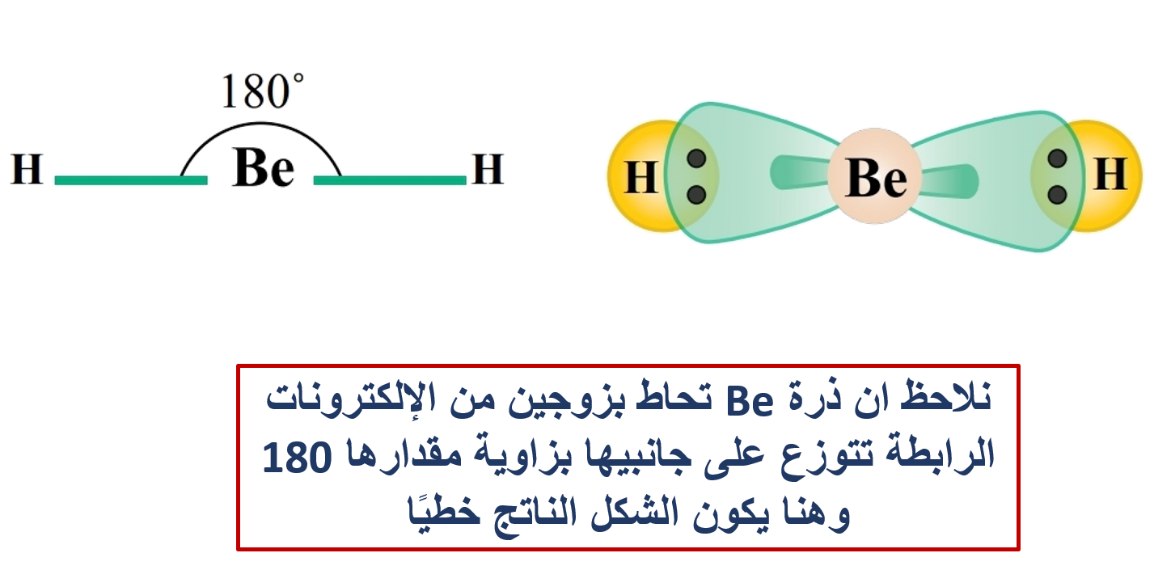
وكمثال آخر أيضًا: هل يستطيع مفهوم تداخل الأفلاك البسيطة تفسير تكوّن الروابط التساهمية بين ذرة البيريليوم Be وذرة الهيدروجين H؟

3- التهجين sp
وينتج من تشارك فلك s مع فلك من p
اتحقق: ما نوع التهجين في الذرات المركزية لكل من الجزيئات (SiCl4 ، BH3 ، BeCl2)؟
والان:
سنحدد قدرة الذرتين التي تشاركت في تكوين الرابطة التساهمية على جذب إلكترونات الرابطة.
وسنكتشف علاقة السالبية الكهربائية للذرة بقدرة النواة على جذب الإلكترونات الرابطة.
فمثلًا: يكون انجذاب زوج الإلكترونات المشترك بين ذرتي الكلور Cl في الجزيء Cl2 متساويًا، فما تفسير ذلك؟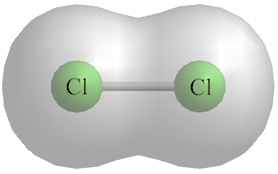
ذلك يعني أن قدرة هاتين الذرتين على جذب إلكترونات الرابطة متساوية؛ بسبب تشابه الذرتين مما يعني أن لها السالبية الكهربائية نفسها.
ولكن: يكون انجذاب زوج الإلكترونات المشترك بين ذرة الكلور Cl و الهيدروجين H في الجزيء HCl نحو ذرة الكلور Cl، فما تفسير ذلك؟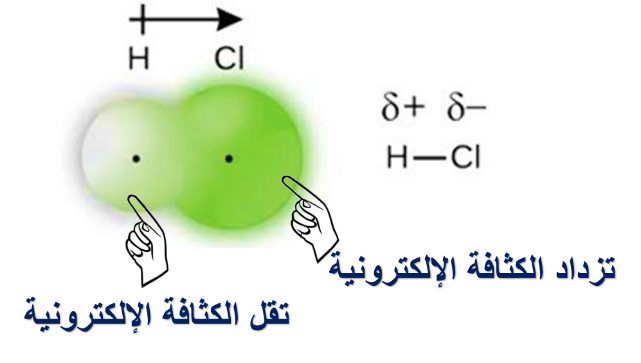
ذلك يعني أن قدرة ذرة الكلور على جذب إلكترونات الرابطة أكبر من قدرة ذرة الهيدروجين والسبب في ذلك يعود إلى أن ذرة الكلور أكثر سالبية كهربائية من ذرة الهيدروجين.
كما نلاحظ أن للرابطة قطبين (قطب يحمل شحنة جزيئية موجبة) و (قطب يحمل شحنة جزيئية سالبة) ؛ لذلك تسمى هذه الرابطة برابطة قطبية.
⦿ على ماذا تعتمد قطبية الرابطة؟
من المثالين السابقين:

تعتمد قطبية الرابطة على الفرق في السالبية الكهربائية بين الذرتين المكونتين للرابطة.
حيث تزداد القطبية بزيادة الفرق بالسالبية الكهربائية بين الذرتين.
وفق مقياس باولنج
"تكون الرابطة غير قطبية إذا قل فرق السالبية الكهربائية بين الذرتين عن 0.4"
وبسبب وجود الروابط القطبية في الجزيئات فإن هذه الجزيئات من الممكن أن تكون قطبية، أي أنها تمتلك عزمًا قطبيًا.
⦿ فماذا نقصد بالعزم القطبي؟
هو مقياس كمي لمدى توزع الشحنات في الجزيء ويعتمد على المسافة الفاصلة بين الشحنات على طرفي الجزيء.
ويقاس بوحدة الديباي (D)
* أما بالنسبة للجزيئات المتعددة الذرات
فإن وجود عزم قطبي إضافة لقطبية روابطه، يعتمد على الشكل الفراغي للجزيء التي نعاملها كقوى متجهة ذات مقدار واتجاه.
●إذا كانت محصلة العزوم القطبية للجزيء = صفر يكون الجزيء غير قطبي
●إذا كانت محصلة العزوم القطبية للجزيء ≠ صفر يكون الجزيء قطبي
مثال (1):
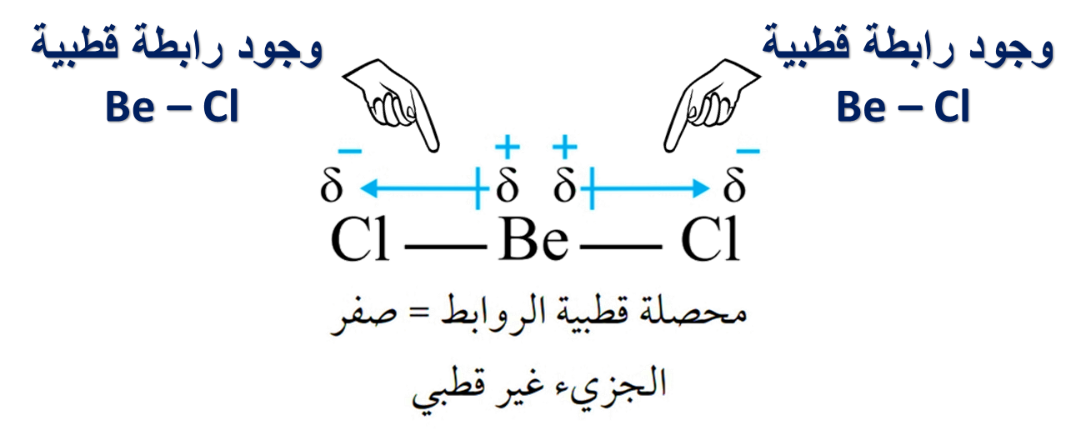
متعاكستان ولهما نفس المقدار، فتلغي بعضها البعض وبالتالي المحصلة = صفر
من المثال السابق نستنتج أن: قطبية الرابطة ليس شرطًا كافيًا ليكون الجزيء قطبي.
مثال(2):
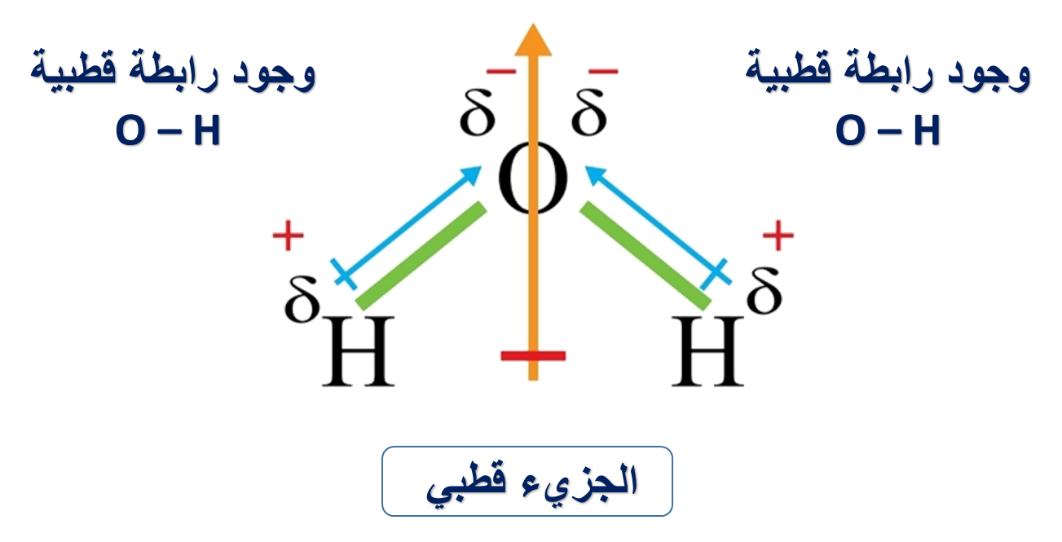
قطبية روابطه لا تلغي بعضها البعض؛ بسبب شكله الفراغي المنحني وبالتالي المحصلة ≠ صفر
* أثر أزواج الإلكترونات غير الرابطة في قطبية الجزيء
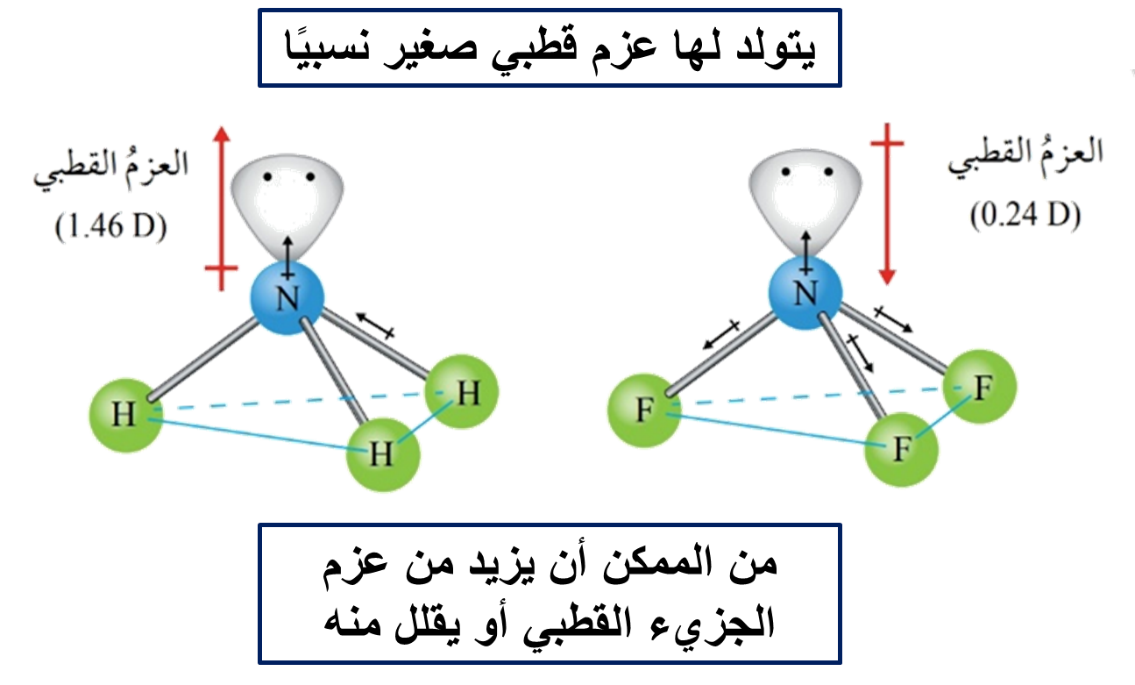
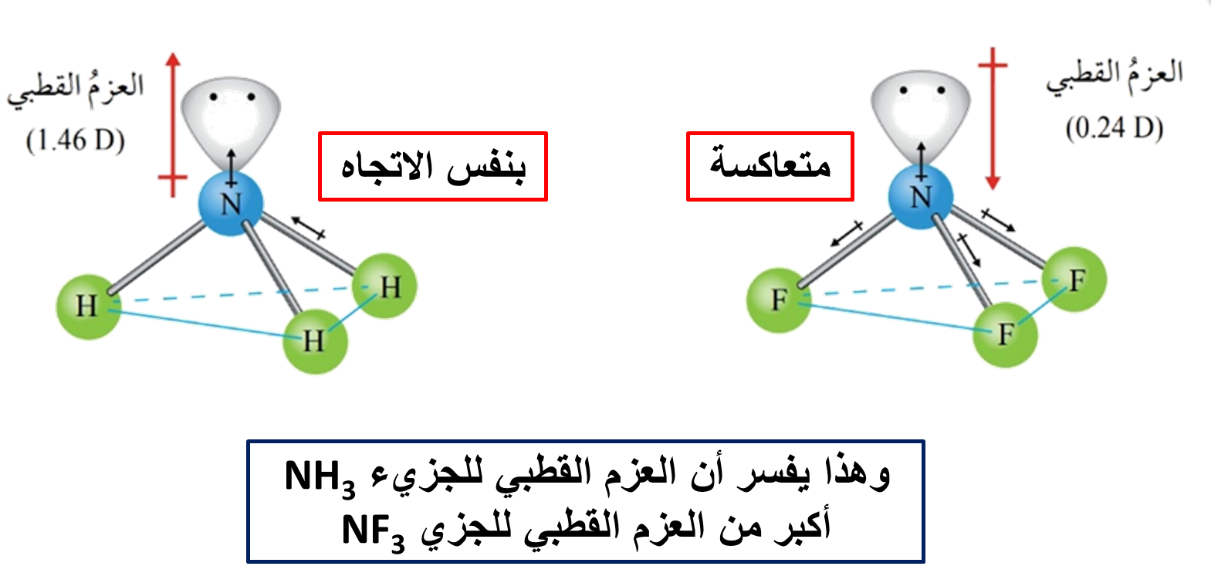

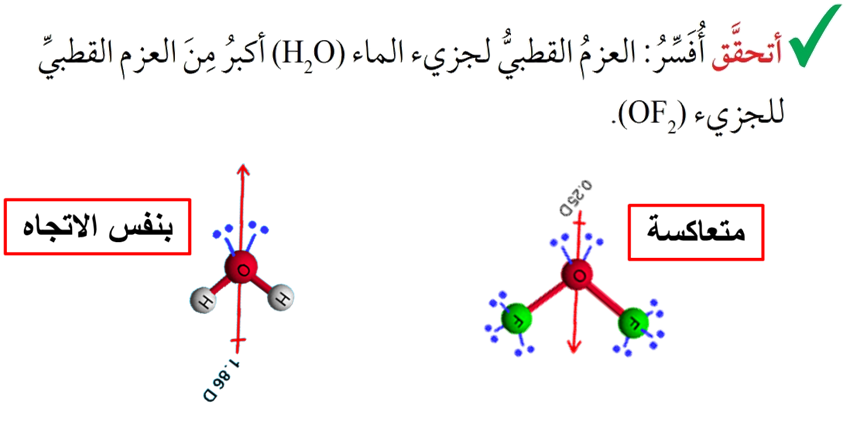
بسبب وجود الإلكترونات غير الرابطة فإنه يتولد لهما عزم قطبي صغير نسبيًا يتجه بعيدًا عن النواة؛ وبما أن هذا العزم القطبي في الماء بنفس اتجاه محصلة العزوم القطبية في جزيء الماء فإنه يزيد من العزم القطبي للجزيء، بعكس جزيء OF2 الذي يكون فيه العزم المتولد بسبب وجود الإلكترونات غير الرابطة بعكس اتجاه محصلة عزوم القطبية مما يقلل من العزم القطبي للجزيء بمقارنة بالماء.