المادة المحدّدة للتفاعل
درسنا سابقًا
كيفيّة إجراء الحسابات الكيميائية بمعرفة كميّة إحدى الموادّ المُتفاعِلة أو الناتجة وفق النسبة المولية التي تُحدّدها المعادلة الموزونة.
السؤال: ماذا يحدث عند خلط كميات معلومة من الموادّ المُتفاعِلة بنسبة موليّة تختلفُ عن النسبة التي تُحدّدها المعادلة الموزونة؟
الإجابة: عند خلطِ كميّاتٍ معلومة من موادَّ مُتفاعِلة بنسبةٍ لا تتطابق مع نسبها المولية في المعادلة الموزونة؛ فمن النادر أن تُستهلَكَ جميعُ كميات الموادّ أثناءِ التفاعُل.
والسؤال الآن: متى يتوقّفُ التفاعُل؟ وما المادة التي تُحدّد نهايته؟
يتوقّف التفاعُل باستهلاك كميّة إحدى الموادّ المُتفاعِلة كُلّيًا
♯ حيث أن المادّة المُتفاعِلة التي تُستهلك كُلّيًا في التفاعُلِ هي التي تُحدد كمية المادة الناتجة ونهاية التفاعل.
* فماذا يطلق على هذه المادة المتفاعلة؟
المادّة المُحدّدة للتفاعُل
وعلى ذلك نستنتج أن:
المادّة المُحدّدة للتفاعُل: هي المادّة المُتفاعِلة التي تُستهلك كُلّيًا في التفاعُلِ وتُحدد كمية المادة الناتجة.
◄ في حين تتبقّى كميةٌ زائدةٌ من مادّة مُتفاعِلة أخرى أو أكثر لم تستهلك كُلّيًا في أثناء التفاعُل تُسمّى المادةَ الفائضة
◄ مثال:
يتفاعُل غازا الهيدروجين والأكسجين كما في المعادلة الآتية:
2H2(g) + O2(g) → 2H2O(g)
يتبيّنُ من المعادلة الموزونة أنه عندما يتفاعل 2mol من الهيدروجين مع 1mol من الأكسجين، فإنّهما يُستَهلكان كلِّيًّا ويتوقّف التفاعُل.
وبهذا تكونُ المادتان كلاهُما محدّدتين للتفاعُل
- ولكن أيُّ المادتين ستكونُ المادةَ المُحدّدة للتفاعُل؛ إذا تفاعل10 mol من الهيدروجينِ مع7mol من الأكسجين؟
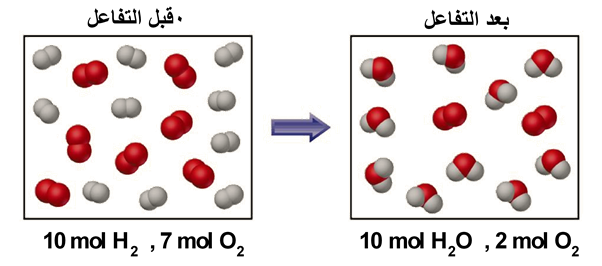
نلاحظ أنه:
- تستهلك جميع كمية الهيدروجين أثناء التفاعُل، وبعدها يتوقّف التفاعُل؛ وبهذا يكون الهيدروجين هو المادة المُحدّدة للتفاعُل
- وفي المقابل يتبقّى2 mol من الأكسجين دون أن تتفاعُل بسبب استهلاكِ كمية الهيدروجين كُلّها؛ ويكون الأكسجينُ هو المادّة الفائضة في التفاعُلِ.
أمثلة:
1- أيُّ المادتين ستكونُ المادةَ المُحدّدة للتفاعُل؛ إذا تفاعل 3mol من النيتروجينِ مع6mol من الهيدروجين؟
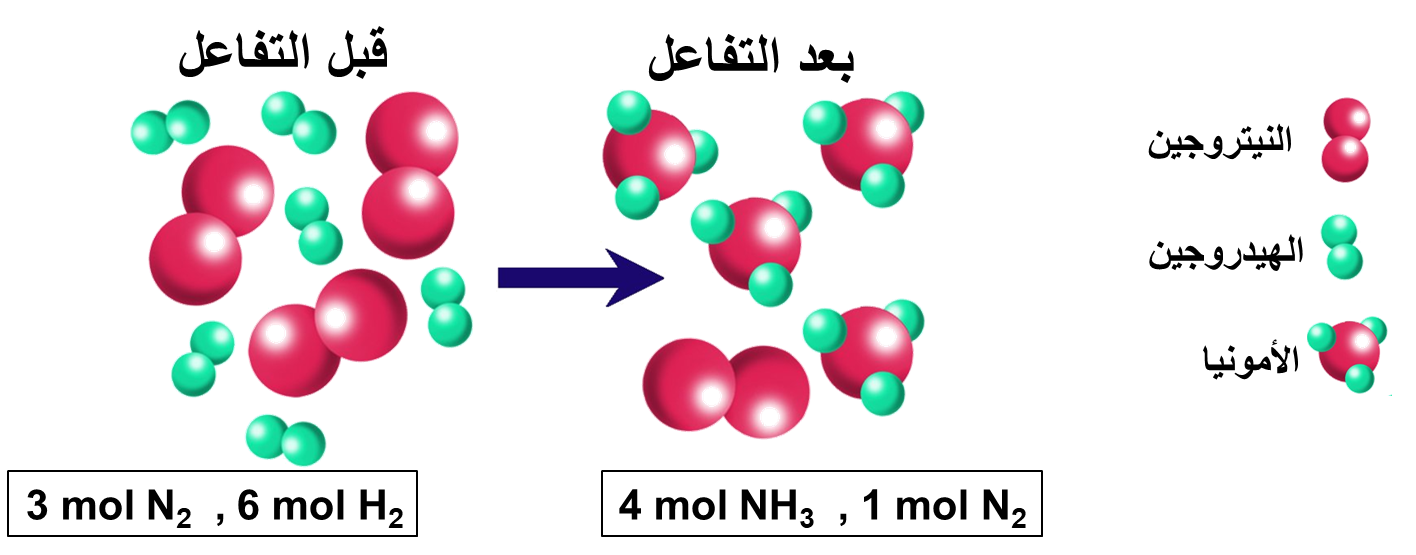
يستهلك الهيدروجين كليًا؛ وبهذا يكون الهيدروجين هو المادة المُحدّدة للتفاعُل
ويكون النيتروجين هو المادّة الفائضة في التفاعُلِ
2- أيُّ المادتين ستكونُ المادةَ المُحدّدة للتفاعُل؛ إذا تفاعل 6mol من الهيدروجين مع4mol من الكلور؟
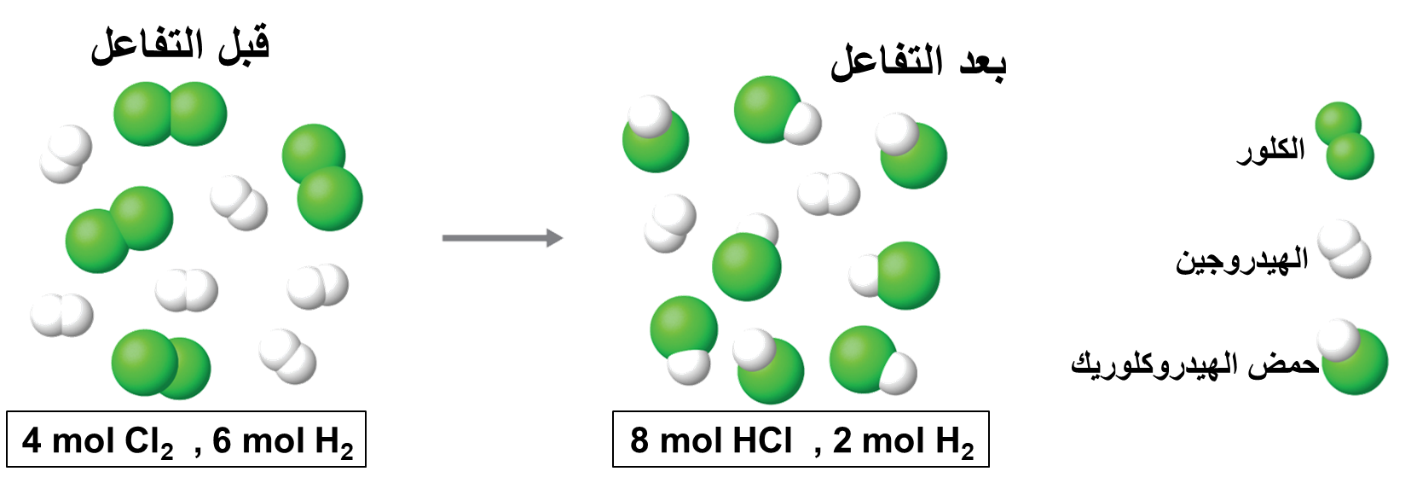
يستهلك الكلور كليًا؛ وبهذا يكون الكلور هو المادة المُحدّدة للتفاعُل
ويكون الهيدروجين هو المادّة الفائضة في التفاعُلِ.
«الحسابات المبنية على المادة المحدّدة للتفاعل»
درسنا سابقًا:
المادّة المُحدّدة للتفاعُل:
وهي المادّة المُتفاعِلة التي تُستهلك كُلّيًا في التفاعُلِ وتُحدد كمية المادة الناتجة.
◄ في حين تتبقّى كميةٌ زائدةٌ من مادّة مُتفاعِلة أخرى أو أكثر لم تستهلك كُلّيًا في أثناء التفاعُل تُسمّى المادةَ الفائضة
كيف يتم تحديد كمية المادة الناتجة للتفاعل؟
تتحدّدُ كميّةُ المادة الناتجة بمعرفة المادة المُحدّدة للتفاعُل التي تُستهلَك تمامًا، فعندَ تفاعُل كميّاتٍ معلومة من موادَّ مُختلفةٍ؛ فإنّه لابدّ من معرفة المادة المُحدّدة للتفاعُل.
كيف يتم معرفة كمية المادة المحدّدة؟
♯ يجري ذلك عن طريق حساب عدد المولات الفعلية للمواد المتفاعلة ومقارنتِها بنسبتها المولية من المعادلة الموزونة.
"وبمعرفة كتلة المادّةِ المُحدّدة للتفاعُل؛ فإنّه يُمكن حساب كتل المواد الفعلية المتفاعلة والناتجة."
- أمثلة:
1- أُضيفُ8mol من البوتاسيوم K إلى5mol من غاز الكلورCl2 للتفاعُل وفقَ المعادلة الموزونة: 2K(s) + Cl2(g) → 2KCl(s)
أ . أستنتجُ المادة المُحدّدة للتفاعُل.
أولًا: أُحدّدُ النسبةَ الموليّة بينَ K Cl2 و من المعادلة الموزونة:
ثانيًا: أحسبُ عدد مولاتِ (n) البوتاسيوم K اللازمةِ للتفاعُل؛ اعتمادًا على مُعطيات السؤال:
عدد المولات المطلوبة للتفاعُل = النسبة المولية × عدد المولات المتوفرة
Moles needs = mol ratio × moles available
وبهذا فإنّ عدد مولات البوتاسيومK المطلوبةِ للتفاعُل 10 mol ، وعدد المولات المتوفرة8 mol ، وهي أقلّ ممّا يلزم للتفاعُل، فإنّ البوتاسيوم K هو المادة المُحدّدة للتفاعُل.
والكلور Cl2المادة الفائضة.
ب. أحسب عدد مولات المادّةِ الناتجة.
2K(s) + Cl2(g) → 2KCl(s)
بالاعتمادِ على المادة المُحدّدة للتفاعُل وهي البوتاسيوم K:
8
2- يحترقُ غازُ الإيثينِ بوجود الأكسجين احتراقًا تامًّا؛ وفقَ المعادلة الكيميائيّة الموزونةِ الآتية:
C2H4(g) + 3O2(g) → 2CO2(g) + 2H2O(g)
فإذا أضيف 18.7g من غاز الإيثين C2H4 إلى7.4 g من غاز الأكسجين O2 أستنتجُ المادةَ المُحدّدة للتفاعُل؟
علمًا أن الكتل المولية بوحدة g/mol هي: (= 32 (C2H4 = 28 , O2
الإجابة:
♯ نتذكر: كيفية حساب عدد المولات بمعرفة الكتلة؛ من خلال العلاقة:
◄ أحُدّد النسبةَ الموليةّ للمواد المُتفاعلِة من المعادلة الموزونة:
C2H4(g) + 3O2(g) → 2CO2(g) + 2H2O(g)
◄ أحسبُ عدد مولاتِ الأكسجين اللازمة للتفاعُل:
عدد المولات المطلوبة للتفاعُل = النسبة المولية × عدد المولات المتوفرة
Moles needs = mol ratio × moles available
مطلوبة متوفرة
وبهذا فإنّ عدد مولات الأكسجين المطلوبةِ للتفاعُل 2.01 mol ، وعدد المولات المتوفرة0.23 mol ، وهي أقلّ ممّا يلزم للتفاعُل، فإنّ الأكسجين هو المادة المُحدّدة للتفاعُل.
والإيثين C2H4 المادة الفائضة.
3- أضيف 50g من الفسفور الأبيض P4إلى100g من غاز الأكسجينO2 لإنتاج الاُكسيد P4O10 وفقَ المعادلةِ الكيميائية الموزونة الآتية:
P4(s) + 5O2(g) → P4O10(s)
* علمًا أن الكتل المولية بوحدة g/mol هي: (= 32 , P4 = 124 (P4O10 = 284 , O2
أ . أحسبُ كتلةَ المادة الناتجة؟
أولًا: أحسبُ عدد مولاتِ كلّ مادة مُتفاعِلة
ثانيًا: أُحدّدُ النسبةَ الموليةَ للمواد المُتفاعِلة من المعادلة الموزونة
P4(s) + 5O2(g) → P4O10(s)
ثالثًا: أحسبُ عدد مولاتِ الأكسجين اللازمة للتفاعُل
عدد المولات المطلوبة للتفاعُل = النسبة المولية × عدد المولات المتوفرة
Moles needs = mol ratio × moles available
رابعًا: نحدّد المادة المحدّدة للتفاعل
مطلوبة متوفرة
المادة المحدّدة للتفاعل هي P4
المادة الفائضة هي O2
خامسًا: أحسبُ عدد مولاتِ المادة الناتجة
بالاعتمادِ على المادة المُحدّدة للتفاعُل وهي الفسفور P4
سادسًا: أحسبُ كتلة المادة الناتجة
ب. أحسبُ كتلةَ المادة الفائضة؟
المادة الفائضة هي O2
أولًا: أحسبُ عدد مولاتِ المادة الفائضة التي تفاعلت وذلك بدلالة عدد مولاتِ المادة المُحدّدة للتفاعُل
ثانيًا: أحسبُ الكتلة التي تفاعلت:
ثالثًا: أحسبُ الكتلة الفائضة:
ج. أحسبُ: المردود المئويّ للتفاعُل علمًا أن المردود الفعلي له 84.6 g؟
إجابات التجربة الإثرائية (كتاب الأنشطة) - المادة المحددة للتفاعل
اسئلة التفكير:
السؤال الأول: يمثل الشكل الآتي تفاعلا كيميائيا لمحاليل مختلفة. أجيب عن الأسئلة التي تليه:
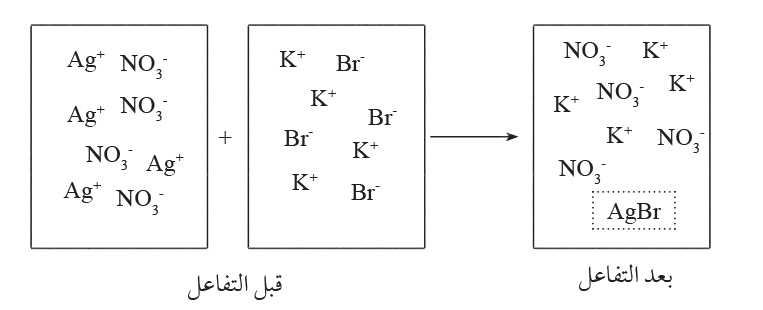
1. أستنتج المعادلة الكيميائية الموزونة لهذا التفاعل.
الإجابة:
2 . أتوقع اسم هذا النوع من التفاعلات.
الإجابة: (إحلال مزدوج) (ترسيب)
3 . أكتب معادلة أيونية نهائية للتفاعل.
الإجابة:
السؤال الثاني: في الشكل الآتي تمثل المثلثات عنصر X والدوائر عنصر Y أجيب عن الأسئلة التي تليه:
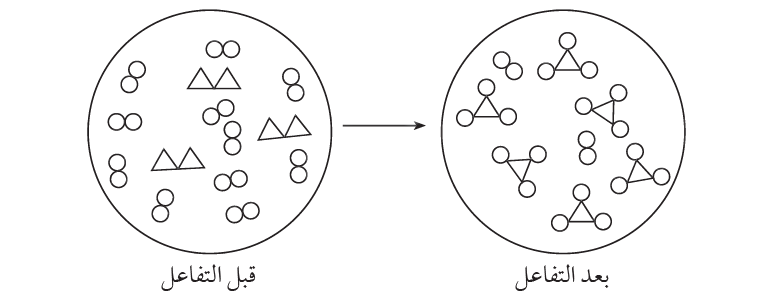
1 . أستنتج المعادلة الكيميائية الموزونة لهذا التفاعل.
الإجابة:
2. أستنتج المادة المحددة للتفاعل، والمادة والفائضة عنه.
الإجابة:
المادة المحددة X2 والمادة الفائضة Y2