مفهومُ الاتّزان الكيميائي
يحترقُ شريط من المغنيسيوم Mgفي جوٍّ من الأكسجين O2 وينتجُ أكسيد المغنيسيوم MgO وكميةٌ كبيرة من الحرارة، وينتهي التفاعُل باحتراق شريط المغنيسيوم كلِّيًّا.
2Mg(S) + O2(g) → 2MgO(S) + Heat
ولا يمكن إعادة تكوين أيٍّ من الموادّ المُتفاعِلة مرةً أخرى في أثناء التفاعُل.
فماذا يعني ذلك؟
يعني أن التفاعُل يسير باتّجاهٍ واحدٍ نحو تكوين المواد الناتجة
ويتّضحُ من المعادلة أن السهم يشير إلى اتّجاه سير التفاعُل
ويطلق على هذا النوع من التفاعلات: التفاعُلات غير المنعكسة
نتوصل إلى أن:
التفاعُلات غير المنعكسة Irreversible Reactions : تفاعُلاتٌ تسري باتجاه واحد نحو تكوين الموادّ الناتجة.
والسؤال الآن: هل تحدثُ جميع التفاعُلات وتنتهي باستهلاك إحدى المواد المُتفاعِلة أو جميعها كلِّيًّا؟

يجري هذا التفاعل في وعاء مغلق لا يسمحُ بفقدانِ أي كمية من الموادّ المُتفاعِلة أو الناتجة من وعاء التفاعُل، ممّا يتيحُ حدوث تفاعُل بين الموادّ الناتجة، ويجعلُ التفاعُل يحدث باتّجاهين متعاكسين.
فعند بدايةِ التفاعُل تتفاعُل الموادّ المُتفاعِلة فيما بينها وتتكوّنُ الموادُّ الناتجة؛ ويُطلَقُ على هذا التفاعُل اسم: التفاعُل الأماميّ
وبمجرد أن تتكوّن المواد الناتجة فإنّها تبدأ بالتفاعُل معًا وتُعيد تكوين المواد المُتفاعِلة مرّةً أخرى؛ ويُطلَقُ على هذا التفاعُل اسم: التفاعُل العكسي
مثال:
يتفاعُل غاز النيتروجين N2 مع غازِ الهيدروجين H2 في وعاءٍ مغلق عند ظروفٍ مناسبة من الضغط ودرجة الحرارة، ويؤدّي ذلك إلى تكوين غازِ الأمونيا NH3 ، في ما يُعرَف بالتفاعُل الأماميّ.
N2(g) + 3H2(g) → 2NH3(g)
وعندما يتكوّن غاز الأمونيا NH3 في وعاء التفاعُل فإنّه يبدأُ بالتفكُّك ويتكون كلٌّ من غاز النيتروجين N2 وغاز الهيدروجين H2 في ما يعرفُ بالتفاعُل العكسي.
2NH3(g) → N2(g) + 3H2(g)
نستنتج مما سبق:
أن وعاءَ التفاعُل يحتوي على كميات مختلفة من المواد المُتفاعِلة والناتجة في الوقت نفسه ويُسمّى هذا النوع من التفاعُلاتِ: التفاعُلات المنعكسة
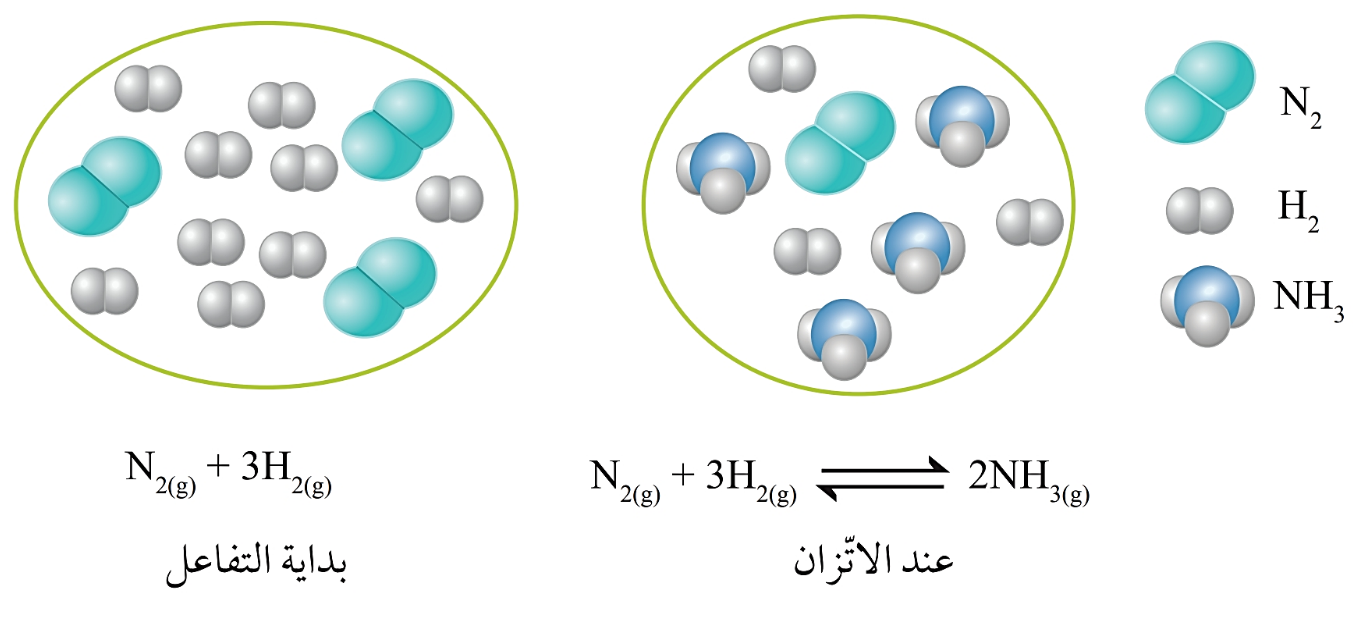
فماذا نقصد بمفهوم التفاعُلات المنعكسة؟
•التفاعُلات المنعكسة:Reversible Reaction تفاعُلات تحدث بالاتجاهين الأماميّ والعكسي في الوقت نفسه.
حيث:
التفاعل الأماميّ ويشار إليه في المعادلة بسهمٍ باتّجاه اليمين →
والتفاعل العكسي ويشار إليه في المعادلة بسهمٍ باتّجاه اليسار ←
و حيثُ:
في المعادلة الكيميائية يُكتب فيها سهمان باتّجاهين (متعاكسين) ⇌
◄ علاقة تركيز المواد المتفاعلة في سرعة التفاعل الكيميائي:
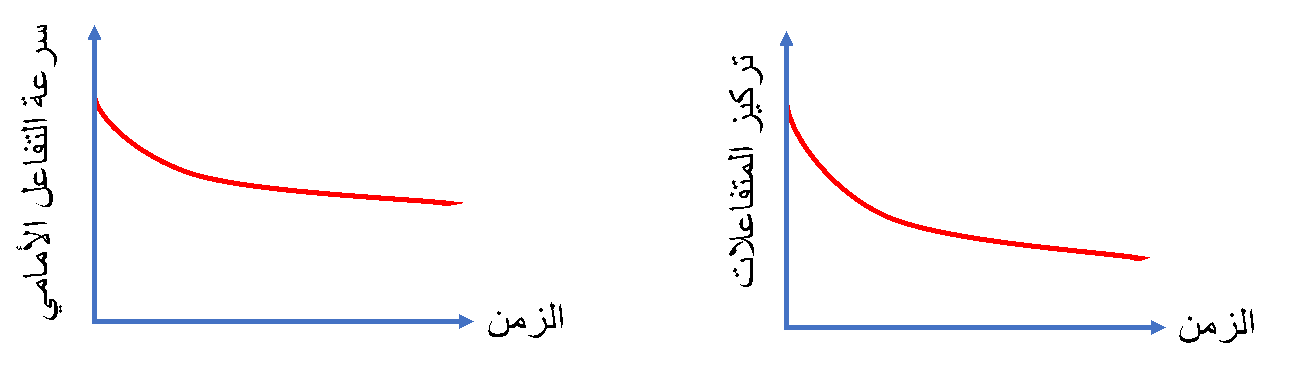
تشير التجارب الكيميائية إلى أنه في البداية تكون تراكيز المواد المتفاعلة أكبر ما يمكن وبهذا تكون سرعة تفاعلها وتحولها إلى مواد ناتجة أعلى ما يمكن
سرعة التفاعل الأمامي
وبمرور الوقت تتناقص تراكيز المواد المتفاعلة وبذلك تتناقص سرعة التفاعل الأمامي
◄ علاقة تركيز المواد الناتجة في سرعة التفاعل الكيميائي:
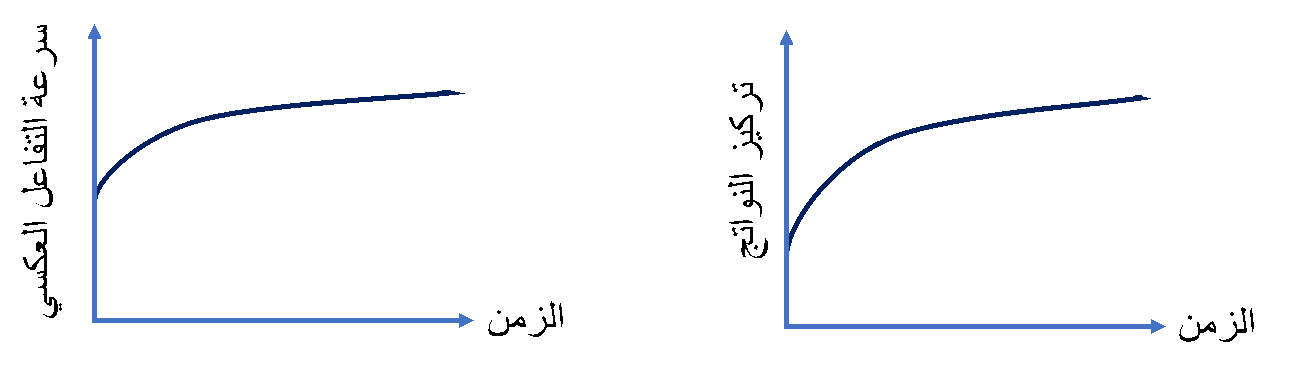
أما المواد الناتجة فتكون تراكيزها عند بداية التفاعل صفرًا
وبمجرد تكونها تبدأ بالتفاعل والتحولِ إلى مواد متفاعلة وبهذا يبدأ حدوث التفاعل العكسي
وبمرور الوقت تزداد تراكيز المواد الناتجة، وبذلك تزداد سرعة تفاعلها وتحولها إلى مواد متفاعلة
سرعة التفاعل العكسي
✓ نتوصل أن علاقة التركيز بسرعة التفاعل، هي علاقة طردية بشكل عام.
♯أما علاقة تركيز المواد المتفاعلة مع الزمن فهي علاقة عكسية.
♯ بينما علاقة تركيز المواد الناتجة مع الزمن فهي علاقة طردية.
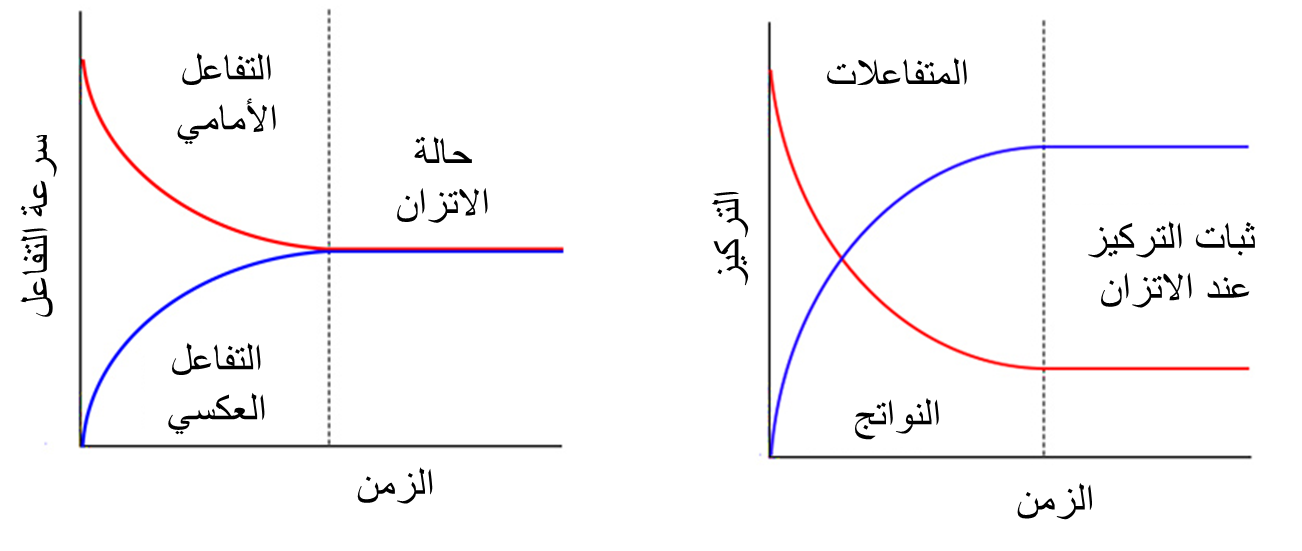
ولكن ماذا يجري حين تصبح سرعة التفاعل الأمامي مساوية لسرعة التفاعل العكسي؟
يصل التفاعل إلى حالة من الاتّزان عندها يستمر حدوث التفاعل بالاتجاهين بالسرعة ذاتها وتثبت تراكيز المواد المتفاعلة والناتجة والخصائص المرتبطة بها مثل الضغط واللون والحجم ودرجة الحرارة، ويوصف التفاعل بأنه في حالة:
الاتّزان الديناميكي
ماذا يقصد بمفهوم الاتّزان الديناميكي؟
•الاتّزان الديناميكي :Dynamic Equilibirium حالة يصل إليها التفاعُل ويستمر عندها حدوث التفاعُل بالاتجاهين الأماميّ والعكسي بالسرعة نفسها.
وللتعرُّف أكثر إلى مفهوم الاتّزان الديناميكيّ:
◄ يُمكن دراسة تفكُّكِ غاز رباعيِّ أكسيد ثنائي النيتروجين N2O4 عديم اللّون إلى غاز ثنائي أكسيد النيتروجين NO2 ذي اللّون البُنيّ المُحمرِّ.
N2O4(g) ⇌ 2NO2(g)
لون بني(مُحمرّ) عديم اللون
يبدأُ التفاعُل الأماميّ بِتحوُّل غازِ رباعيِّ أكسيد ثنائي النيتروجين N2O4 إلى غاز ثنائي أكسيد النيتروجين NO2 بسرعة عالية نسبيًّا، ويُعبّر عن التفاعُل بالمعادلة الآتية:
N2O4(g) →2NO2(g)
وبمرور الوقت، يتناقص تركيز غاز N2O4 وبذلك تتناقص سرعة التفاعل الأمامي.
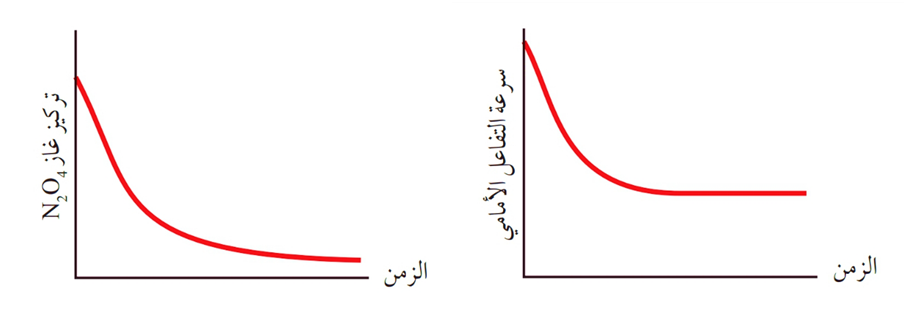
أمّا غاز NO2 ؛ فيكونُ تركيزُه عند بداية التفاعُل صفرًا، وتكون سرعة التفاعل العكسي صفراً أيضًا، وبسبب تفكُّك غاز N2O4 يبدأ تكون غاز NO2 وظهور اللّون البُنيّ في وعاء التفاعُل، ويبدأ حدوث التفاعل العكسي وتحول غاز NO2 إلى الغاز N2O4بسرعة بطيئة نسبيًّا، ويُعبّر عن التفاعُل كما في المعادلة الآتية:
2NO2(g) → N2O4(g)
وبزيادةِ تركيز NO2 في وعاء التفاعُل، تتزايد سرعةُ التفاعُل العكسي تدريجيًّا، وبعد فترة من الزمن تثبت سرعة التفاعل وتثبت تراكيز المواد الناتجة.
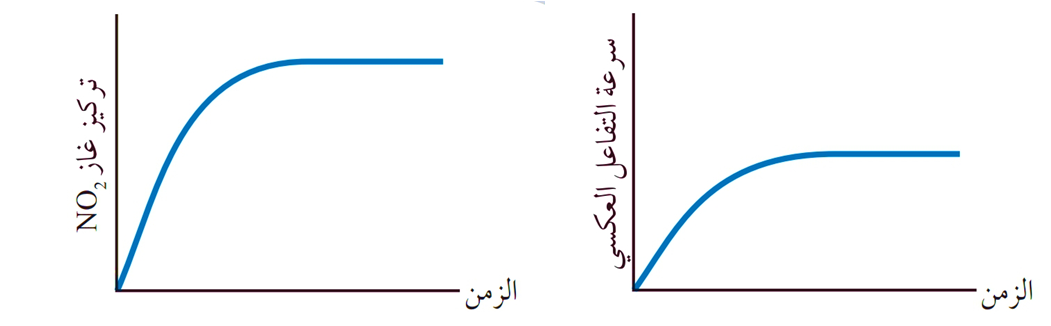
يتضح مما سبق:
أن تراكيز المواد المتفاعلة وسرعة التفاعل الأمامي يتناقصان بمرور الزمن، وفي الوقت نفسه تتزايد تراكيز المواد الناتجة وتتزايد سرعة التفاعل العكسي،
إلى أن يصل التفاعل إلى حالة الاتّزان حيث تصبح سرعة التفاعل الأمامي مساوية لسرعة التفاعل العكسي، وعندها تثبت تراكيز المواد المتفاعلة والناتجة.
العواملُ المؤثّرة في الاتّزان
يمكن للتفاعل أن يُكوِن المواد الناتجة بنسبة أكبر من المواد المتفاعلة.
ويَكونْ الاتزان مزاحاً جهة المواد الناتجة.

كما يمكن للتفاعل أن يُكوِن المواد المتفاعلة بنسبة أكبر من المواد الناتجة.
ويَكونْ الاتزان مزاحاً نحو المواد المتفاعلة

موضع الاتّزان : Equilibrium Position حالة الاتزان التي تكون عندها نسبة المواد الناتجة أكبر من المواد المتفاعلة ويَكونْ الاتزان مزاحاً جهة المواد الناتجة، أو تكوِن نسبة المواد المتفاعلة أكبر من المواد المتفاعلة ويَكونْ الاتزان مزاحاً نحو المواد المتفاعلة.
يُمكن التحكم بموضع الاتّزان بإزاحته نحو اليمين لزيادة كمية المواد الناتجة، أو إزاحته نحو اليسار لتقليل كمية المواد الناتجة وزيادة كمية المواد المُتفاعِلة.
وذلك عن طريق التحكُّم بمجموعة من العوامل
فما هذه العوامل؟ وكيف تُؤثّر في موضع الاتّزان؟
✓ مبدأ لوتشاتلييه :
"إذا حدث تغييرٌ في أحد العوامل المؤثّرة في الاتّزان لتفاعُل كيميائي مُتّزنٍ، مثل التركيز، أو الضغط، أو درجة الحرارة؛ فإنّ التفاعُلَ يعملُ على تعديل موضع الاتّزان للتّقليلِ من أثر ذلك التغيير "
وتوصَّل إلى أنه يمكن التحكُّم بموضِع الاتّزان للتفاعُل عبر التحكم بظروف التفاعُل من: تركيزٍ أو ضغطٍ أو درجةِ حرارة
فكيف يتم التحكُّم بالعوامل المؤثرة في الاتّزان؟
التركيز
يتأثّرُ موضع الاتّزان بتغيير كميات الموادّ أو تراكيزِها في وعاء التفاعُل عند درجة الحرارة نفسِها؛ إذْ يُؤدّي تغيير تركيز مادة مُتفاعلةٍ أو ناتجة إلى اضطراب في حالة الاتّزان ما يدفع التفاعُل إلى تعديلِ وضعه للوصول إلى حالة الاتّزان من جديد.
فكيف يحصل ذلك؟
يحصل ذلك بتغيير موضع الاتّزان بإزاحته جهة اليمين (نحو تكوين المواد الناتجة)، أو جهة اليسار (نحو تكوين المواد المُتفاعلة)؛ للتّقليلِ من أثر ذلك التغيير، ثم يعود التفاعُل إلى حالة الاتّزان من جديد.
فمثلًا:
يتفكّكُ خماسي كلوريد الفسفور PCl5 في وعاء مغلقٍ، وينتجُ غاز ثلاثي كلوريد الفسفور PCl3 وغاز الكلورCl2 ، ويصل التفاعُل إلى حالة الاتّزان كما في المعادلة الآتية:
PCl5 (g) ⇌ PCl3(g) + Cl2(g)
وعند إضافة كمية من غازPCl5 فإنّ تركيزَهُ يزداد في وعاء التفاعُل ويختل الاتّزان، ووفقًا لمبدأ لوتشاتلييه يعملُ التفاعُل على تعديلِ موضع الاتّزان وإزاحته جهة اليمين التي تُقلّل من أثر هذه الزيادة، وبالتالي سوف تزداد سرعة التفاعُل الأماميّ كما في المعادلة:
PCl5 (g) PCl3(g) + Cl2(g)
PCl3(g) + Cl2(g)
وبهذا تُستهلك كمية من الغاز المضاف وتتكون كميات جديدة من PCl3 و Cl2 وتزدادُ تراكيزُها، وبمرور الوقت، ونتيجةً لذلك تبدأ سرعة التفاعُل العكسي بالتزايد، وسرعة التفاعُل الأماميّ بالتناقص إلى أن تتساوى السرعتان فيعودُ التفاعُل إلى حالة الاتّزان من جديد، كما في المعادلة:
PCl5 (g) ⇌ PCl3(g) + Cl2(g)
✓ وتحدث التغيُّرات ذاتها فيما لو جرت إزالة كمية من Cl2 أو PCl3 أو سحبها من وعاء التفاعُل.
أمّا عند إضافة كمية من غاز Cl2 إلى وعاء التفاعُل فيزداد تركيزُه، ووفقًا لمبدأ لوتشاتلييه سوف تزداد سرعةُ التفاعُل العكسي للتقليل من أثر هذه الزيادة، ويُزاح موضع الاتّزان جهة اليسار كما في المعادلة:
PCl5 (g)  PCl3(g) + Cl2(g)
PCl3(g) + Cl2(g)
ونتيجةً لذلك تنتج كمية جديدة من غاز PCl5 ويزداد تركيزُه، وبمرور الوقت ونتيجةً لذلك تبدأ سرعة التفاعُل العكسي بالتناقص وسرعة التفاعُل الأمامي بالتزايد، إلى أن تصبح السرعتان متساويتين، يعود التفاعُل إلى حالة الاتّزان من جديد.
PCl5 (g) ⇌ PCl3(g) + Cl2(g)
الضغط
يتأثرُ ضغطُ الغاز المحصور في وعاءٍ مُغلقٍ بحجم الوعاء وأعداد مولات الغازات فيه
يتناسب ضغطُ الغاز عكسيًّا مع حجم الوعاء عند ثبات درجة الحرارة وطرديًّا مع عدد مولاتِ الغاز أو عدد الجزيئات فيزداد ضغط الغاز بزيادة عدد الجزيئات عند ثبات درجة الحرارة.
في حين لا تتأثر المواد الصلبة والمواد السائلة بتغيُّرات الضغط في وعاء التفاعُل.
تُجرى التفاعُلات التي تشتمل على الغازات في أوعية مغلقة لضمان عدم فقدانها أي كمية من الغازات المُتفاعلة أو الناتجة لكي يصلَ التفاعُل إلى حالة الاتّزان
فكيف يمكن تغيير ضغط الغاز في وعاء التفاعل؟
ويمكنُ تغيير ضغط الغاز في وعاء التفاعُل بالتحكم بحجم الوعاء
درجةُ الحرارة
يختلفُ تأثير درجة الحرارة في الاتّزان الكيميائي تبعًا لنوع التفاعُل؛ إذا كان مَاصًّا أم طاردًا للحرارة.
فمثلًا:
يُمكن دراسة أثر تغيير درجة الحرارة لتفاعُل مُتّزنٍ ماصٍّ للحرارةِ مثل تفاعُل تحلُّلِ رباعيِّ أكسيد ثنائي النيتروجين N2O4 كما في المعادلة:
يكونُ التفاعُل في حالة اتّزان عند درجة حرارة الغرفة، ويكون لون خليطِ الغازات في وعاء التفاعُل بُنيًّا باهتًا
وعند تسخين خليط الغازات تزدادُ درجة حرارته، ما يدفعُ التفاعُل إلى تعديلِ موضع الاتّزان ويتّجهُ نحو الجهة التي تستهلك الحرارة الزائدة؛
أي جهة إنتاج NO2 وتزدادُ كميّتُهُ في وعاء التفاعُل وتقلُّ كمية N2O4 ؛ لذا يُلاحظُ حدوثُ زيادةٍ في شِدّة اللّونِ البُنيّ المُحمرِّ، وتستقر شدته بعد مُدة من الزمن، ويصلُ التفاعُل إلى حالة اتّزان جديدة ولا يعود إلى اللون الباهت مرّةً أخرى، ما يعني أن حالة الاتّزان الجديدة وموضعها تختلف عمّا كانت عليه قبل التسخين.
أمّا عند تبريدِ الخليط وخفض درجة حرارته؛
فإنّ التفاعُل يتّجهُ نحو الجهة التي تزيد من إنتاج الحرارة، ويندفع التفاعُل بالاتجاه العكسي، أيْ جهة تكوينN2O4 ، فيزدادُ تركيزُه ويقل تركيز NO2 وبذلك يصبحُ لونُ المحلول مائلً إلى اللَّون الأصفر، ما يعني أن التفاعُل وصل إلى حالة اتّزان جديدة، أي أن الاتّزان وموضعه أُزيحَ نحو المواد المُتفاعلة.
إجابات التجربة الاستهلالية (كتاب الأنشطة) - تسامي اليود
التحليل والاستنتاج:
1. أوضح التغيُّرات التي تطرأ على بلورات اليود الصلب، وأسمِّي هذه العملية.
تتحول بلورات اليود الصلب الى الحالة الغازية (بخار اليود) عند وضعها في حمام الماء الساخن، وتسمى هذه العملية التسامي.
2 . أحدد لون بخار اليود المتصاعد.
يتخذ بخار اليود اللون البنفسجي.
3. أوضح التغيرات التي طرأت على بخار اليود بمرور الوقت، وأسمِّي هذه العملية.
يتجمع بخار اليود على شكل بلورات صلبة على زجاجة الساعة المحتوية بلورات الجليد نتيجة عملية التبريد وتسمى هذه العملية الترسب.
4 . أفسر ثبات لون بخار اليود في الكأس الزجاجية.
يثبت لون بخار اليود بعد فترة من الزمن لأن كمية اليود الصلب المتبخرة تساوي كمية بخار اليود المترسبة فلا يتغير عندها لون بخار اليود في الكأس الزجاجي.
5. أستنتج العلاقة بين ما يحدث لبلورات اليود، وما يحدث لبخاره عند ثبات اللون في الكأس الزجاجية.
تحدث عملية التسامي بسرعة مساوية لسرعة عملية الترسب، وتوصف العمليتين بأنهما في حالة اتزان.
إجابات التجربة (1) (كتاب الأنشطة) - أثر التركيز على موضع الأتزان
التحليل والاستنتاج:
1 . أحدد لون المحلول الناتج من إضافة محلول كلوريد الحديد إلى محلول ثيوسينات الأمونيوم.
يكون لون المحلول أحمر دموي أو بني محمر.
2 . أحدد المادة التي أدت إلى تغيير لون المحلول عند إضافة قطرات من محلول كلوريد الأمونيوم إلى الأنبوب الأول، وقطرات من محلول كلوريد الحديد إلى الأنبوب الثاني.
الأنبوب الأول: كلوريد الحديد ذات اللون البني الباهت.
الأنبوب الثاني: ثيوسيانات الحديد ذات اللون البني المحمر.
3. أفسر أثر تغيير تراكيز المواد على موضع الاتزان وفق مبدأ لوتشاتلييه.
عند زيادة تركيز إحدى المواد المتفاعلة تزداد سرعة التفاعل الأمامي ويزاح موضع الاتزان نحو تكوين المواد الناتجة (جهة اليمين) وعند زيادة تركيز إحدى المواد الناتجة تزداد سرعة التفاعل العكسي ويزاح موضع الاتزان نحو تكوين المواد المتفاعلة (جهة اليسار).
4 . أستنتج العلاقة بين تغيُّر لون المحلول وتراكيز المواد في وعاء التفاعل.
عند زيادة تركيز المادة يطغى لونها على لون المحلول، أي أن لون المحلول يميل نحو لون المادة الأكثر تراكيز في المحلول.
إجابات التجربة (2) (كتاب الأنشطة) - أثر درجة الحرارة موضع الأتزان
التحليل والاستنتاج:
1. أستنتج أثر زيادة درجة الحرارة على تراكيز كلٍّ من الغازين في الدورق.
تؤدي زيادة درجة الحرارة إلى زيادة تركيز NO2 ونقصان تركيز N2O4
2. أفسر تغيُّر لون الغاز في الدورق الموضوع في الماء الساخن، والموضوع في الماء البارد مقارنة بالدورق رقم ( 1).
حالة الماء الساخن: تزداد شدة اللون البني وذلك بسبب إزاحة موضع الاتزان نحو تكوين غاز NO2 ذو اللون البني.
حالة الماء البارد: تقل شدة اللون البني وذلك بسبب إزاحة موضع الاتزان نحو تكوين غاز N2O4 عديم اللون.
3. أفسر أثر درجة الحرارة على كلٍّ من التفاعلين الأمامي والعكسي.
حيث أن التفاعل طارد للحرارة فان زيادة درجة الحرارة تزيد سرعة التفاعل العكسي ويزاح موضع الاتزان نحو اليسار. أما خفض درجة الحرارة فيزيد سرعة التفاعل الأمامي ويزاح موضع الاتزان نحو اليمين.
4 . أستنتج أثر درجة الحرارة على الاتزان للتفاعل الماصِّ للحرارة والتفاعل الطارد لها.
| زيادة درجة الحرارة | خفض درجة الحرارة | حالة الاتزان | |
| التفاعل الطارد | يزاح موضع الاتزان نحو اليسار | يزاح موضع الاتزان نحو اليمين | اتزان جديد يختلف عما سابقه |
| التفاعل الماص | يزاح موضع الاتزان نحو اليمين | يزاح موضع الاتزان نحو اليسار | اتزان جديد يختلف عما سابقه |
إجابات التجربة الإثرائية (كتاب الأنشطة) - تغير موضع الأتزان
التحليل والاستنتاج:
1. أوضح أثر إضافة محلول حمض الهيدروكلوريك على تراكيز الأيونات في المحلول وموضع الاتزان.
يؤدي الى إزاحة موضع الاتزان نحو اليمين، فيقل تركيز أيونات+2 [Co(H2O)6] وزيادة تركيز أيونات -2 [Co(Cl)4]
2. أتوقع موضع الاتزان الناتج عن إضافة الماء إلى المحلول.
يؤدي الى إزاحة موضع الاتزان نحو اليسار
3. أفسر التغير في لون المحلول نتيجة إضافة نترات الفضة الى المحلول.
تؤدي إضافة نترات الفضة الى ترسيب أيونات الكلوريد مما يسبب إزاحة موضع الاتزان نحو اليسار ويزداد تركيز أيونات+2 [Co(H2O)6] وبذلك تزداد شدة اللون الزهري في المحلول.
4 . أقارن موضع الاتزان في المحلول الساخن والمحلول البارد.
يزاح موضع الاتزان نحو اليمين في الماء الساخن، ويزاح نحو اليسار في الماء البارد.
5. أستنتج نوع التفاعل؛ إذا كان ماصا للحرار ة أم طاردا لها.
التفاعل ماص للحرارة
إجابات(كتاب الأنشطة) - أسئلة التفكير
السؤال الأول:
أجرى مجموعة من الطلبة تجارب لدراسة موضع الاتزان لثلاثة تفاعلات، تعبر المنحنيات الثلاثة الآتية عن النتائج التي جرى التوصل إليها، أدرس هذه المنحنيات، ثم أجيب عن الأسئلة التي تليها:
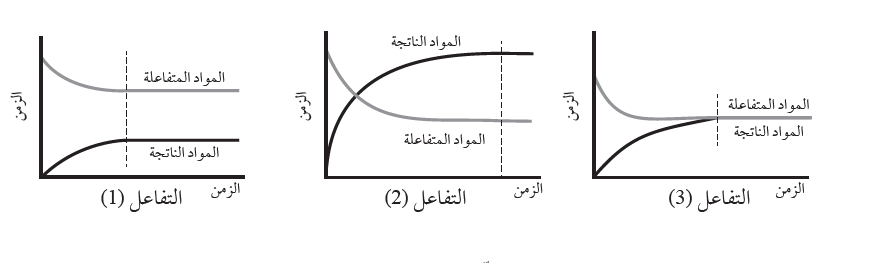
1. أتوقع الجهة التي يزاح نحوها الاتزان لكلٍّ من التفاعلين ( 2,1 ).
التفاعل الأول:المواد المتفاعلة
التفاعل الثاني:المواد الناتجة
2 . أتنبأ بقيم تقريبية لثابت الاتزان لكلٍّ من التفاعلات الثلاثة؛ مدعما تنبُّؤاتي بالبراهين.
التفاعل الأول: kc˂1 ، ودليل ذلك ان تراكيز المواد المواد المتفاعلة أكبر من تراكيز المواد الناتجة.
التفاعل الثاني: kc˃1 ، ودليل ذلك ان تراكيز المواد المواد المتفاعلة أقل من تراكيزالمواد الناتجة.
التفاعل الثالث: kc=1 ، ودليل ذلك ان تراكيز المواد المواد المتفاعلة مساو لتراكيزالمواد الناتجة.
3. أقترح بعض الإجراءات لزيادة كمية المواد الناتجة في التفاعل ( 2).
سحب كمية من المواد الناتجة ، أو زيادة كمية المواد المتفاعلة
السؤال الثاني:
أقارن: المنحنيان المجاوران يمثلان تغيُّرات الطاقة لتفاعلين مختلفين، أدرسهما وأقارن -وفقا لمبدأ لوتشاتلييه- أثر زيادة درجة الحرارة على المردود المئوي لكلٍّ من التفاعلين.
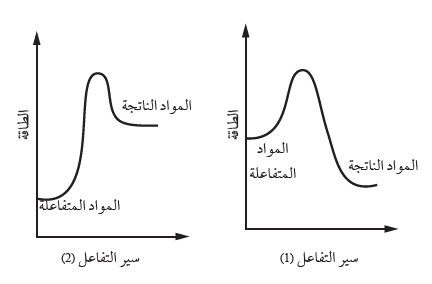
التفاعل (1) : تفاعل طارد للطاقة وبالتالي فان زيادة درجة الحرارة تؤدي الى إزاحة موضع الاتزان نحو تكوين المواد المتفاعلة وتقلل من تركيز المواد الناتجة مما يقلل المردود المئوي للتفاعل.
التفاعل (2) : تفاعل ماص للطاقة وبالتالي فان زيادة درجة الحرارة تؤدي الى إزاحة موضع الاتزان نحو تكوين المواد الناتجة فيزداد تركيزها ويقل تركيز المواد المتفاعلة مما يزيد المردود المئوي للتفاعل.
السؤال الثالث:
يبين الشكل المجاور منحنيات تغيُّر تراكيز المواد في تفاعل ما إلى حين وصوله إلى حالة الاتزان، أدرس المنحنيات ثم أجيب عن الأسئلة الآتية:
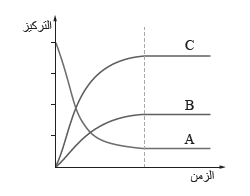
1. أصنّف التفاعل (اتحاد، تحلُّل، إحلال)، وأدعم إجابتي باستخدام البيانات في المنحنى البيانيِّ.
يتضح من المنحنى وجود مادة متفاعلة واحدة (A) ، ومادتين ناتجتين (B, C) ؛ما يعني ان التفاعل هو تحلل المادة A لتكوين المادتين B,C
2. أصف تغيُّر تراكيز المواد من بداية التفاعل إلى حين وصول التفاعل إلى حالة الاتزان.
يقل تركيز المادة A بمرور الزمن الى ان يصل التفاعل الى حالة الاتزان، عندها يثبت تركيزها، أما المادتين B,C فان تراكيزها يزداد بمرور الزمن لحين وصول التفاعل الى حالة الاتزان تثيت تراكيزها.
3. أفسر: بعد بدء التفاعل لا تصبح تراكيز أيٍّ من المواد في التفاعل تساوي صفرا.
لأن التفاعل عند حالة الاتزان يستمر بالحدوث بالاتجاهين الأمامي والعكسي بالسرعة نفسها، أي انه يُكوِّن المواد المتفاعلة باستمرار، وفي الوقت نفسه يُكوِّن المواد الناتجة، ولذلك نجد أن وعاء التفاعل يحتوي على المواد الناتجة والمتفاعلة بنسب متفاوتة، أي أن تركيز أي منها لا يساوي صفرا.
4 . أكتب تعبير ثابت الاتزان للتفاعل؛ بناء على فرضية مفادها أن المواد جميعها في الحالة الغازية.